基于微粒视角分析溶液中的离子反应
2022-08-30浙江刘忠英
浙江 刘忠英
溶液中的离子反应的知识有着理论性强,平衡类型多,影响因素复杂的特点。理解这些知识需要学生建立微粒观念,从微粒之间的作用统摄各类平衡的认识方法,电解质的电离、盐类的水解、离子反应、溶液酸碱性,均是基于微粒作用的观点。微粒浓度等量关系的判断常涉及电离、水解等知识,其中也融合了一些浓度计算问题,使得该类问题变得较为复杂,所以学生遇到此类问题时常会感到无从下手、思维出现混乱,其主要原因是学生没有形成良好的思维习惯或解题模式。该类问题解题模式的训练不能靠大量的习题训练来解决,而应注重思路分析、展现科学思维方法。教师在处理该类问题时,可引导学生写出溶液中存在的粒子种类,进而洞察溶液中微粒之间的关系,最后依据问题要求运用平衡常数或守恒方法来解答。
一、从微粒间的作用认识水溶液中的平衡类型
用粒子间的作用去认识电解质溶液,使学生从感性认识上升到理性认识,从宏观层面的认识深入到微观层面的认识,可以解决学生对溶液中存在的平衡体系判断不清的问题。如有学生认为醋酸溶液中也存在醋酸根的水解平衡,只是程度很小。若从粒子间的作用去看,醋酸溶液中存在的是醋酸分子与水分子之间的作用,醋酸根离子是溶质与溶剂作用的结果,如此才能避免学生的思维出现转圈现象。即溶于水的弱电解质(弱酸、弱碱、含酸式根离子的盐等)存在电离平衡,溶于水且含有弱根离子的正盐溶液中存在水解平衡,难溶电解质在饱和水溶液中存在沉淀溶解平衡。用粒子间的作用去认识电解质溶液也可以从根本上帮助学生厘清一些模糊问题。如学生认为在FeCl3溶液中加入NaOH可以促进水解,因为中和了水解产生的极少量的H+,若从粒子间的作用去看,此过程主要是大量未水解的Fe3+与OH-直接作用生成沉淀,不会促进水解平衡。表1列出了水溶液中三大平衡的微粒间作用比较的情况。

表1 水溶液中溶质和溶剂之间的作用比较
从表中可以看出:水的电离平衡是水分子之间的作用,电离平衡是溶质与溶剂之间的作用,盐类的水解平衡是溶质中的弱酸根或弱碱阳离子与水的作用,这三类平衡共同特点是均有质子的传递。如果溶质内的化学键很强,与水作用很弱,则溶质几乎不电离,存在的形式只有分子,没有离子,则就是非电解质。可见,某物质要被定义为电解质,其溶质分子与水分子之间交换质子的能力应强于水分子之间交换质子的能力,这也就解释了为什么在水溶液中,水是最弱的电解质。溶液呈酸碱性是溶质离子破坏了水的电离,溶质是酸或碱时,与水产生的OH-或H+作用得到水,水的电离平衡被抑制;溶质是含有弱酸根或弱碱根离子的正盐时,与水产生的OH-或H+作用得到弱电解质,水的电离平衡被促进,使得溶液中氢离子和氢氧根离子浓度不相等,从而呈现酸碱性。
【例1】(2020·浙江7月选考·17)下列说法不正确的是
( )
A.2.0×10-7mol·L-1的盐酸中c(H+)=2.0×10-7mol·L-1
B.将KCl溶液从常温加热至80℃,溶液的pH变小但仍保持中性
C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
【参考答案】A

二、从微粒的存在形态判断三大守恒的类型
电解质溶液中电荷守恒、物料守恒、质子守恒关系式是高考的高频考点,要求学生会用三大守恒解决溶液中离子浓度的有关问题。电解质溶液中溶质和溶剂在相互作用的过程中,总有一些恒定不变的量,如溶液中的正负电荷总数相等,溶液中得到质子和失去质子数相等,溶液中非氢非氧原子的总物质的量比值不变。对于三大守恒的运用,不仅要求考生能够写出给定溶液的等量关系,最重要的是会判断某特定的等量关系推导出的源头,因此,需要挖掘三大守恒等式背后的逻辑,辨识三大守恒式中微粒形态的特征,了解三大守恒式的用途,灵活运用三大守恒。当给出溶液中酸碱性时,可以依据电荷守恒以及H+、OH-浓度的大小关系确定其他离子浓度大小关系,表2列出了三大守恒的特征和识别标志。
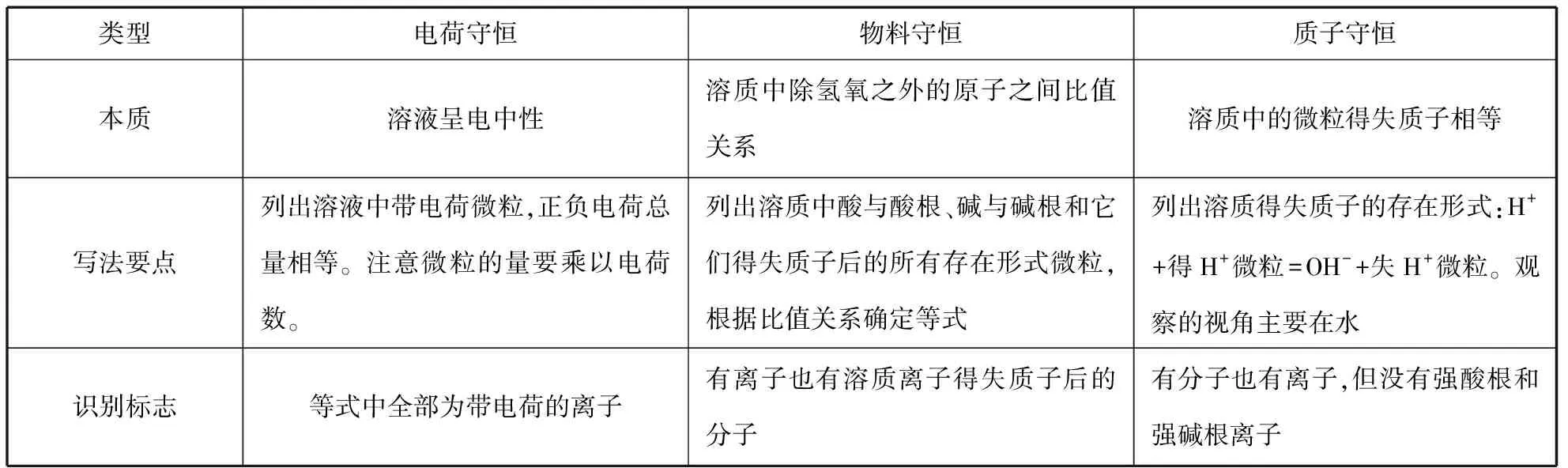
表2 水溶液中三大守恒比较
从表中可以看出,当等式中出现所有离子时则考虑电荷守恒式,当等式中无H+、OH-出现,则考虑物料守恒式,当等式中无金属阳离子出现时则考虑质子守恒式。值得说明的是质子守恒是由于电解质溶液中水分子与溶质粒子之间发生H+转移产生的,故碱溶液中不存在质子守恒。金属阳离子既不能结合H+又不能释放H+,所以质子守恒式中一定不会出现金属阳离子。直接书写质子守恒相对较难,笔者以NaHCO3溶液为例,用图1表示:
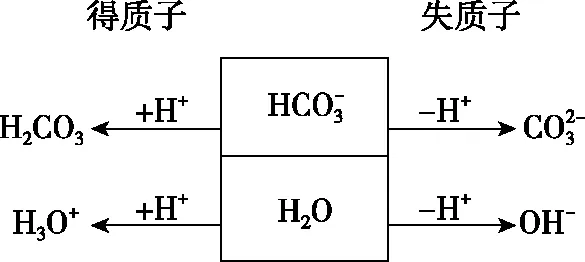
图1

( )
A.0.1 mol·L-1H2A溶液中有c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1
B.当滴加至中性时,溶液中c(Na+)=c(HA-)+2c(A2-),用去NaOH溶液的体积小于10 mL
C.当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有c(A2-)=c(H+)-c(OH-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2-)
【参考答案】B

三、从微粒间的制衡关系推算离子浓度
水的离子积常数、电离平衡常数、水解平衡常数在一定温度下是定值,表达平衡常数的微粒浓度之间量的关系受到常数的制约,故平衡常数是定量判断和计算离子浓度大小的重要工具。以水的离子积常数为例,在一定温度下,除中性溶液以外其他任何溶液中氢离子浓度的变化肯定与氢氧根离子浓度的变化情况相反,稀释任意溶液,不可能使所有离子的浓度均减小。
酸碱的电离平衡常数、盐的水解平衡常数书写中肯定涉及氢离子或氢氧根离子的浓度,在一定温度下,常数表达式中共轭酸碱对离子浓度比值也就受制于溶液的酸碱性。据此可以通过配制一定浓度共轭酸碱对溶液,利用测pH的方法粗略计算电离平衡常数,也可以判断一定pH溶液中共轭酸碱对微粒浓度的相对大小,当溶液中的共轭酸碱对微粒浓度相等时,pH与pKa值也相等。以氨水的电离平衡常数为例:若一定温度下,欲使溶液中铵根离子浓度与一水合氨分子浓度增大,根据平衡常数,只需要溶液中氢氧根离子浓度减小即可。故加水、加入酸溶液,加入显酸性的盐均可。通常溶液的酸碱性比较容易测定,当外加一些试剂的时候,溶液酸碱性的变化也比较容易判断,可以用宏观的理性思维判断酸碱性,从平衡常数推算其他离子浓度的变化。

【参考答案】1012·Ka1,1024·Ka1·Ka2。


