利用不同氢源及氮源电化学合成氨研究进展与挑战
2022-08-29关浩然朱丽娜朱凌岳苑丹丹张雨晴王宝辉
关浩然,朱丽娜,朱凌岳,苑丹丹,张雨晴,王宝辉
(1 东北石油大学化学化工学院,黑龙江大庆 163000;2 中国石油天然气股份有限公司石油化工研究院大庆化工研究中心,黑龙江大庆 163714)
氨是基本有机化学工业及化肥生产的主要原料,氨分子中氢的含量高、能量密度大,并且易于输送和保存,在工业与农业生产中有着举足轻重的地位。世界上第一台合成氨工业设备于1913年9月开始投入使用,产量为5t/d,人们开始了对合成氨工艺的探索与研究。经过一百多年的发展,通过对合成氨技术及工艺的革新,目前全球氨产量已经达到约2×10t/a。哈伯-博世(Haber-Bosch)工艺是一种传统的合成氨工艺,发展时间最长并且使用最为广泛,技术也相对更加成熟。该工艺在高温(350~650℃)、高压(20~40MPa)条件下,以氮气和氢气为原料,在催化剂的作用下合成工业产品氨,其主要反应为式(1)。

该反应是典型的放热反应,高压和低温条件更加有利于反应的进行。但从动力学角度考虑,低温环境下反应速率较慢,不利于工业生产,所以为加快反应进程、提高反应速率,需要适当地升高温度。此外,随着温度的升高,氨由于自身稳定性原因,会发生部分热分解,导致产品产率降低,所以需要继续升高压力以克服热分解的问题。由于上述种种原因,哈伯-博世工艺需要在较高的温度和压力下进行反应,使其生产工艺对设备及生产成本均有较严苛的要求。除此之外,传统哈伯-博世合成氨工艺每年释放约420Mt的CO,同时受热力学限制,转化率仅有10%~15%。随着近年来化石燃料的大量消耗、环境恶化日益加剧,亟需找到一种绿色环保的合成氨工艺替代路线。目前新的合成氨工艺主要包括光催化合成氨、酶催化合成氨以及电化学合成氨三种。其中,电化学合成氨可以在低温常压状态下进行,反应过程清洁环保,比哈伯-博世工艺减少约20%的能耗,并且不受热力学限制,是近年来研究的热点领域。但催化剂的活性以及选择性低,是电化学合成氨现阶段面临的挑战之一。除催化剂外,不同的氢源、氮源也对电化学合成氨的转化率有明显影响。
本文从电化学合成氨中提供氮、氢元素的原料以及不同原料所使用的阴极催化剂等多个角度,对现阶段电化学合成氨技术研究进展进行综述,并阐述了研究所面临的挑战以及潜在研究方向,旨在为后续电化学合成氨研究人员提供帮助。
1 供氮原料的选择
1.1 以氮气(N2)为原料
大气中约有4000 万亿吨气体,其中氮气约占78%,是空气中含量最高的气体。这使得氮气几乎可以无限使用。与传统工艺相比,以氮气为原料电化学合成氨时,阴极发生氮气还原反应(nitrogen reduction reaction, NRR),可以在中低温常压条件下进行,反应条件温和,降低温度的同时也降低了氨气分解的速率,使其能够达到更高的产率。在NRR 过程中,氮气分子经过吸附、解离、加氢、电子转移等一系列过程,最终转化为NH。NRR存在两种可能的反应机理:解离(dissociation)机制和非解离(缔合)机制,如图1所示。解离机制中,氮气中的氮氮三键需要被破坏(解离能为945.41kJ/mol),氮原子随后附着在催化剂表面通过加氢最终生成NH分子[图1(a)]。在缔合机制中,氮原子加氢过程与N N 中三键被破坏的过程同时进行,在减少能耗的同时提高了反应效率。根据氮原子加氢顺序的不同,又可以分为远端缔合途径(distal pathway) 和交替缔合途径(alternating pathway)。在交替途径中,两个氮原子依次交替加氢,其中一个氮原子转化为NH后,N N 三键断裂,另一个氮原子继续留在催化表面加氢,最终生成NH[图1(b)]。而在远/末端缔合途径中,远离催化表面的氮原子首先加氢并释放出NH,另一个氮原子留在催化剂表面,继续加氢最终生成NH[图1(c)]。虽然NRR过程原料易于获取,但由于N N解离能较高,导致解离机制较为困难。
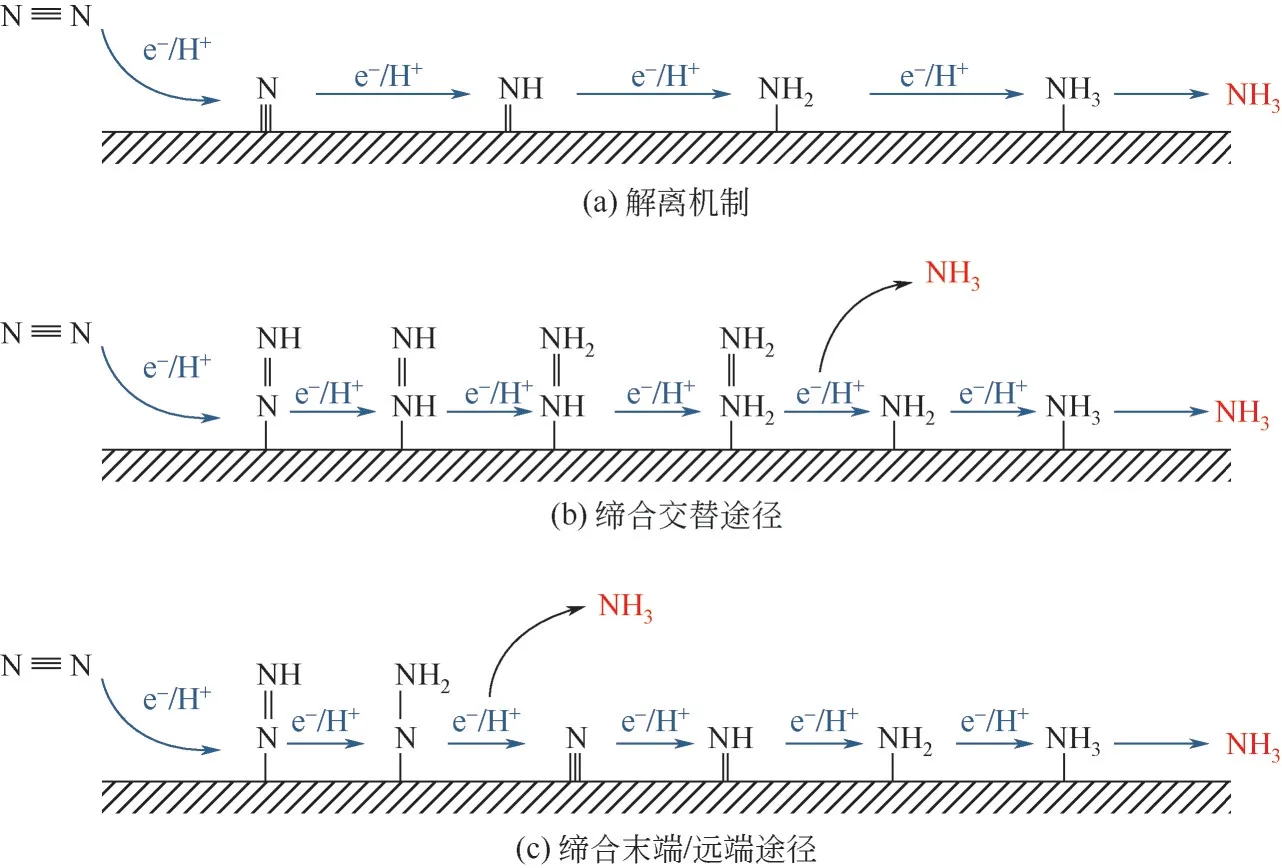
图1 N2还原解离机制与缔合机制合成氨反应机理[21]
1.2 以硝酸盐()为原料

Niu 等对NORR 的反应机理进行了推测,认为硝酸盐合成氨的加氢反应机理主要分为氧端途径(O-end)、氮端途径(N-end)、侧端加氢途径(NO-side)三种,如图2所示。其中,侧端加氢途径又分为氮侧加氢(N-side)和氧侧加氢(Oside)。
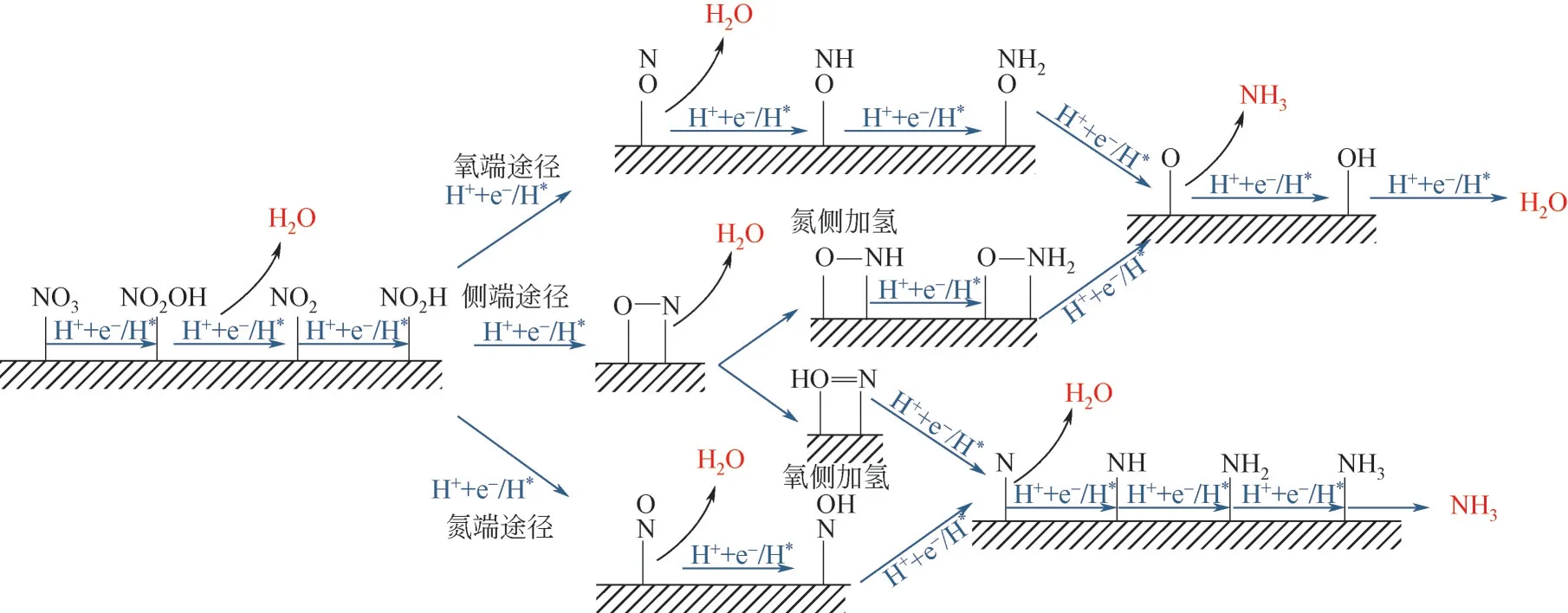
图2 NO3RR反应机理[13]
Yu 等利用异构Co/CoO 纳米片阵列(Co/CoO nanosheet arrays NSAs)在-1.3V(.SCE 饱和甘汞电极)的条件下,利用NO-合成NH,法拉第效率(FE)能够达到93.8%且同时具有91.2%的选择性。其中,Co/CoO NSAs 不仅能够抑制反应中H的生成,同时形成了高能量屏障使得副产物生成更加困难。Wang 等利用钛网支撑的CoO纳米棒阵列作为催化剂,在-0.65V的条件下对NH(aq)的选择性为33.6%,并且NH产率为14.5mg/(h·cm)。在这之后,他们制备了具有富氧空位的TiO纳米管,用于硝酸盐电化学合成氨。硝酸盐中的氧原子能够填充到TiO的氧空位中,达到削弱N—O 键的作用。在-1.6V(.SCE)的条件下,硝酸盐中氮的转化率为95.2%、选择性为87.0%、产率为0.045mmol/(h·mg)。Fu 等以Cu{111}纳米片作为催化剂,利用HO 作为氢源,在-0.15V(.RHE)的条件下,实现了较高产率390.1μg/(h·mg),与此同时该催化剂具有高选择性(法拉第效率为99.7%),Cu{111}优异的催化性能主要归因于能够抑制析氢反应(hydrogen evolution reaction, HER)的发生,同时提高决定速率步骤的反应速率。此外,他们发现在碱性介质中,硝酸盐还原合成氨结构更加敏感。Chen等将铜加入3,4,9,10-苝四甲酸二酐(PTCDA)中,形成用于硝酸盐还原电化学合成氨的铜分子固体催化剂,实现了以硝酸盐为原料通过八电子转移合成氨。含有适量铜掺杂的催化剂(O-Cu-PTCDA)催化性能有所提高,在-0.4V(.RHE)的条件下,氨产率为(436±85)μg/(h·cm),法拉第效率能够达到85.9%,证明PTCDA催化剂具有高选择性及较高的催化活性。Li等设计了直径约为2nm 的氧掺杂-钌(Ru)核壳结构的纳米簇,用于催化硝酸盐的还原。这种特殊的核壳结构所引起的拉伸应变效应有效地抑制了析氢反应,使得氢从催化剂表面解吸,并形成了氢自由基。该实验由硝酸盐合成氨的产率为(1.17±0.04)mmol/(h·cm)。
1.3 以氮氧化物(NOx)为原料
氮氧化物作为最常见的大气污染物,不仅会污染水体,同时还会危害人类的身体健康。一氧化氮会与人体血液中的血红蛋白结合生成亚硝基血红蛋白,使血液无法运输氧从而引起中毒。二氧化氮会导致地表水酸化、富营养化,从而导致水生生物和鱼类中的毒素含量提高,同时它也是酸雨形成的主要原因之一。在热电厂等工业生产中,在产能的同时会排放大量氮氧化物,使得生态环境进一步恶化。一些研究人员认为,氮氧化物也可以作为合成氨的氮源,并且由于NO比N反应活性更强,所以NO 更容易被还原,并且使用选择性以及催化活性更强的催化剂可以使得一氧化氮还原反应(nitric oxide reduction reaction, NORR)过程的产率更高、反应条件更加温和。NORR反应机理如图3所示。
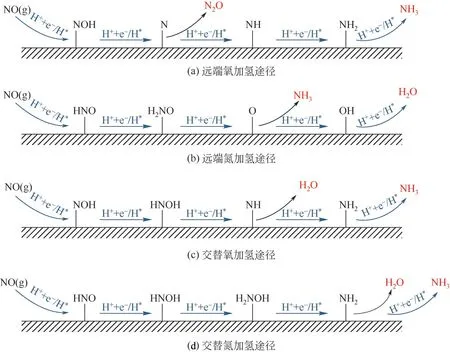
图3 一氧化氮还原反应合成氨机理[20]
Long 等提出以NO 作为氮源、以铜作为催化剂的电化学合成氨的替代途径。密度泛函理论计算表明,NORR 比NRR 更为活跃。利用泡沫铜作为工作电极,在-0.9V(.RHE)的条件下,产氨速率能够达到517.1μmol/(h·cm),同时法拉第效率为93.5%。Zhang 等将MoS纳米片负载在石墨毡上合成了一种新的催化剂(MoS/GF),在酸性条件下,氨的产率可达99.6μmol/(h·cm),远高于水基NRR 催化剂的催化效率,当以碳纸负载MoS纳米片作为阴极时,产率为411.8μg/(h·mg),优于很多现有的以N为原料的金属电池体系的产率,并且该组研究人员发现,Mo的edge位点带有正电荷,在有利于NO 的吸附与活化的同时抑制质子的结合,使得该催化剂对于NORR 有更高的催化活性,并对HER 有很好的抑制作用,从而达到高产率及高法拉第效率。
2 供氢原料及阴极催化剂
传统合成氨工艺使用氢气作为供氢原料,在高温高压的条件下,加入催化剂大量生产氨,反应过程不仅能耗大,且氢气来自于化石燃料,制氢过程会产生大量的CO(生产每吨NH释放1.87t CO)。工业合成氨通常在350~650℃、20~40MPa 的条件下进行,但转化率最高仅能达到15%,且工艺复杂,实际能耗是理论能耗的2倍左右。相比之下,电化学合成氨可以使得反应在中低温度下进行,并且反应的副产物更少,供氢原料也不局限于氢气。目前电化学合成氨的供氢原料可以分为三种,分别为氢气(H)、水(HO)以及其他来源。
2.1 以氢气(H2)作为原料
工业合成氨使用的氢气来自化石燃料,产氢过程中会生成大量CO。此外,反应通常在高温下进行,需要消耗大量能量,随着温度的升高,氨气的分解速率加快,使得产率很难提高。除此之外,早期以氢气作为氢源的研究中,大多数使用需要在1500~1650℃才能烧结而成的固体质子导体。Chen等采用反相微乳液法制备了 LBGM(LaBaGaMgO)氧离子固体质子导体,400~800℃范围内,在氢气氛围中可以制备得到纯净的质子导体。在520℃的高温条件下,利用该质子导体以氮气和氢气为原料进行氨的合成,产氨速率最高为1.89×10mol/(s·cm)。Guo等采用微乳液法制备了 BCY (BaCeYO,=0.05、 0.10、 0.15、0.20),在500℃下,以氮气为原料,=2.1×10mol/(s·cm),BCY 的质子电导率最高能达到1.04×10S/cm,电流效率可达到60%以上,并发现利用微乳液法制备的质子导体具有良好的烧结性能,该固体质子导体最大质子传导率为7.64×10S/cm。2017年,Kishira等采用了CsHPO和SiPO复合材料作为电解质,以负载了Pt 的碳纸作为阳极,研究了Pt/C、Pt-Ru/C、Ru/C、Ru、Ag-Pd五种材料阴极对NRR 的催化效果。Pt/C、Pt-Ru/C、Ru/C 三种催化剂形貌相似,由于铂和钌颗粒负载在高比表面积的炭黑上,使得催化剂层具有较高的多孔性,其中Pt/C和Ru 作为阴极时,均大于1×10mol/(s·cm)。此外,Ru 对N N 键的解离具有很高的活性,而N N 键的解离是电化学合成氨的速率决定步骤,这也使得Ru 是贵金属中最有研究前景的催化剂之一。当外加电压从0.3V 增加到0.6V 时,NH生成速率和电流效率降低。外加电压对于电极反应有两方面影响,首先,随着外加电压的增加,阴极上氨气和氢气的生成速率也会加快,其次,外加电压的增加会使电解池的电流密度显著增加,在高电流密度下,阴极上的催化剂活性位点极有可能被质子覆盖,使催化剂性能受限,导致氨的生成速率降低,在0.3V 的外加电压下,Pt/C 的氨气生成速率和电流效率最高。同年,Kosaka等采用渗透法将铁负载到多孔BCY(BaCeYO)电极中,利用K、Al修饰的Fe-BCY 材料作为阴极,在610℃下,以氮气和氢气为原料合成氨。该课题组进行了对照实验,观察在阴极侧使用纯N或N+15%H作为原料时,氨合成速率是否有变化。未加H时合成速率为2.4×10mol/(s·cm),而在阴极侧通入15%H发现氨合成速率有了明显的加快,能够达到6.7×10mol/(s·cm),这说明适当地使质子与BCY 和Fe材料接触能够加快反应速率,并且由于通入H加快了N N 的解离,从而进一步提高了氨的生成速率。Díez-Ramírez 等利用K-β-AlO固体电解质,研究了K对CoMoN-Ag 的影响,发现通入少量K可以使CoMoN-Ag 的催化活性增强,以氢气和氮气为原料时,产氨速率提高了48%,首次达到300%,但当通入过多K时,合成速率反而会降低,这可能是由于高浓度的钾离子形成了K-N-H 型化合物,阻断了活性电位。
除固体质子导体外,熔盐电解质同样能够起到很好的导电作用,有着较高的电导率,与水基电解质相比,熔盐电解质析氢反应的速率有所减小,并且通过调整共熔盐的配比,可以使反应温度进一步降低。Murakami 等利用熔融LiCl-KCl-LiN(含0.5%LiN) 和LiCl-KCl-CsCl-LiN (含0.5%LiN)作为电解质,以N和H为原料合成NH,NH生成速率最高可达到3.3×10mol/(s·cm),并且通过改变气相电极结构、优化反应条件可以达到更高的电流效率及产率。Amar Ibrahim等以碳酸盐-LiAlO复合材料作为电解质,尖晶石氧化物CoFeO为催化剂,Ag为阴极,Ag-Pd为阳极,在400℃、0.8V的条件下,催化氮气与氢气合成氨,=2.32×10mol/(s·cm)。Bicer 等以KOH-NaOH 熔碱为电解质,在210℃内向体系中循环通入N和H,以多孔镍网为电极,FeO为催化剂合成氨,NH生成速率为6.53×10mol/(s·cm),相比之下,熔融KOH-NaOH熔点较单独熔盐更低。该研究者认为,低电流密度能够提高NH生成速率,提高反应温度可以降低反应电势。2020年,Hattori等发现了一种新的低温(50℃)合成氨途径,利用一种稳定提供电子的多相催化剂CaFH 立方体,该催化剂在50℃下就可以利用N和H合成氨,且活化能仅为传统催化剂的一半,产氨速率为190μg/(h·cm)。
2.2 以水(H2O)作为原料
由于氢气需要通过化石能源燃烧获得,并且过程中会大量排放CO,且固体质子导体烧结温度高,所以近年来电化学合成氨通常使用水作为反应中氢原子的来源。在现有的以水作为原料合成氨的研究中,大多数使用双室电解池,N在阴极上被还原成NH,为防止生成的NH在阳极室被氧化而影响实验结果,需要利用离子交换膜连接阴极室和阳极室,如图4(a)所示。当以熔盐作为电解质时,则可以使用单室电解池,如图4(b)所示。
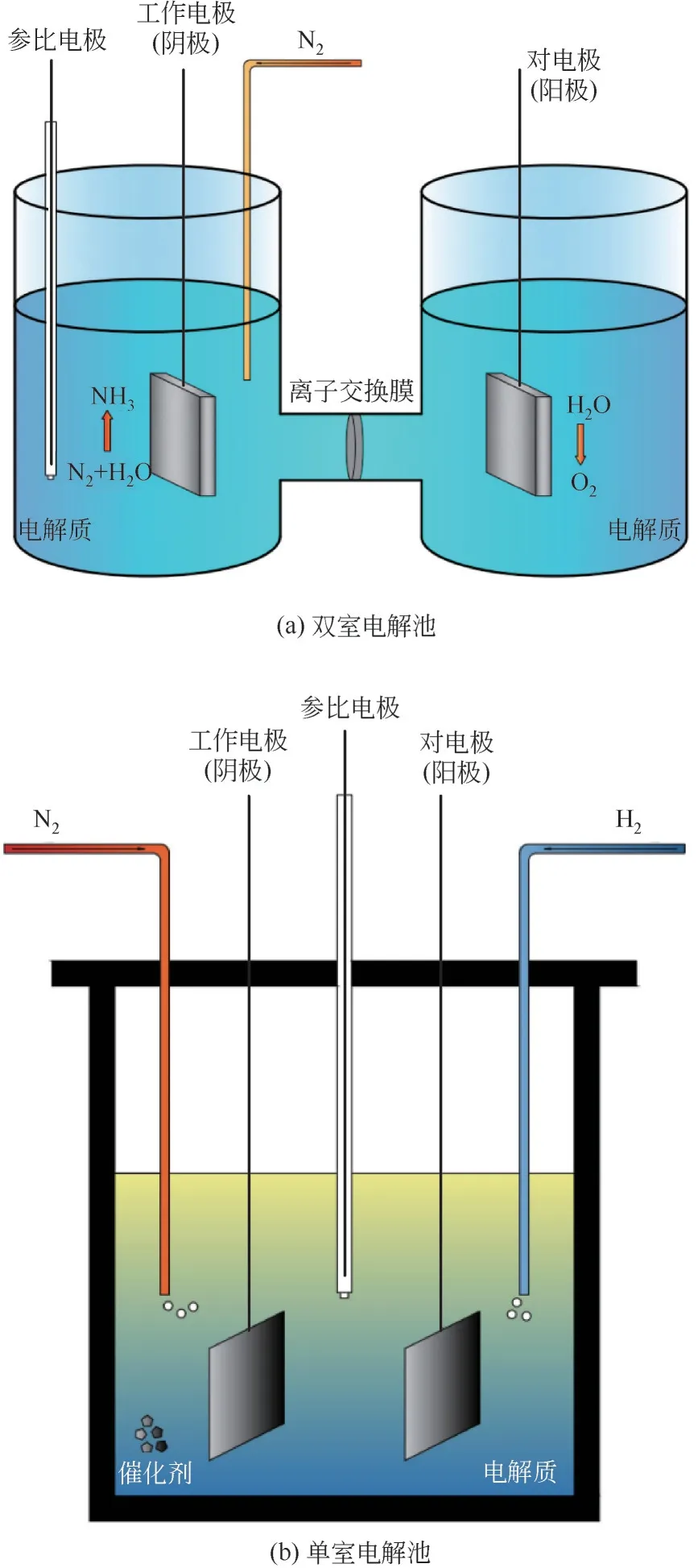
图4 电化学实验装置示意图
由于在阴极上发生还原反应,所以针对电化学合成氨的研究多数集中在阴极材料及催化剂上。表1对近年来以水作为氢源电化学合成氨的研究及其所使用的阴极催化剂、产氨速率与法拉第效率等信息进行了汇总。
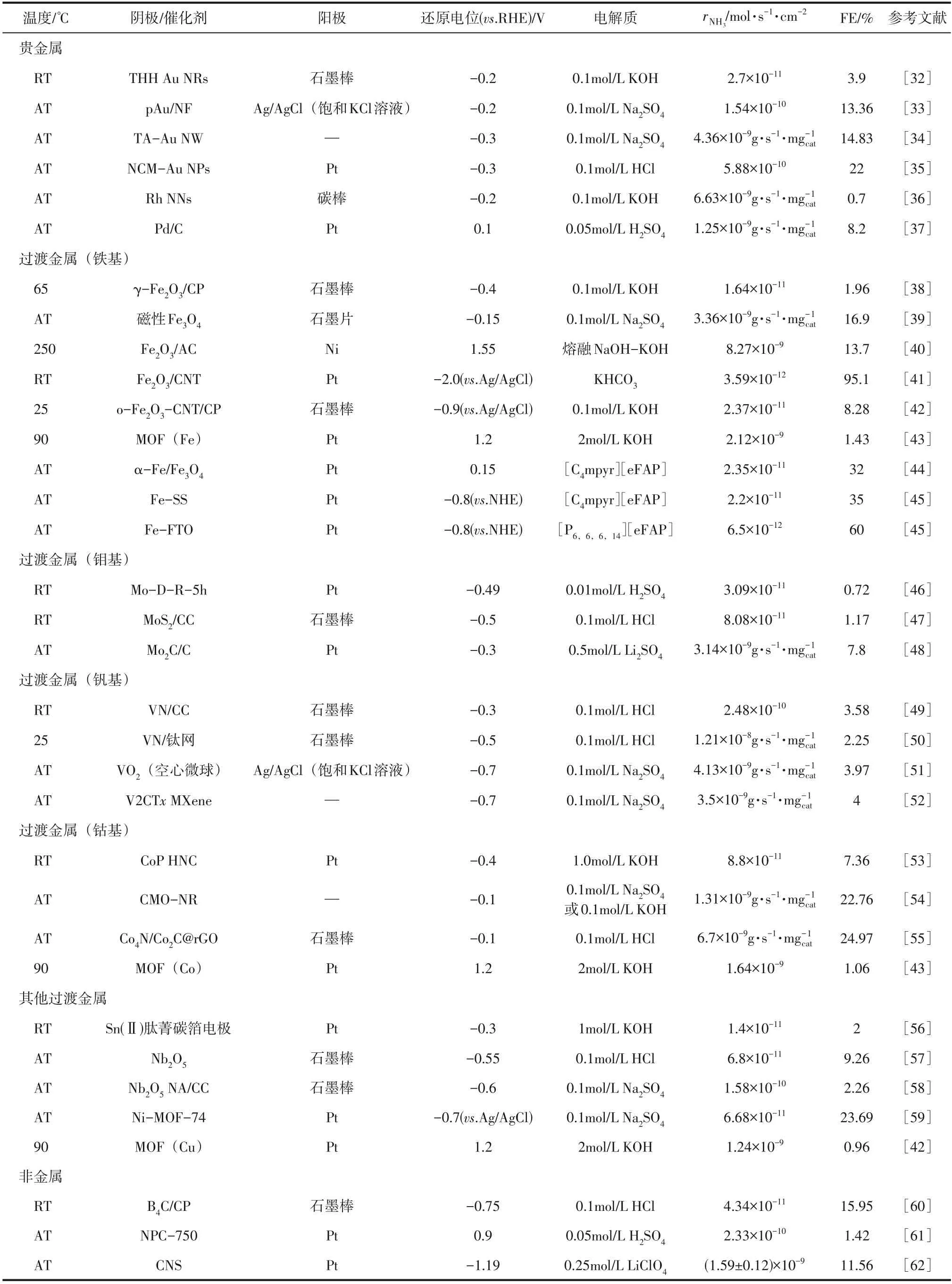
表1 以水为氢源电化学合成氨(表中均为NRR反应)
贵金属因其导电能力强、活性高且低温催化性能比非贵金属优异等优点,在电化学合成中经常作为催化剂被广泛应用。Bao等合成了THH Au NRs(二十四面体金纳米棒,tetrahexahedral gold nanorods)催化剂,以HO和N为原料合成氨,在该催化剂作用下,反应速率[=2.7×10mol/(s·cm)]得到了一定的提升。但该催化剂在催化过程中,纳米棒由于腐蚀而粘连,导致在一定时间后,催化活性有所下降。Wang 等使用了一种氮掺杂纳米多孔石墨碳膜,利用金纳米颗粒对其功能化后,成功地在酸性水溶液下将N转化为NH,产氨速率为5.88×10mol/(s·cm),法拉第效率提高到22%。该课题组提出比表面积对优化多相催化剂的催化活性起着关键的作用,纳米多孔石墨碳膜(NCM)的分层多孔结构和优异的导电性能,使其在催化过程中增强了催化剂、电解质和水之间的三相接触和电荷传输,从而加快了反应速率。2021 年7 月,Liu 等利用单宁酸修饰金纳米线(TA-Au NW)在0.1mol/L NaSO水溶液中合成氨,得到了15.71μg/(h·mg)的氨生成速率以及14.83%的法拉第效率,同时该课题组仅利用碳纸作为工作电极进行对比实验,并没有NH的生成,说明催化过程中所生成的氨均来自于氮气和水反应。有研究发现,Au 的活性一维结构为反应提供了足够的活性位点,使得催化剂具有高催化活性与高稳定性,而单宁酸涂层具有丰富的吸附反应物界面位,增加了反应物与催化剂表面的碰撞次数,从而使反应速率进一步得到提升。除Au外,Rh同样可以作为电化学合成氨的催化剂。Liu 等合成了一种超薄铑纳米片纳米组件,该催化剂具有超薄(约1nm)的二维纳米片形状、高比表面积以及改进的电子结构,使得该催化剂可以在更低的电位(-0.2V.RHE)下有着更高的产率=6.24×10mol/(s·cm)。Wang等发现钯基催化剂对NRR 有着很好的催化性能,Pd的独特活性源于其平衡的HER活性,同时在其晶格中容易吸收氢原子而形成Pd 氢化物。由于这种氢化机制,使得钯基催化剂在低电位下具有高选择性和高活性。虽然贵金属在催化过程中表现出了优异的催化性能以及稳定性,但贵金属价格昂贵,不适合用于工业大量生产。

续表1
相比于贵金属,过渡金属因成本低廉、易于获取等优点而备受关注。近年来备受关注的过渡金属催化剂主要有Fe、Mo、V、Co、Pd 等,铁基催化剂作为传统电化学合成氨所使用的催化剂,在研究中被广泛使用。部分研究人员通过利用纳米材料对催化剂进行进一步改进,从而达到更好的催化效果。Kong 等将涂有γ-FeO纳米颗粒催化剂的多孔碳电极作为阴极,可以在65℃、-0.4V 的条件下直接利用水和氮气合成氨,合成速率为1.64×10mol/(s·cm),FE 为1.96%。与一些贵金属纳米催化剂相比,γ-FeO纳米颗粒明显有着更大的粒径,可能会降低氨生成的活性,文中指出,可以通过减小颗粒尺寸或是进一步改进材料性能来提高催化剂的化学利用率。Tang 等利用碳纳米管(CNT)修饰的FeO,在表面改性之后,合成速率为2.37×10mol/(s·cm),FE 达到8.28%。经过CNT修饰的催化剂由于具有较高的表面氧空位,使得催化性能得到改善,在相同条件下,该催化剂的催化性能优于贵金属(Ru/C),但在16h 后,随着反应持续生成NH可能会导致Nafion膜降解,使得反应速率与法拉第效率均有所下降,体系的耐久性与稳定性较差。He 等制备磁性FeO纳米颗粒作为催化剂,环境温度下,在0.1mol/L NaSO中合成氨速率为12.09μg/(h·mg)、法拉第效率为16.9%,密度泛函理论(DFT)计算表明,N N键被完全激活,证明NRR 主要是沿着交替途径进行,并且在反应过程中不同电位下均未检测到NH的生成,证明了FeO纳米颗粒对NRR过程的优异特异性。除对催化剂本身的粒径大小或结构进行改进外,由于催化剂在电解质中的分散对催化性能有着至关重要的影响,可以将催化剂负载到其他材料上。Cui 等通过将纳米级FeO负载到活性炭(FeO/AC)上作为阴极催化剂,首次实现了在熔盐中利用湿氮气直接合成氨,在250℃、1.15V 的条件下FE 能够达到13.7%;1.55V 时,氨生成速率能够达到8.27×10mol/(s·cm)。研究表明,活性炭具有很高的微孔率,并且密度与熔融NaOH-KOH 相似,使得活性炭粉末可以很好地分散在熔盐中,且该催化剂能够抑制HER,从而促进Fe的还原。金属-有机框架材料(MOFs)是近年来发展迅速的一种配位聚合物,Zhao等首次利用Fe、Co、Cu制备金属-有机框架材料催化剂,结果表明,MOF(Fe)在三种材料中的性能最佳,合成速率能够达到2.12×10mol/(s·cm)。MOF(Fe)在低温常压下对NRR 的催化活性在非贵金属催化剂中较为优秀。除对催化剂的改良外,该课题组还发现,以纯N和HO为原料合成氨时高于以空气作为氢源时的产氨速率,这主要是由于空气中N的分压低于纯N,且在反应过程中产生的氨有被空气中O氧化的可能性。杨通等同样利用MOF 材料制备了催化剂,其中制备的Ni-MOF-74 催化剂效果最佳,氨产率能够达到6.68×10mol/(s·cm),并且有着23.69%的法拉第效率。该催化剂的主要优势在于颗粒较小,并且可以均匀地分散在电解质中,因其有最多的金属-氧键以及最大的电化学比表面积,从而得到了较高的氨产率;由于Ni-MOF-74 可以很好地抑制析氢反应的进行,使得在反应中转移的电子均用于氨的合成,最终得到较高的法拉第效率。
除对催化剂结构进行改进外,在不同的电解质中,催化剂的效果也会发生改变。Suryanto 等在α-Fe/FeO催化剂的基础上,使用[Cmpyr][eFAP]离子液体作为电解质进行合成,法拉第效率能够达到32%,文中提出疏水氟化非质子电解质有效地限制了质子的可用性,通过抑制析氢反应提高电流效率,并且α-Fe/FeO特殊的核壳结构最大限度地减少了反应中刚开始还原阶段的电荷损失。同样使用离子液体电解质的还有Zhou等,除[Cmpyr][eFAP]外,该课题组还使用了[P][eFAP]离子液体,利用电沉积技术将铁基催化剂应用于氟掺杂氧化锡玻璃(FTO)、泡沫镍(NF)、不锈钢(SS)三种工作电极材料上,使用[P][eFAP]作为电解质、FTO作为电极基底时法拉第效率(60%)最高,使用NF作电极基底时,反应速率为1.88×10mol/(s·cm)。
由于钼元素在固氮酶中起着重要作用,使得钼基催化剂同样具有研究前景。Yang等通过将Mo-Fe双金属层电沉积5h,制备了Mo-D-R-5h电催化剂,研究发现,通过电沉积使Mo 的催化性能有了显著的提高[=3.09×10mol/(s·cm)、FE=0.72%]。Zhang 等发现在酸性条件下,即使发生强烈的析氢反应,MoS仍然对NRR有催化活性。Cheng等将MoC 嵌入超薄碳纳米片作为电催化剂,同样证明了伴随剧烈的氢析出时,也有可能实现高效的NRR,在各种过渡金属碳化物中,MoC 具有高效吸附富电子物质的能力并有着优异的催化活性,这归功于在碳纳米片中含氧基团的静电力的限制下,形成了高活性的MoC 纳米点位。除此之外,文中提出,析氢反应在电化学合成氨中虽然属于竞争反应,但对于提高产率必不可少。
钒具有较高的电化学稳定性及选择性,同样可以作为NRR 的催化剂。Zhang 等将VN 纳米阵列负载到碳布上作为催化剂,在常温下反应速率为2.48×10mol/(s·cm)。Guo 等制备了VO空心微球,Zhang等将VN纳米片阵列附着在钛网上,电催化性能在8h 内均可保持稳定,反应中未检测到副产物NH,进一步证明了钒基催化剂在合成氨过程中具有优异的选择性。Xia 等利用二维碳化钒在环境条件下成功合成了NH,以N/N为原料,在产物中观察到NH/NH,说明在反应中N是唯一的氮源。上述研究均证明钒基催化剂选择性较高,但随着时间增加,氨合成速率和电流效率均有所降低,所以未来要着重考虑如何增强钒基催化剂的使用耐久性。
Guo 等利用对钴进行改性制备CoP(空心微笼)催化剂,在碱性介质中合成NH并且未产生NH。Zhang 等在环境条件下,以CoMoO纳米棒作为催化剂合成NH,法拉第效率能够达到22.76%,并且发现,在Co-Mo 的协同作用下,金属氧化物的电催化性能得到了明显提高。Qiao等合成了最新的钴基催化剂CoN/CoC@rGO,过渡金属碳化物本身就具有优异的导电性及稳定性,而石墨烯的加入进一步优化了过渡金属的导电性能,在-0.1V(.RHE)、常温条件下,氨合成速率为6.7×10g/(s·mg)、法拉第效率达24.97%,高于现有的其他钴基催化剂。
虽然过渡金属均可在一定条件下合成氨,但有些过渡金属本身的电导率较低,限制了反应产率,因此一些研究人员制备了复合材料作为阴极催化剂。Li等合成了一种非晶型Au/CeO-RGO阴极催化剂,-0.2V 时NH产率为2.7×10mol/(s·cm),高于大多数Au基阴极催化剂。与晶型Au相比,非晶型Au 具有更好的化学反应活性、催化性能以及更强的N结合能力。Lee 等利用Ag-Au 作为阴极催化剂,并在阴极上覆盖沸石型咪唑啉骨架型疏水材料(ZIF),从而很大程度地抑制了阴极上的析氢反应,增强了催化剂与反应物之间的作用,在四氢呋喃基电解质溶液中,法拉第效率最高为22%。Huang等制备了NiS@MoS核壳微球,该催化剂表面具有足够的活性位点、较高的结构孔隙率以及便捷的传输通道,有利于电子传递并且结构稳定。-0.1V 时,在0.1mol/L 的NaSO溶液中,氨产率为9.66μg/(h·mg)、法拉第效率为14.8%。实验发现,NiS 和MoS的协同作用进一步促进了界面电荷转移,从而优化了反应中间体的自由能,使得该复合催化剂有了很高的催化活性。
此外,一些非金属材料同样具有促进NRR,抑制HER 的作用。Liu 等利用氮掺杂的多孔碳(NPC)在室温下合成氨,并发现在750℃下合成的NPC-750 有着最高的催化活性以及电流效率,产率为2.33×10mol/(s·cm)、法拉第效率为1.42%,该课题组实现了利用非金属电催化剂在常温条件下低成本合成氨。Qiu 等发现碳化硼纳米片可以在室温下进行人工固氮,在常温条件下,该催化剂合成氨速率为4.34×10mol/(s·cm)、FE 为15.95%。Song等合成了一种氮掺杂的碳纳米尖刺电催化剂合成氨,合成速率最高可达1.70×10mol/(s·cm),文中提出,对于该催化剂而言,尖刺半径越小,对电场的增强效果越明显。
除催化剂以外,部分研究人员将重点放在电解质上,Liu 等制备了一种氮掺杂萤石型稀土复合陶瓷氧化物CeMO氧离子固体质子导体电解质,在该电解质中,利用氮气和水蒸气合成氨,产氨速率最高能够达到8.2×10mol/(s·cm)。该课题组研究发现,虽然CeO在高温H-HO 氛围中是一个质子-电子混合导体,但掺杂CeO有着较好的氨生成率,而该氧离子质子导体具有较高的电导率,可能是因为陶瓷具有较高的化学均匀性和烧结密度,该研究证明,在以水为氢源的体系中,氧离子质子导体可以作为电解质。
2.3 其他氢源
除氢气与水之外,其他含氢气体也可作为合成氨的氢源。Murakami等利用甲烷作为氢源,利用熔融LiCl-KCl-CsCl 作为电解质,在常压下,氮气提供反应所需的氮原子,同时甲烷分解产生氢气与氮原子结合生成氨,电流效率能够达到72%。在电解池中发生的反应如式(2)~式(4)。

Murakami 等随后以硫化氢(HS)为氢源,利用熔盐为电解质合成氨,同时对阳极进行了一系列分析,发现镍的氧化产物为NiS 和NiS,证明了硫化氢作为氢源的可行性。

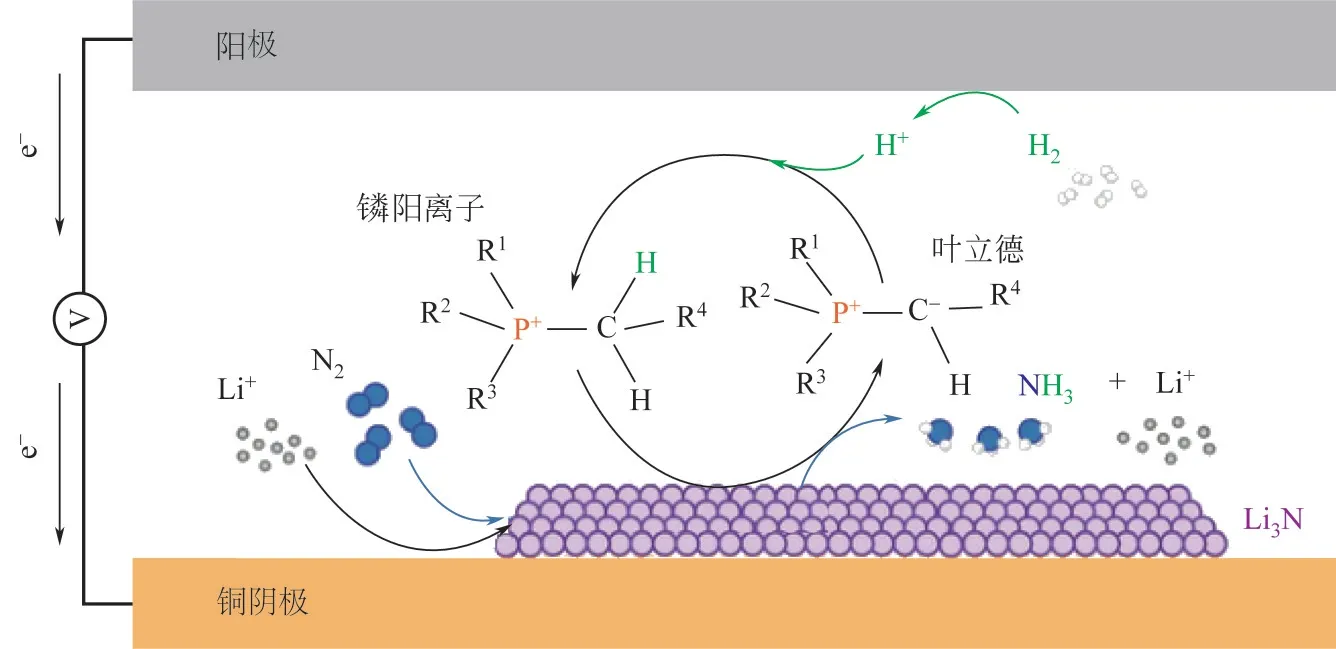
图5 以[P6,6,6,14][eFAP]作为质子导体合成氨机理
3 总结与展望
(1)以氮气为原料时,氢气和水可以作为合成氨的氢源,但氢气受到其来源及运输等因素的限制,在应用过程中还需要进行工艺及设备的改进。近些年研究人员更多以水作为氢源进行转化,研究过程中面临氮气在水中溶解度低、析氢等副反应多等难题。如何更好地通过抑制竞争反应来提高合成氨产率和电流效率,是未来需要着重研究的方向。部分研究人员以离子疏水液体作为电解质,可以使体系中的HO维持在较低浓度,从而达到抑制析氢反应的目的。因此在后续开展的研究中可以通过改变氢源的组成或结构,对其进行定向反应设计,减少电化学反应过程中副反应的发生,促进原料在体系中能够进行较为单一的氧化还原反应,从而达到更高的产率与电流效率。
(2)由于硝酸盐易溶于水,所以水在以硝酸盐为氮源的合成氨研究中能够作为理想的氢源。与氮气为氮源的合成过程相比较,硝酸盐合成过程更加复杂,其主要原因是反应过程中氮转化需要八电子转移,反应条件更为苛刻。并且元素价态改变跨度较大,中间产物较多,如肼(NH)、氮气等,这些中间产物的生成必然会影响目标产物的产率及反应体系的电流效率,导致以硝酸盐还原合成氨的反应机理更难分析。催化剂的介入能够有效解决目前存在的问题,选择或合成高效催化剂,能够提高在反应过程中对于主反应的选择性。通过改变催化剂的结构,增加催化剂表面氧空位,可以进一步削弱N==O键或N—O键,从而达到反应在更低还原电位进行的目的,相对来说,主反应的增强相当于削弱了副反应。此外,还可以将金属催化剂与其他材料进行复合,使催化剂结构稳定、表面具有功能性、增加活性位点,从而提高电子传导率,达到提高合成氨产率的目的。
(3)现阶段关于氮氧化物为氮源的研究相对较少,主要原因是水体系内合成氨产率及电流效率受到析氢等竞争反应的影响较难有大的突破。此外,不同氮氧化物之间存在转换,二氧化氮在水中易发生反应生成一氧化氮及硝酸,在合成氨反应中改变了体系中的氮源结构,平添了诸多不可控因素。结合氢源的选择,可以从电解质的选择上入手,通过改变反应体系,选择熔融电解质、固体电解质等对反应进行强化。高温稳定的电解质体系有助于突破受电解质沸点限制的反应温度,降低合成氨所需要的电解电势,促进反应向产物方向进行。此外,还可以借助电解质进行固氮反应,提高氮氧化物在反应体系中的参与度,使得反应速率和电流效率得到改进。
