1-MCP 处理结合激光微孔膜包装对采后水蜜桃的保鲜效果
2022-08-27彭思佳虞任莹童秀子李雪瑞于丽娟罗海波
彭思佳,虞任莹,童秀子,李雪瑞,李 宏,于丽娟, ,罗海波,
(1.南京师范大学食品与制药工程学院,江苏南京 210023;2.云南省农业科学院农产品加工研究所,云南昆明 650221)
水蜜桃(Prunus persica)属于典型的呼吸越变型果实,采收期正值7~9 月份高温多雨季节,使得采后表现出旺盛的呼吸作用和快速软化等特点,加之软化后更易受自身携带及贮运过程中病原菌的影响而腐烂变质,因此极难贮藏,常温下仅3~5 d 即丧失商品价值和食用价值[1-2]。
目前,国内外已有采用冷藏、热水处理、气调、1-甲基环丙烯(1-MCP)、钙处理、涂膜和辐照等技术对水蜜桃进行贮藏保鲜的报道,并取得了一定的效果[3-5]。在这些保鲜技术中,自发气调包装具有操作简便、成本低、安全性高且适用范围广等优点,已成为果蔬中短期贮藏和销售过程中最具发展潜力的保鲜技术之一[6]。然而,传统自发气调包装大多采用透气透水性能较差的聚乙烯(PE)、聚氯乙烯(PVC)或聚偏二氯乙烯(PVDC)保鲜膜等进行包装,极易导致包装内形成不良的气体环境和水蒸气凝结,常引起果蔬生理性品质劣变,甚至加速厌氧微生物生长而腐烂。
微孔膜包装作为一种新兴的低成本环保型自发气调保鲜技术,可通过微孔改善传统包装膜的渗透性,有效地调节包装内O2和CO2的体积比及相对湿度,避免传统自发气调包装易发生低氧呼吸及高CO2损害等缺陷,从而达到动态自发气调的保鲜效果[7]。目前,已有研究人员采用微孔膜包装对猕猴桃[8-9]、甜樱桃和草莓[10]的保鲜效果进行了探索,发现微孔膜包装显著抑制了果实生理生化代谢,维持果实较好的品质,延长了保鲜期。激光打孔具有准确、清洁和无污染等优点,且处理后材料的整体性能受影响较小,一定数量的微米级小圆孔,可根据不同果蔬的呼吸速率调整包装膜的透气率,比普通微孔膜具有更好的选择性透气、透水性能[7]。然而,微孔膜包装受果蔬种类、膜厚度、孔径、单位面积孔数量等因素的影响较大,针对不同果蔬的微孔膜包装参数还需进一步研究。
采后1-MCP 处理可通过与乙烯受体特异性结合而阻断乙烯的催熟作用,目前已广泛应用于果蔬的贮藏保鲜。1-MCP 处理对香蕉、苹果、桃、猕猴桃、李、梨、甜柿、番石榴、番茄、青椒和油菜等均具有不同程度的保鲜效果[11]。然而,1-MCP 单独处理对微生物生长影响不大,且果蔬贮藏过程中会有新的乙烯受体合成,因而其保鲜效果仍然有限,需要与其他技术联用以提高协同增效作用[12]。近年来研究发现,1-MCP 处理结合微孔膜包装具有协同效应,可发挥更好的保鲜效果[7]。俞静芬等[9]采用1-MCP 结合微孔保鲜膜对“红阳”猕猴桃进行处理,能在一定程度上延缓猕猴桃的衰老,降低呼吸高峰值,延长猕猴桃果实的货架期。蔡佳昂等[13]研究表明,1-MCP 与微孔气调包装复合技术能够减缓苕尖的腐烂黄化,维持较好的营养品质,使其贮藏期延长至18 d。
本研究以霞辉8 号水蜜桃为试验材料,在前期充分考虑水蜜桃呼吸强度及膜透水透气性能的基础上制作激光微孔膜保鲜袋,研究1-MCP 处理结合激光微孔膜包装对水蜜桃果实品质及生理生化的影响,探讨其协同保鲜效果,为1-MCP 结合激光微孔膜包装的实际应用提供理论参考。
1 材料与方法
1.1 材料与仪器
霞辉8 号水蜜桃 于2021 年7 月下旬(26~34 ℃)采自江苏省常州市溧阳市北山桃园,挑选果型大小、色泽、成熟度基本一致,无病虫害、无机械伤的桃果实,置5 ℃下预冷24 h;激光微孔保鲜膜 由北京丹普客包装技术有限公司提供,聚烯烃+30%马铃薯淀粉材质,孔径30 μm,厚度10 μm,孔数量为80000/m2,水蒸气透过率1 L/m2d,CO2透过率8 L/m2d,O2透过率1.6 L/m2d;1-MCP 咸阳西秦生物科技有限公司;其他常用化学试剂均为国产分析纯。
SYS-GH 30A 呼吸测定仪 辽宁赛亚斯科技有限公司;CR-10Plus 色差计 Konica Minolta 公司;GY-1 果实硬度计 牡丹江市机械研究所;AWAJ 阿贝折光仪 上海叶拓仪器仪表有限公司;ZHTE-48 多样品组织研磨仪 南京卓恒科学仪器有限公司;Pico-21 高速冷冻离心机 Thermo Fisher 公司;UV-1100 紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 样品处理 将挑选好的桃果实随机分为三组,每组105 个。第一组置聚苯乙烯密封箱中用2 μL/L 1-MCP 在5 ℃下熏蒸24 h,熏蒸结束后将桃放入塑料筐,每筐35 个果实,用激光微孔膜包装(1-MCP+LMF)。第二组在同样条件下不经熏蒸处理仅用激光微孔膜(LMF)包装。第三组在同样条件下不经熏蒸处理且采用纸箱包装作为对照(Control)。将上述样品置5 ℃贮藏,每7 d 取15 个桃果实进行相关指标测定。
1.2.2 失重率和硬度的测定 失重率采用称重法,各组每7 d 取3 个桃果实进行称重,计算公式如下:

1.2.3 可溶性固形物和抗坏血酸含量的测定 可溶性固形物含量用折光仪测定,结果以百分比(%)表示。抗坏血酸含量测定采用2,6-二氯靛酚法[14]。将桃样品与2%草酸充分研磨匀浆后离心(10000×g,10 min)。吸取2.0 mL 上清液于50 mL 的锥形瓶中,加1%草酸溶液18.0 mL 振荡混匀,用标准抗坏血酸标定过的2,6-二氯酚靛酚溶液滴定至粉红色,并以在30 s 内不褪色为滴定终点,记录2,6-二氯酚靛酚溶液的用量,结果表示为mg/kg FW。
1.2.4 呼吸强度的测定 呼吸强度用呼吸测定仪测定,结果表示为mg CO2/kg·h。
1.2.5 过氧化氢含量的测定 过氧化氢(H2O2)含量参照Gouda 等[15]的方法并进行了较小程度的修改。将硫酸钛(5%)和200 μL 的浓氨水溶液加入到1 mL 的提取物中,并在3000×g 下离心10 min。沉淀物用丙酮反复洗涤并离心。将残余物溶于5 mL浓硫酸(2 mol/L)中,在415 nm 处测量吸光度。结果以μmol/kg FW 表示。计算公式如下:
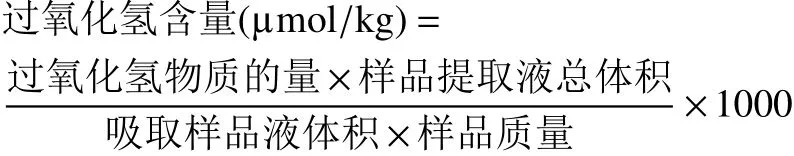
1.2.6 超氧化物歧化酶、过氧化氢酶和抗坏血酸氧化酶活力的测定 超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑(NBT)光还原法测定[14]。称取2.0 g 样品与6 mL 4 ℃下预冷的pH7.8、50 mmol/L 磷酸缓冲溶液(含1 mmol/L DTT、1%PVP)研磨匀浆后离心(10000×g,30 min,4 ℃)。反应管中分别依次加入0.2 mL 上清、pH7.8,50 mmol/L的磷酸缓冲溶液4.2 mL、13 mmol/L Met 0.4 mL,0.1 mmol/L EDTA 0.4 mL,0.075 mmol/L NBT 0.4 mL 和0.002 mmol/L 核黄素溶液0.4 mL,不加酶液的反应管作为最大光还原管,不光照为对照管。将各反应管放入光照培养箱中,4000 lx 光强度下反应30 min,光照结束后立即避光测定A560值,以抑制NBT 光还原50%为一个酶活单位(U),结果表示为U/g FW。
过氧化氢酶(catalase,CAT)的活性参照曹建康等[14]的方法进行测定,并稍作调整。反应在pH7.8的磷酸盐缓冲液、0.2%的H2O2和1 mL 的粗提液中进行,每隔30 s 记录吸光值A240的变化,连续记录3~5 min。以每分钟A240变化0.001 为一个酶活单位(U),结果表示为U/g FW。
抗坏血酸氧化酶(ascorbate peroxidase,APX)活性的测定参照曹建康等[14]的方法进行,并稍作修改。将2 g 样品与5 mL 含有0.1 mmol/L EDTA、1 mmol/L抗坏血酸和1%(w/v)聚乙烯吡咯烷酮的磷酸钠缓冲液(pH7.8)混匀离心(10000×g,20 min,4 ℃)。离心后,将1 mL 粗提物与磷酸二氢钾缓冲液(pH7.0)2.5 mL、0.1 mmol/L EDTA 0.1 mL、5 mmol/L 抗坏血酸溶液0.1 mL 和1.5 mmol/L H2O22.0 mL 混合。每15 s 记录A290的值,连续记录1~2 min。以每分钟A290变化0.01 为一个酶活单位(U),结果表示为U/g FW。
1.2.7 原果胶和可溶性果胶含量的测定 原果胶和可溶性果胶含量均采用咔唑比色法[14],并稍作修改。通过乙醇沸水浴去除样品中的糖分和其他物质,离心后取沉淀。随后将30 mL 去离子水加入沉淀物中,于50 °C 下振摇35 min,溶解果胶后,通过离心得到上清液,用于可溶性果胶的测量;提取原果胶时,将沉淀中加入25 mL 0.5 mol/L 硫酸溶液,沸水浴1.5 h,用于原果胶的测量。将1 mL 原果胶或可溶性果胶提取物与6 mL 浓硫酸的反应混合物在沸水浴中加热30 min,冷却后加入0.2 mL 1.5 g/L 咔唑-乙醇,在黑暗中培养30 min 后,测定A530值。
结果以生成半乳糖醛酸的质量分数(%)表示。计算公式如下:

1.2.8 多聚半乳糖醛酸酶和β-葡萄糖苷酶活力的测定 多聚半乳糖醛酸酶(polygalacturonase,PG)和β-葡萄糖苷酶活力均参照曹健康等[14]的方法进行。将样品与乙醇混合离心,沉淀中加入5 mL 预冷的乙酸钠缓冲液,置4 ℃下孵育20 min,离心后取上清液。PG 的反应混合物包含1.0 mL 醋酸钠缓冲液(pH5.5),0.5 mL 聚半乳糖醛酸溶液和1.0 mL 上清液;β-葡萄糖苷酶的反应混合物含有1.5 mL 的水杨酸溶液和1.0 mL 的上清液。在37 ℃的恒温水浴中保持1 h后,测定A560值。根据葡萄糖标准曲线计算出酶促反应生成的葡萄糖的量,酶活性以每小时每克桃组织样品(鲜重)在37 ℃催化底物形成葡萄糖的质量表示,即mg/kg·h。
1.3 数据处理
每组实验均重复3 次,结果表示为平均值±标准差。采用SPSS 19.0 软件进行数据分析,采用单因素方差分析进行显著性差异分析,P<0.05 为差异显著。采用Excel 2016 软件作图。
2 结果与分析
2.1 1-MCP 处理结合激光微孔膜包装对采后水蜜桃品质的影响
2.1.1 1-MCP 处理结合激光微孔膜包装对采后水蜜桃失重率的影响 失重率是判断果实新鲜度和商品价值的重要指标之一。如图1 所示,随着贮藏时间的延长,对照组失重率快速上升,这可能是受蒸腾作用的影响,果实含水量减少所致。LMF 处理组和1-MCP+LMF 处理组失重率在整个贮藏期间均显著(P<0.05)低于对照组,两处理组之间无显著(P>0.05)差异,这可能与激光微孔膜包装能有效抑制桃果实蒸腾失水有关,但1-MCP 对失重率的影响较小。
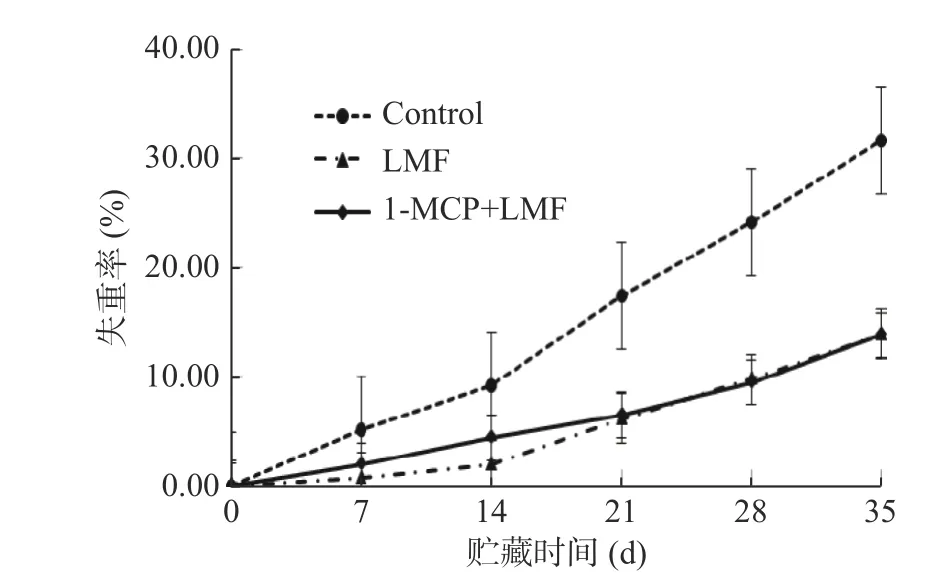
图1 1-MCP 结合激光微孔膜包装处理对水蜜桃失重率的影响Fig.1 Effect of 1-MCP treatment combined with laser microporous film packaging on weight loss of honey peach
2.1.2 1-MCP 处理结合激光微孔膜包装对采后水蜜桃硬度的影响 硬度是评价桃果实品质的另一重要指标。在贮藏过程中,水蜜桃硬度呈下降趋势(图2),采后7 d 内桃果实的硬度变化较小,贮藏7~14 d 内果实硬度呈迅速下降趋势;贮藏14 d 时,对照组、LMF 处理组及1-MCP+LMF 处理组硬度分别下降了47.35%、28.46%和20.71%,其中下降幅度较小的是1-MCP+LMF 处理组;贮藏35 d 时,1-MCP+LMF 处理组硬度为4.98 kg/cm2,显著(P<0.05)高于对照组的2.85 kg/cm2。在本试验中,果实硬度下降速度依次为对照组>LMF 处理组>1-MCP+LMF 处理组,结果说明1-MCP 处理结合激光微孔膜包装能较好保持桃果实的硬度。
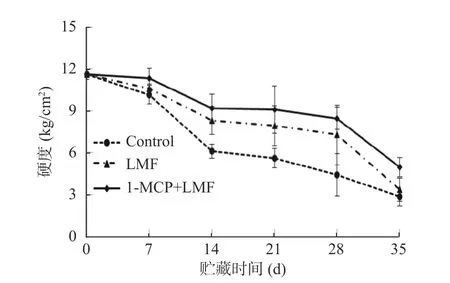
图2 1-MCP 结合激光微孔膜包装处理对水蜜桃硬度的影响Fig.2 Effect of 1-MCP treatment combined with laser microporous film packaging on hardness of honey peach
2.1.3 1-MCP 处理结合激光微孔膜包装对水蜜桃可溶性固形物和抗坏血酸含量的影响 可溶性固形物是影响果实风味和营养的主要成分。如图3A 所示,贮藏前期,对照组桃果实可溶性固形物呈现下降趋势,贮藏7 d 后可溶性固形物含量持续上升;而另两个处理组可溶性固形物含量则在贮藏第7 d 达到最大值,随后呈现先降后升趋势。贮藏35 d 时,对照组、LMF 处理组及1-MCP+LMF 处理组可溶性固形物含量分别上升了26.84%、10.00%和5.79%,这可能是由于随着贮藏时间的延长,果实变软,糖分积累所致。贮藏28~35 d,1-MCP+LMF 处理组可溶性固形物均显著(P<0.05)低于对照组和LMF 处理组,该结果表明1-MCP 处理结合激光微孔膜包装能较好维持桃果实可溶性固形物含量。
抗坏血酸是反映果实营养成分的重要指标之一,在提高果实的抗氧化和抗衰老方面也起着重要作用。由图3B 可知,随着贮藏时间的延长,桃果实抗坏血酸含量呈下降趋势,且在贮藏过程中,1-MCP+LMF 处理组的抗坏血酸含量始终高于其他处理。贮藏35 d 时,对照组、LMF 处理组及1-MCP+LMF 处理组抗坏血酸含量分别下降了93.75%、83.75%和78.75%,LMF 和1-MCP+LMF 处理均延缓了抗坏血酸含量的下降,其中1-MCP+LMF 处理效果更好。
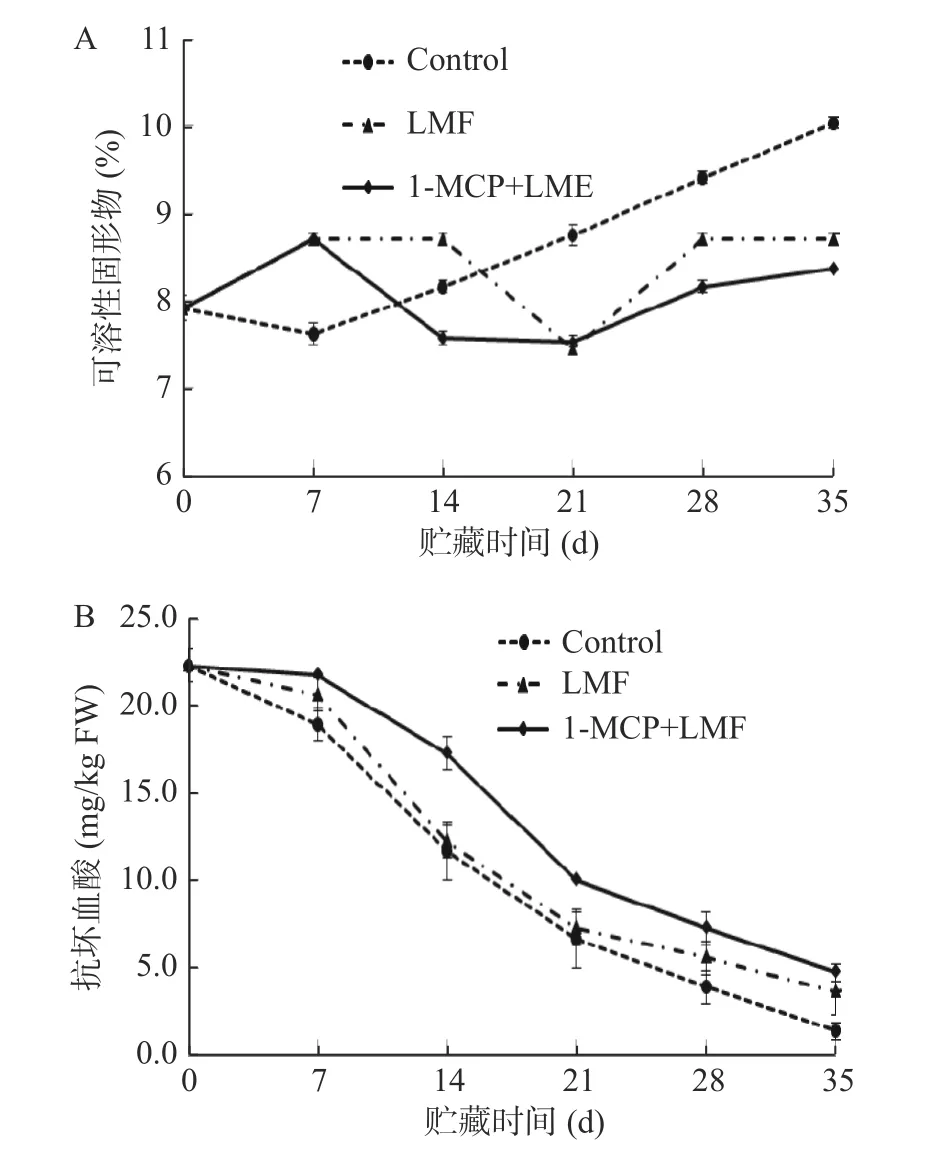
图3 1-MCP 结合激光微孔膜包装处理对水蜜桃可溶性固形物和抗坏血酸含量的影响Fig.3 Effect of 1-MCP treatment combined with laser microporous film packaging on soluble solids and ascorbic acid content of honey peach
2.2 1-MCP 处理结合激光微孔膜包装对水蜜桃呼吸强度的影响
桃属于呼吸跃变型果实,由图4 可知,在贮藏过程中,桃果实呼吸强度整体呈上升趋势,采后14 d 内桃果实的呼吸强度变化较小,贮藏14~21 d 内呼吸强度呈迅速上升趋势;贮藏21 d 时出现第一个呼吸高峰,对照组、LMF 处理组及1-MCP+LMF 处理组的呼吸强度分别为80.21、72.35 和64.47 mg CO2/kg·h,并在贮藏35 d 时出现第二个呼吸高峰;贮藏35 d 时,1-MCP+LMF 处理组呼吸速率为60.00 mg CO2/kg·h,显著(P<0.05)低于LMF 处理组及对照组。贮藏后期,LMF 处理组和1-MCP+LMF 处理组呼吸强度均低于同时间的对照组果实,表明激光微孔膜可有效抑制水蜜桃的呼吸强度,且与1-MCP 结合处理有协同作用。
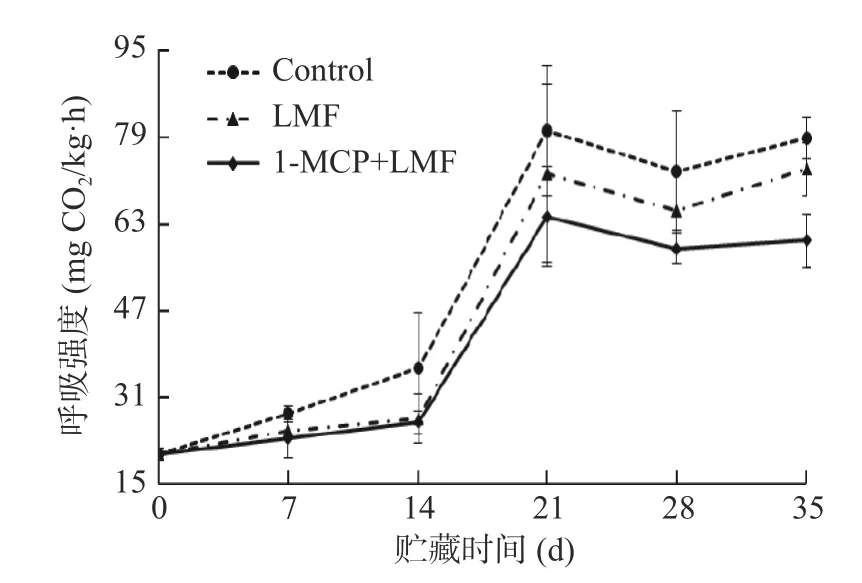
图4 1-MCP 结合激光微孔膜包装处理对水蜜桃呼吸强度的影响Fig.4 Effect of 1-MCP treatment combined with laser microporous film packaging on respiration intensity of honey peach
2.3 1-MCP 处理结合激光微孔膜包装对水蜜桃活性氧及相关酶的影响
2.3.1 1-MCP 处理结合激光微孔膜包装对水蜜桃H2O2含量的影响 如图5 显示,随着贮藏时间的延长,桃果实的H2O2含量整体呈缓慢上升趋势。贮藏前期,各处理组H2O2含量在贮藏前期上升后下降,LMF 和1-MCP+LMF 处理组在7 d 形成峰值,而对照组在贮藏14 d 时形成峰值;贮藏后期,1-MCP+LMF 处理组H2O2含量始终低于LMF 处理组和对照组;贮藏35 d 时,对照组H2O2含量上升了1.12 倍,显著(P<0.05)高于LMF 和1-MCP+LMF 处理组。这说明激光微孔膜处理可以有效抑制桃果实H2O2的产生,但与1-MCP 复合处理协同效应较小。
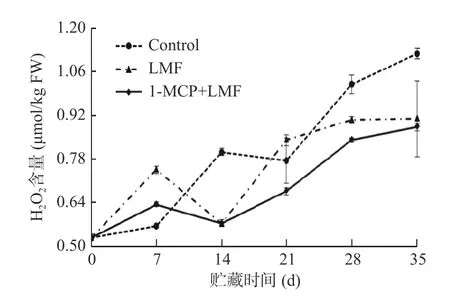
图5 1-MCP 结合激光微孔膜包装处理对水蜜桃H2O2含量的影响Fig.5 Effect of 1-MCP treatment combined with laser microporous film packaging on H2O2 content of honey peach
2.3.2 1-MCP 处理结合激光微孔膜包装对水蜜桃SOD、CAT 和APX 活力的影响 SOD、CAT 和APX是具有清除活性氧作用的酶类。如图6A 所示,贮藏期间,SOD 酶活整体呈上升趋势,除了贮藏第14 d,1-MCP+LMF 处理的桃果实SOD 活性均显著(P<0.05)高于对照组和LMF 处理组;贮藏第35 d 时,1-MCP+LMF 处理组SOD 活性上升了18.75%,显著(P<0.05)高于对照组。如图6B 所示,对照组样品在第7 d 和第28 d 时CAT 酶活达到高峰,1-MCP+LMF和LMF 处理加速了第二个酶活高峰的出现;贮藏第35 d 时,LMF 和1-MCP+LMF 处理组CAT 活性分别上升了32.79%和84.65%,显著(P<0.05)高于对照组。如图6C 所示,贮藏过程中,APX 酶活整体呈下降趋势;贮藏7 d 内,各组APX 酶活呈迅速下降趋势,14~21 d 内桃果实的APX 酶活变化较小;贮藏期间,1-MCP+LMF 处理组酶活显著(P<0.05)高于LMF 处理组和对照组,保持了较高的抗氧化酶活性,减缓了APX 酶活的下降速度。上述结果表明,1-MCP 处理结合激光微孔膜包装可有效保持较高的SOD、CAT 和APX 活性,提高桃果实的抗氧化能力,降低活性氧对细胞的损害。
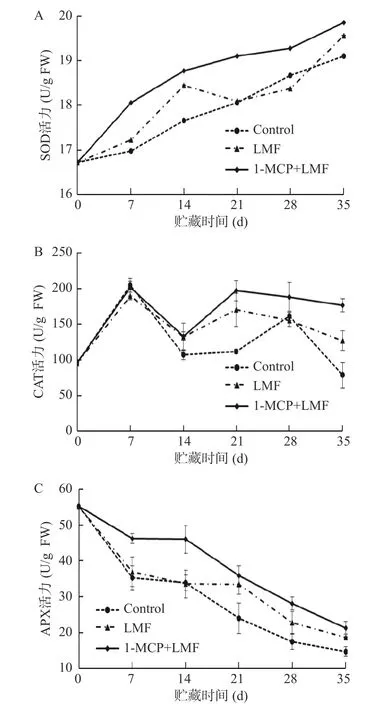
图6 1-MCP 结合激光微孔膜包装处理对水蜜桃SOD、CAT 和APX 活力的影响Fig.6 Effect of 1-MCP treatment combined with laser microporous film packaging on SOD, CAT and APX activity of honey peach
2.4 1-MCP 处理结合激光微孔膜包装对水蜜桃果胶成分及其相关酶的影响
2.4.1 1-MCP 处理结合激光微孔膜包装对水蜜桃原果胶和可溶性果胶含量的影响 果胶参与细胞壁分子间的相互作用,存在于细胞的胞间层,在果实后熟软化过程中,原果胶会被水解成可溶性果胶,导致果实变软。如图7A 所示,随贮藏时间的延长,原果胶含量整体呈下降趋势;贮藏7~14 d 时,对照组原果胶含量迅速下降,从1.52%下降到1.18%,而1-MCP+LMF 和LMF 处理组则整体呈缓慢下降趋势;贮藏35 d 时,对照组、LMF 处理组及1-MCP+LMF 处理组原果胶含量分别下降34.32%、21.91%和17.24%,且1-MCP+LMF 处理组的原果胶含量在整个贮藏期间均显著(P<0.05)高于LMF 处理组及对照组。
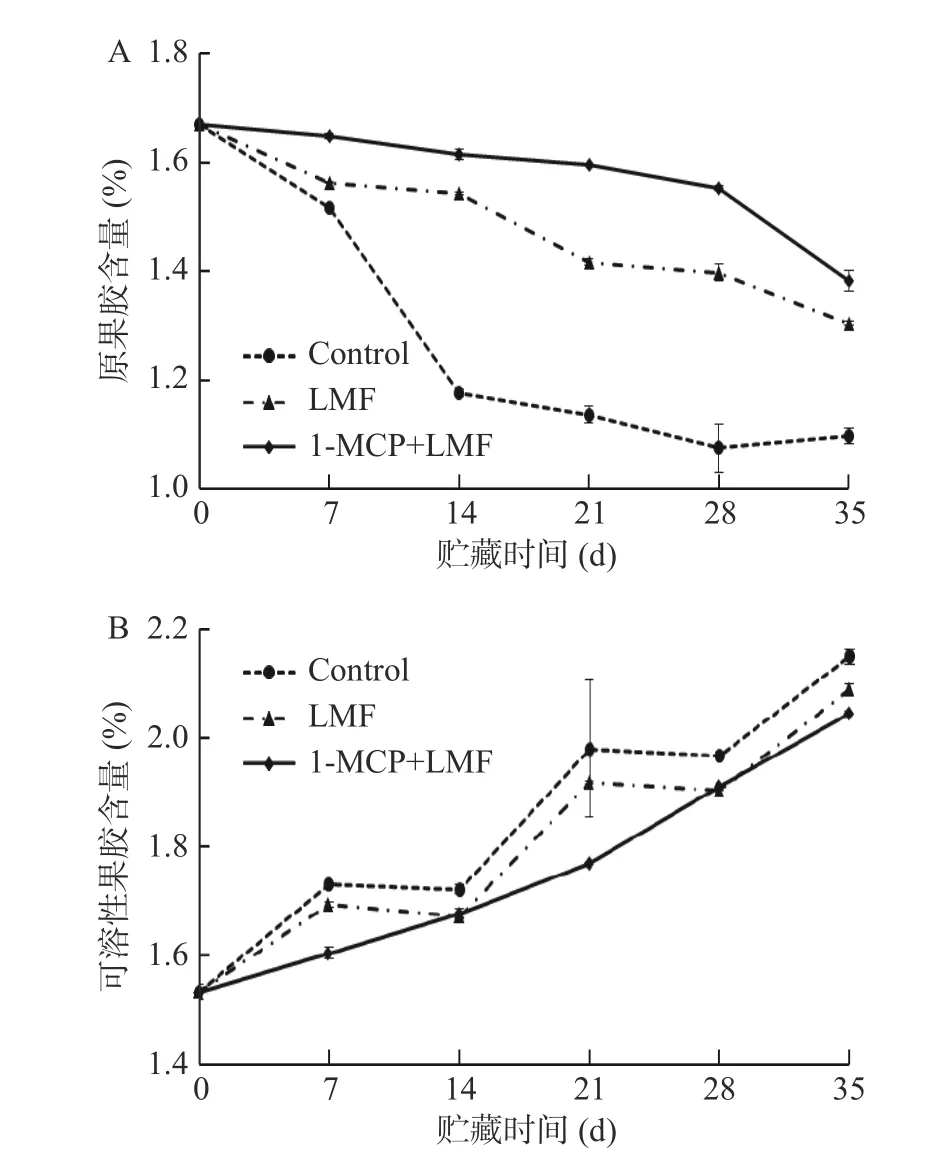
图7 1-MCP 结合激光微孔膜包装处理对水蜜桃原果胶和可溶性果胶含量的影响Fig.7 Effect of 1-MCP treatment combined with laser microporous film packaging on protopectin and soluble pectin content of honey peach
如图7B 所示,桃果实可溶性果胶含量在贮藏期间总体呈上升趋势,1-MCP+LMF 处理组果实内可溶性果胶含量在贮藏期间以较低速度缓慢上升,且均低于LMF 处理组和对照组;贮藏过程中,对照组可溶性果胶含量最高,除了贮藏第21 d 外,1-MCP+LMF和LMF 处理组均无显著(P>0.05)差异。上述结果表明,激光微孔膜包装对水蜜桃原果胶分解为可溶性果胶起到了一定的抑制作用,结合1-MCP 处理可有效抑制原果胶含量的减少,但对于抑制可溶性果胶含量上升效果不明显。
2.4.2 1-MCP 处理结合激光微孔膜包装对水蜜桃PG 和β-葡萄糖苷酶活力的影响 PG 作为主要的细胞壁降解酶之一,可水解聚半乳糖醛酸中的α-1,4 半乳糖苷键,降解细胞壁的结构骨架,导致果实软化。如图8A 所示,桃果实贮藏期间PG 活性总体呈上升趋势。贮藏14 d 内,三组果实PG 活性缓慢上升;贮藏14~21 d,对照组PG 活性快速上升,而1-MCP+LMF 和LMF 处理组PG 活性21 d 后才开始快速上升;贮藏28~35 d,各组PG 活性变化较小;贮藏第35 d时各组PG 活性均达到峰值,对照组、LMF 处理组及1-MCP+LMF 处理组PG 活性分别上升了4.49、2.29 和2.22 倍。
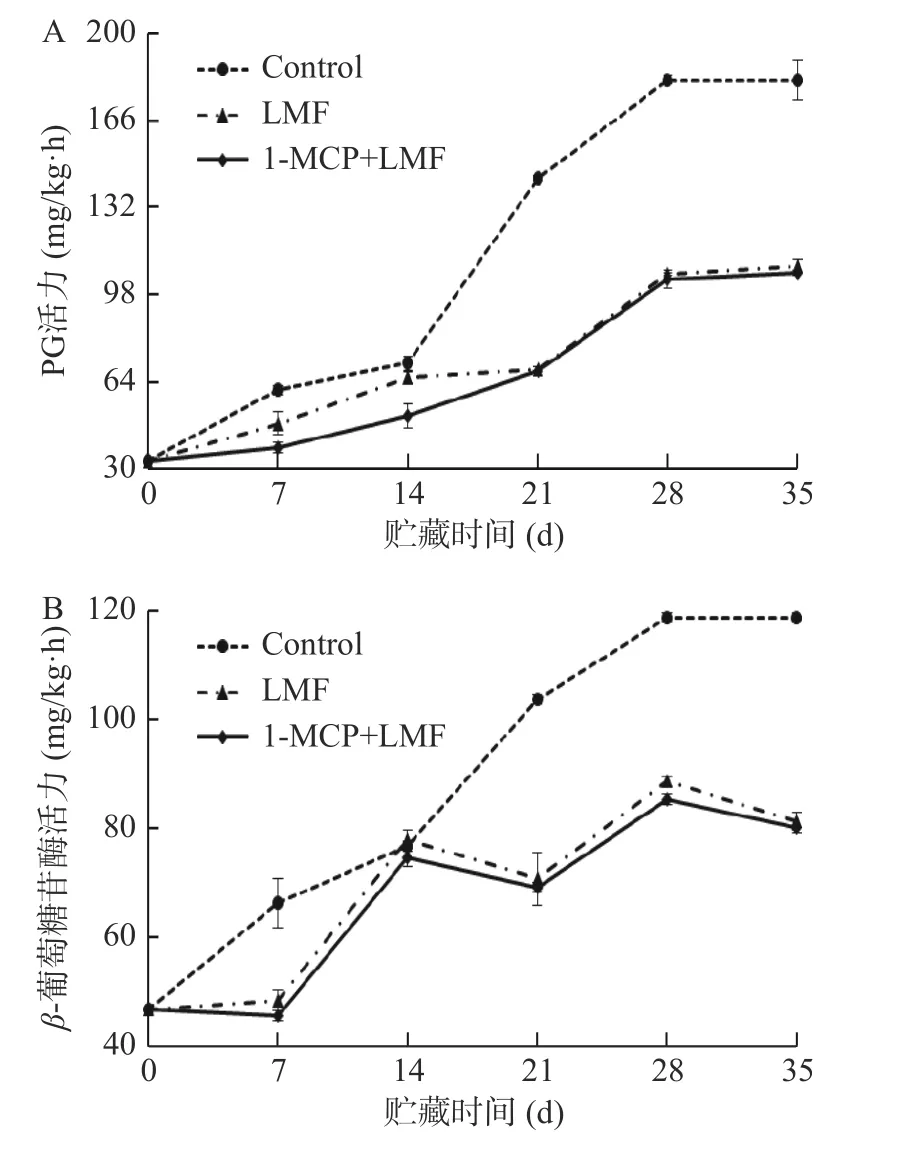
图8 1-MCP 结合激光微孔膜包装处理对水蜜桃PG 和β-葡萄糖苷酶活力的影响Fig.8 Effect of 1-MCP treatment combined with laser microporous film packaging on the PG and β-glucosidase activity of honey peach
β-葡萄糖苷酶主要降解果胶多聚醛酸侧链的半乳糖残基,破坏细胞壁结构。如图8B 所示,贮藏期间,桃果实β-葡萄糖苷酶活性总体呈上升趋势;对照组始终保持较快的酶活上升速度,而1-MCP+LMF和LMF 处理组β-葡萄糖苷酶活性在贮藏7~14 d 时才开始快速上升;贮藏28 d 时,各组酶活达到峰值,对照组、LMF 处理组及1-MCP+LMF 处理组PG 活性分别上升了1.54、0.74 和0.71 倍。贮藏期间,1-MCP+LMF 和LMF 处理组桃果实β-葡萄糖苷酶活性均显著(P<0.05)低于对照组,但在贮藏后期,LMF处理和1-MCP+LMF 处理组之间无显著(P>0.05)差异,与PG 活性结果一致。
3 讨论
采收后的果蔬仍会进行旺盛的生理代谢,导致其营养成分损失,品质下降。在生理成熟阶段收获如桃子等呼吸跃变型水果,会导致呼吸速率明显增加,从而刺激某些代谢变化[16]。因此,延长水果保质期的有效方法是将呼吸速率保持在最低水平,1-MCP 是乙烯的竞争性抑制剂,能与乙烯受体不可逆结合,抑制桃果实的呼吸速率。此外,环境中的气体组分对水蜜桃保鲜具有重要的影响,采用普通塑料薄膜包装容易造成包装内氧气浓度降低,引起果蔬的无氧呼吸,加速果实腐败变质[17]。适宜的采后处理措施可延缓果实生理代谢进程,减少水分损失,维持果实相对稳定的营养成分,其中微孔膜包装可有效地调节贮藏环境中的O2/CO2比。Cliff 等[18]研究发现,采用微孔膜包装的鲜切苹果,在贮藏结束时具有更好的硬度和感官品质。马佳佳等[19]研究发现微孔膜气调保鲜可以降低环境中的O2/CO2比,延缓枇杷果实理化品质的下降。本研究中,激光微孔膜包装处理和1-MCP结合激光微孔膜包装处理有效地抑制了“霞辉8 号”水蜜桃冷藏期间的呼吸强度,维持了可溶性固形物及抗坏血酸的含量,抑制了失重率的上升,其中复合处理效果更好,表明1-MCP 结合激光微孔膜包装对维持水蜜桃品质具有良好的协同效果。
采后果蔬体内清除ROS 能力下降,ROS 产生与清除失去平衡,导致果蔬体内积累过多的ROS,加速果实采后品质劣变。植物在长期的进化过程中,形成了一套完善的酶促反应系统来清除一定阈值内的ROS,其中SOD、CAT 和APX 是活性氧酶促清除系统的重要成员,提高SOD、CAT 和APX 活性有利于维持细胞内ROS 产生与清除的动态平衡,减少细胞膜损伤[20]。蔡佳昂等[13]研究表明,1-MCP 与微孔气调包装复合处理可抑制红苕尖CAT、SOD 活性的下降,有效延长红苕尖保鲜期。吉宁等[8]研究发现,微孔膜耦合不同浓度的1-MCP 处理能保持“贵长”猕猴桃果实较高的SOD、POD、CAT 酶活性,有效减少膜脂过氧化物的产生,延缓果实后熟衰老。本实验中,1-MCP 结合激光微孔膜包装维持了桃果实冷藏期间较高的ROS 清除相关酶(SOD、CAT 和APX)活性,降低了H2O2的产生,表明1-MCP 结合激光微孔膜包装对维持桃果实冷藏期间ROS 代谢平衡有较好的效果,这可能与激光微孔膜的选择性透气透水性有关。
活性氧和细胞壁物质代谢是引起果实软化的重要因素[21],果实软化会影响水蜜桃采后贮藏性能和货架寿命,加速果实腐烂变质。已有研究表明,细胞壁物质降解与果实软化密切相关,原果胶是保持细胞壁结构完整的果胶成分,贮藏期间逐渐降解为可溶性果胶[22]。PG 和β-葡萄糖苷酶是导致纤维素和果胶分解的关键酶,细胞壁降解酶协同作用导致细胞壁组分不稳定,果实软化腐烂[23-24]。殷健东[25]研究表明1 μL/L 1-MCP 处理可显著抑制“雨花露”水蜜桃冷藏期间PG、β-葡萄糖苷酶和Cx 等酶活力,维持细胞壁结构的稳定性,从而延缓果实软化。肖烟云[26]研究发现1.2 μL/L 1-MCP 处理可降低桃果实PG、Cx和β-半乳糖苷酶等细胞壁降解酶活力,延缓共价结合果胶、离子结合果胶、纤维素和半纤维素等细胞壁构成成分含量的下降及水溶性果胶含量的增加,从而保持桃果实较高的硬度,延缓后熟软化。本实验中,激光微孔膜包装结合1-MCP 处理可有效降低PG 和β-葡萄糖苷酶活性,从而缓解原果胶的水解,保持细胞壁结构完整,从而维持了较高的果实硬度,延缓了果实软化,但与1-MCP 的协同作用在贮藏后期较小。
4 结论
激光微孔膜包装可显著降低果实失重率,延缓可溶性固形物、抗坏血酸等营养成分的变化,维持果实硬度,抑制水蜜桃冷藏期间呼吸代谢,维持SOD、CAT 和APX 等活性氧代谢相关酶较高的活力,和较低的细胞壁分解酶活力,进而延缓了原果胶含量的下降和可溶性果胶含量的上升,最终延缓生理生化代谢进程,保持水蜜桃果实较好的感官品质。1-MCP 处理结合激光微孔膜包装具有协同效果,水蜜桃果实货架寿命在5 ℃条件下可达到28 d。该研究结果为1-MCP 处理结合激光微孔膜包装技术的产业化应用提供了理论依据。
