一株后生元菌株的抑菌特性研究及其细菌素基因簇的挖掘
2022-08-27张晓妍沙沈菲郭丽丹周婉婷陈雨滢汪立平
张晓妍,沙沈菲,郭丽丹,贾 爽,周婉婷,陈雨滢,汪立平,2,3,
(1.上海海洋大学食品学院,上海 201306;2.农业部水产品贮藏保鲜质量安全风险评估实验室,上海 201306;3.上海海洋大学食品热加工工程技术研究中心,上海 201306)
随着当今高密度集约化养殖模式的推进,水产动物病害频发,感染性疾病特别是细菌感染严重制约了水产养殖业的健康可持续发展。实验室前期从陕西汉中某大鲵养殖场的病鲵体内分离出了一株嗜水气单胞菌()。嗜水气单胞菌是我国流行最广泛的一种典型人-畜-水生动物共患致病菌,它不仅是引起鱼类运动性气单胞菌败血症的主要病原,也是两栖类、爬行类以及哺乳类动物的重要病原。抗生素类药物因高耐药性、药物残留和破坏养殖微生态平衡等局限,已无法满足水产养殖病害防治愈来愈高的需求。因此,当前迫切需要寻找可替代抗生素的治疗药物来应对嗜水气单胞菌引起的疾病感染。
近三十年来,饲料添加剂作为水产养殖业的抗生素替代物引起了科学界的广泛关注。益生菌、益生元及后生元作为最有前景的饲料添加剂之一,可用于防治水产动物的细菌性、病毒性及寄生虫性疾病。然而,益生菌作为一种活菌制剂,对体内环境要求较为苛刻,如遇高温、胃酸等环境便会失活,这成为了扩大其应用的障碍。研究指出,益生菌对机体的作用不一定与活菌有直接关系,起关键作用的极有可能是菌株代谢产物或菌体成分,这些活效因子正式被国际益生菌组织命名为后生元(Postbiotic)。后生元又称灭活益生菌,是益生菌经加工处理后的菌体及其代谢产物的统称。经过筛选的后生元,即便经过高温或肠胃消化液处理仍可保有高度功能活性,且比活性益生菌具有更好的安全性、吸收性和机体分布性,有利于促进宿主健康。
可产生细菌素的乳酸菌被认为是应用于食品、医疗等领域的潜在后生元,如日本的热灭活植物乳植物杆菌L-137(L-137)。细菌素是细菌代谢过程中产生的一类具有生物活性的多肽或蛋白质。天然来源的细菌素因其无毒副作用、不易产生耐药性、无残留和无污染等特点,符合水产品安全生产的需要,有望成为人类摆脱“耐药菌危机”的新手段。用它来对付大鲵感染的特定病原,对于减少其疾病感染、耐药菌的产生和传播都具有重要意义,是极具潜力和创新的替代选择。基于此,本文筛选了一株对中国大鲵病原嗜水气单胞菌有拮抗作用的产细菌素乳酸菌株,并对其进行了抑菌特性的研究和细菌素基因簇的挖掘,以评估其作为后生元菌株的潜在应用价值。
1 材料与方法
1.1 材料与仪器
指示菌嗜水气单胞菌Ah2 陕西汉中某大鲵养殖场病鲵体内腹水分离所得;鲤鱼上皮瘤细胞EPC上海海洋大学水产学院病原库赠予;筛选用泡菜、豆豉、腐乳、酸奶和奶酪样品 上海、武汉和青岛市售食品;LB 和MRS 肉汤干粉培养基 广东环凯微生物科技有限公司;无菌脱纤维羊血平板 青岛海博生物技术有限公司;抗菌药物药敏纸片 杭州微生物试剂有限公司;乙酸乙酯 分析纯,上海泰坦科技股份有限公司;Ezup 柱式基因组DNA 抽提试剂盒(细菌)、改良Bradford 法蛋白浓度测定试剂盒、过氧化氢酶(3000 U/mg)、木瓜蛋白酶(≥15 U/mg)、胃蛋白酶(≥2500 U/mg)、胰蛋白酶(≥180 U/mg)、蛋白酶K(≥20 U/mg)、Triton X-100 生工生物工程(上海)股份有限公司;胎牛血清 杭州四季青生物工程材料有限公司;M199 培养基、0.25%胰酶消化液美国Gibco 公司;双抗 北京兰杰柯科技有限公司;T培养瓶 无锡耐思生命科技股份有限公司;超低分子量3.3~20.1 kD 蛋白质Marker 北京索莱宝科技有限公司;Tricine-SDS-PAGE 凝胶配制试剂盒上海万生昊天生物技术有限公司;SDS、Tris BBI(上海)生命科学有限公司;2×Tricine loading buffer中科瑞泰(北京)生物科技有限公司。
SPX-250B-Z 生化培养箱 上海博讯实业有限公司医疗设备厂;7200 型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;A200 型梯度PCR 仪 杭州朗基科学仪器有限公司;H2050R 台式真空冷冻离心机 湘仪离心机仪器有限公司;RV8V 旋转蒸发仪德国IKA;JY-SCZ2+电泳仪 北京君意东方电泳设备有限公司;FE28 酸度计 瑞士METTLER TOLEDO;IX71 光学倒置显微镜 日本OLYMPUS;Gel Doc 凝胶成像系统 美国BIO-RAD;SU5000 扫描电子显微镜 株式会社日立制作所。
1.2 实验方法
1.2.1 产细菌素乳酸菌株的筛选
1.2.1.1 指示菌Ah2 菌液的制备 将甘油管冻存的指示菌Ah2 划线接种至固体培养基,28 ℃静置孵育24 h;挑取单菌落接种至10 mL LB 肉汤,28 ℃、150 r/min 摇床培养8 h 后得种子液,将种子液以1%的接种量接入LB 肉汤,上述条件培养后即得指示菌Ah2 菌液。
1.2.1.2 乳酸菌无细胞上清液的制备 从市售泡菜、豆豉、腐乳、酸奶和奶酪共20 份样品中各取1 g 加入含9 mL 的0.85%无菌生理盐水均质袋中,均质15 min。10 倍稀释至10,取各浓度稀释液100 μL均匀涂布在含CaCO的MRS 固体平板上,30 ℃孵育24~48 h。挑取产生溶钙圈的菌落划线纯化3 次。将长好的单菌落接种至10 mL MRS 液体培养基中,30 ℃、150 r/min 摇床培养24 h 得种子液,将种子液以2%接种量接入液体培养基,上述条件培养后得发酵液。取适量体积发酵液于4 ℃、10000 r/min 离心15 min 后收集上清液。将上清液用磷酸钠缓冲液(pH7.0)调节至pH6.0,以此消除有机酸的干扰。0.22 μm 滤膜过滤后,加入适量过氧化氢酶使之终浓度为1 mg/mL,以此消除过氧化氢的作用。以上处理后即得无细胞上清液(Cell free supernatant,CFS)。
1.2.1.3 产细菌素优良乳酸菌的筛选 基于多肽抗菌性测定法改良,采用稳定性优于纸片扩散法和牛津杯法的打孔法结合双层平板法筛选具有优良抑菌活性的产细菌素菌株。于10 mm 平皿中预先倒一层含2%(w/v)琼脂的素琼脂培养基,将1‰(v/v)上述制得的指示菌Ah2 菌液与冷却至50 ℃的LB半固体培养基(1%琼脂含量)预先混合后倾注平板,使板内菌浓度约为10CFU/mL,制备成双层平板。凝固1 h 后,用直径6 mm 的无菌枪头垂直打孔,枪头尖端挑出孔内琼脂。吸取50 μL 待测菌CFS 加至孔内,4 ℃扩散2 h,28 ℃正置培养6~8 h 观察结果,每个待测菌株设置三个重复。游标卡尺测量并记录抑菌直径。通过抑菌直径评价各菌株的抑菌活性,后续研究选择抑菌活性最佳的菌株进行。
1.2.1.4 产细菌素优良乳酸菌的鉴定 将筛选得到的产细菌素乳酸菌株接种到MRS 肉汤中,30 ℃、150 r/min 摇床振荡培养24 h 后,于4 ℃、12000 r/min离心1 min,弃上清。采用Ezup 柱式基因组DNA抽提试剂盒(细菌)提取菌株基因组DNA,用细菌16S rDNA 通用引物27F(5′-AGAGTTTGATCCTGG CTCAG-3′)和1492R(5′-GGTTACCTTGTTA CGA CTT-3′)进行PCR 扩增,扩增条件为94 ℃ 3 min,94 ℃1 min,60 ℃ 1 min,72 ℃ 1 min,35 个循环。扩增产物送至上海生物工程有限公司测序,经NCBI 数据库同源性比对后,邻接法构建系统发育树鉴定到种。
1.2.1.5 产细菌素优良乳酸菌的生长曲线与细菌素产量动态分析 挑取优良菌株单菌落接种至10 mL MRS 液体培养基中,30 ℃,150 r/min 摇床培养18 h得种子液,种子液以2%的接种量接入500 mL 液体培养基,上述条件培养至48 h。每间隔4 h 取样测定菌株发酵液的细胞密度OD、pH 及菌株CFS 的抑菌活性,绘制生长动态图。CFS 根据1.2.1.2 方法制备,抑菌活性参照1.2.1.3 方法测定,每个测定数据设置三个重复。
1.2.1.6 产细菌素优良乳酸菌株的药敏特性分析参照1.2.1.3 方法制备双层平板。表面待干后贴上标准药敏纸片,置30 ℃生化培养箱24 h。游标卡尺测量并记录抑菌圈直径。菌株对10 种抗生素的药敏特性检测参照国标进行。
1.2.2 乳酸菌产细菌素的抑菌特性探究
1.2.2.1 细菌素的初步纯化 取上述制得的CFS 与乙酸乙酯以1:1(v/v)萃取。萃取3 次,每次萃取2 h。CFS 一次全部加入,乙酸乙酯体积3 等分依次加入,每次加入后均需振荡混匀。待分层清晰后,将上层萃取液转移至旋蒸瓶,40 ℃、80 r/min 旋蒸除去乙酸乙酯,即得细菌素粗提物。冷冻干燥后用适量超纯水悬浮,即得细菌素粗提液(Crude extract of bacteriocin,CEB)。适当稀释CEB 用于考马斯亮蓝法蛋白测定试剂盒测定细菌素粗提液的蛋白浓度。
1.2.2.2 细菌素的稳定性分析 将适量稀释的CEB(蛋白浓度约6.47 mg/mL)分别按以下处理进行细菌素的酸碱耐受性、热稳定性、酶敏感性和贮藏稳定性测定:a.用对应缓冲液调节CEB 的pH 至2.0~10.0,37 ℃水浴4 h 后调回pH6.0,使用不含CEB 的对应pH 缓冲液作为对照。缓冲液种类如下:甘氨酸盐酸盐缓冲液(pH2.0),柠檬酸-磷酸盐缓冲液(pH3.0~6.0),磷酸钠缓冲液(pH7.0),Tris 盐酸盐缓冲液(pH8.0~9.0)和甘氨酸-氢氧化钠缓冲液(pH10);b.-20、60、80、100 和121 ℃分别处理各30 min,冷却至室温,以未处理的CEB 为对照;c.加入终浓度为1 mg/mL 木瓜蛋白酶、胃蛋白酶、胰蛋白酶和蛋白酶K 溶液,37 ℃温浴2 h 后,80 ℃加热 15 min使蛋白酶失活,以未处理的CEB 为对照;d.4 ℃下分别储存1、3、6 和9 个月,以未处理的新鲜CEB 为对照。以上参照1.2.1.3 测定抑菌活性,每个处理组设置三个重复。
1.2.2.3 细菌素的抑菌谱检测 基于1.2.1.3 所述双层平板法结合打孔法测试细菌素对16 种指示菌的抑制效果。每孔加入50 μL 适量稀释的CEB(蛋白浓度约6.47 mg/mL),每种指示菌设置三个重复。
1.2.3 优良乳酸菌产细菌素对嗜水气单胞菌Ah2 的抑菌效果评估
1.2.3.1 抑菌强度测定与溶血反应 参考国标和阳离子抗菌肽方法测定细菌素对Ah2 的最小抑菌浓度(Minimum inhibitory concentration,MIC)和最小杀菌浓度(Minimum bactericidal concentration,MBC)。于96 孔板中等比稀释CEB(起始蛋白浓度约为1.08 mg/mL),共10 个浓度梯度。将10 μL 不同浓度稀释液与90 μL 含Ah2 菌悬液(约10CFU/mL)混合,分别以Ah2 菌悬液和CEB 为阳性有菌对照和阴性无菌对照,28 ℃孵育12 h。肉眼观察是否有细菌沉淀,肉眼无可见细菌沉淀对应最小浓度数值即为MIC。从MIC 起向高浓度选4 个浓度梯度,每个浓度梯度取50 μL 加至血平板中28 ℃静置培养24 h,观察溶血反应,无Ah2 溶血圈对应最小浓度数值即为MBC。每个梯度设置三个重复。
1.2.3.2 细胞毒性变化分析 将复苏后的EPC 细胞置于含有培养液(M199 培养基、10%(v/v)FBS 和1%(v/v)双抗)的T瓶中25 ℃孵育至80%的细胞密度,调整细胞浓度至2×10/mL。取0.1 mL 加入24 孔板中,将1.2.3.1 测得的MIC 和MBC 对应孔溶液各10 μL 分别加入含有细胞的孔中,作用12 h。分别以Ah2 菌液和CEB 为阳性有菌对照和阴性无菌对照。光学倒置显微镜观察Ah2 引起的细胞形态变化,确定细菌素对Ah2 的抑菌效果。每个浓度设置三个重复。
1.2.3.3 显微结构变化分析 参考辛维岗等的方法制备样本,扫描电子显微镜(Scanning electron microscope,SEM)观察经LP01 处理后指示菌Ah2超微结构的变化,初步探究细菌素LP01 的作用机制。
1.2.4 细菌素的分子量测定与凝胶原位抑菌活性检测
1.2.4.1 细菌素分子量的测定 将CEB 适当稀释用于紫外全波长扫描定性,验证其是否为肽或蛋白类物质。其次,采用Tricine-SDS-PAGE 电泳测定分子量。首先预电泳,即不加样品于30 V 电压下运行约30 min;将样品按说明书变性处理后,于凝胶两侧平行上样,每孔10 μL,80 V 运行30 min,以样品条带尾部跑至浓缩胶前沿为准;最后100 V 运行4~5 h,当条带距离凝胶底部约0.5~1 cm 时,停止电泳。将其中一半凝胶用于考马司亮蓝R250 凝胶染色1 h 后脱色处理,根据marker 条带判断细菌素分子量范围。
1.2.4.2 细菌素抑菌活性的验证 将电泳后的另一半凝胶参照邓晓娟等所述方法用于凝胶原位检测,即将凝胶转移至无菌平皿中,加入1% Triton X-100(v/v)温和摇动20 min,使细菌素在凝胶原位复性;弃去Triton X-100 并用无菌水漂洗2 次后,加入0.1 mol/L、pH7.2 的磷酸缓冲液温和摇动30 min,弃去缓冲液。将凝胶置于按1.2.1.3 方法制备的含指示菌Ah2 双层平板上,28 ℃培养过夜,观察有无抑菌透明带。
1.2.5 产细菌素乳酸菌株的全基因组测序及细菌素基因簇的挖掘 通过Illumina Hiseq×10 平台(2×150 bp)进行双端测序(PE150),利用组装软件SOAPdenovo2 局部组装及优化形成多条基因组scaffolds,得到菌株的全基因组序列。通过在线软件BAGEL4,挖掘菌株的抗菌物质相关基因簇,预测植物乳植物杆菌M4L1 可能产生的细菌素种类。
1.3 数据处理
以上所测数据均包含3 次生物学重复,以平均值±标准差方式呈现。利用Origin 9.0 和IBM SPSS 25.0 统计软件分别对数据进行处理与分析。
2 结果与分析
2.1 产细菌素乳酸菌株的筛选
2.1.1 产细菌素优良乳酸菌的筛选与鉴定 分别从泡菜、豆豉、酸奶、干酪和腐乳的20 份样品中共分离出近80 株乳酸菌。筛选得到4 株对Ah2 具有较好拮抗作用的菌株(图1、表1),CFS 抑菌直径范围在(16.85±0.14)mm 至(25.13±0.27)mm 之间,存在显著差异(<0.05),最终确定抑菌活力最佳菌株M4L1进行后续研究。菌株M4L1 在MRS 琼脂平板上形成乳白色、凸起、表面光滑且圆润的菌落,革兰氏染色结果显示为一株革兰氏阳性菌,呈直或弯的杆状,单个、有时成对或成链状(图2)。16S rDNA 序列(Genbank 登录号:MZ753464.1)结合系统发育分析鉴定M4L1 为植物乳植物杆菌()。

图1 四株乳酸菌对Ah2 的抑菌效果对比Fig.1 Comparison of inhibition effect on four strains of lactic acid bacteria against Ah2

表1 四株乳酸菌的抑菌活性Table 1 Antimicrobial activity of four strains of lactic acid bacteria
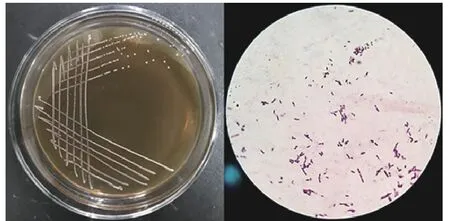
图2 菌株M4L1 的菌落形态和显微形态图Fig.2 Colony and microscopic morphology of M4L1
2.1.2 植物乳植物杆菌M4L1 的生长动态及抑菌活性规律 如图3 所示,M4L1 从4 h 起进入对数生长期,在24 h 时达到最大生物量,24~44 h 间处于稳定期,44 h 后进入衰亡期;同时,CFS 的抑菌直径也从4 h 起明显增加,在稳定期(24 h)达到最大,而抑菌圈直径的变化反映了细菌素的抑菌活性即细菌素产量的变化,由此说明细菌素从M4L1 对数生长期起开始分泌至稳定期达到最大产量,与M4L1 的生长规律相符合。该规律体现了植物乳植物杆菌M4L1 产生的细菌素为次级代谢产物,其产量与M4L1 的生物量有关,因此选定24 h 为植物乳植物杆菌M4L1发酵培养的最佳时间。
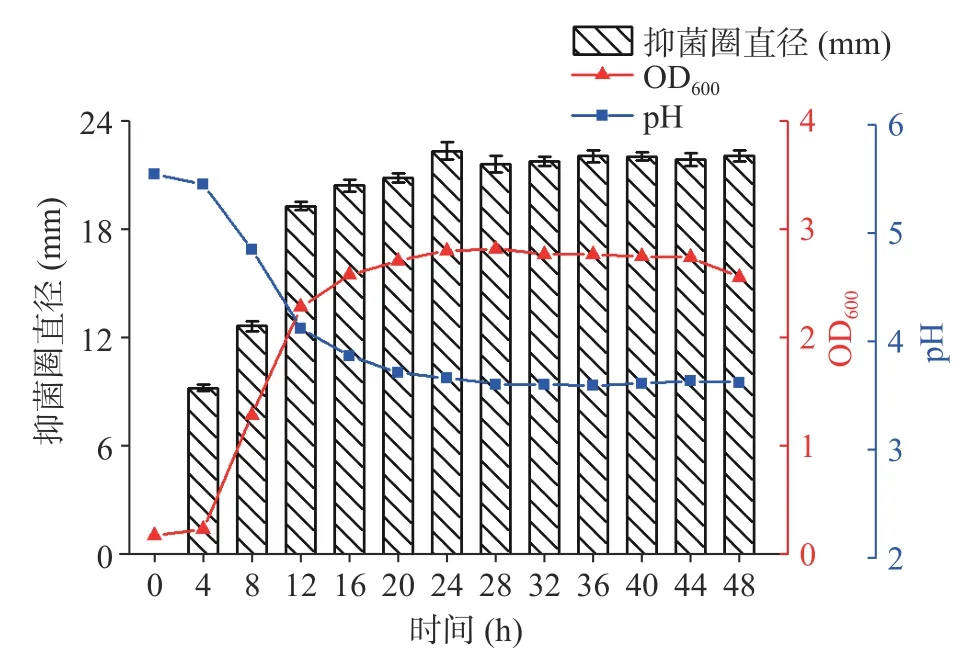
图3 植物乳植物杆菌M4L1 的生长动态及抑菌活性规律Fig.3 Growth dynamics and antimicrobial regularity of L.plantarum M4L1
2.1.3 植物乳植物杆菌M4L1 的药敏特性 拮抗菌株对10 种抗生素的药敏特性见表2。该菌对复方新诺明、头孢曲松、氨苄西林、氯霉素和四环素等5 种抗生素高度敏感,对红霉素中度敏感,对其余4 种药物耐药。该结果与许多报道的相近,说明不同来源的植物乳植物杆菌存在一些类似的药敏特性。
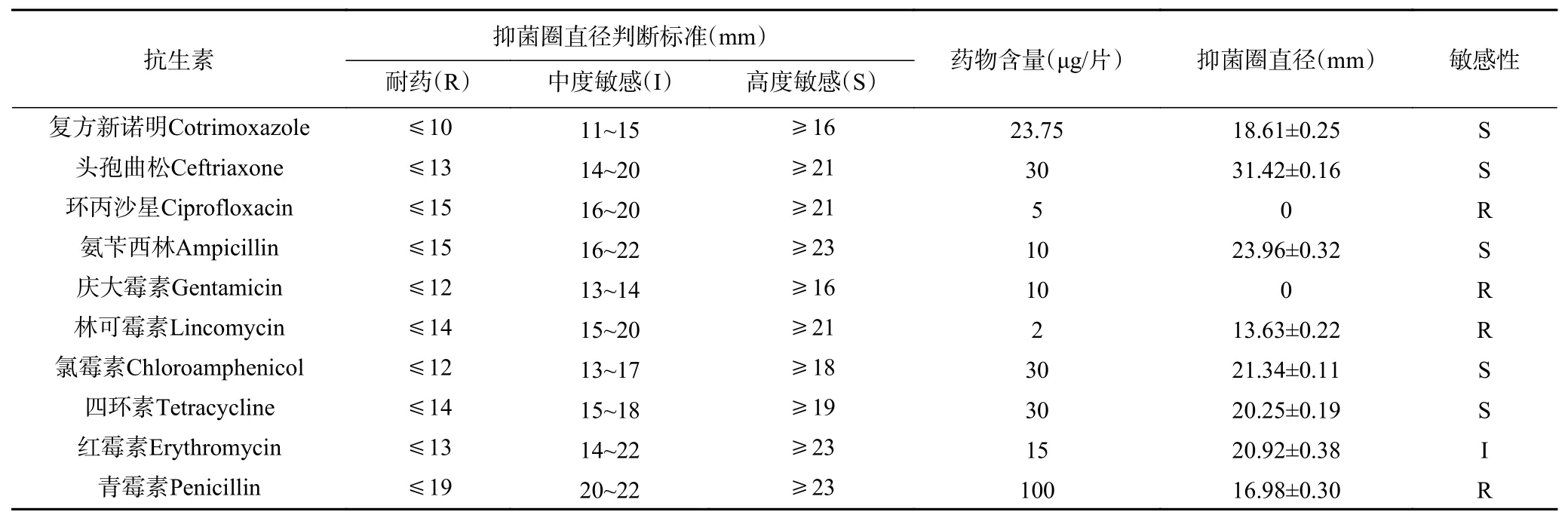
表2 植物乳植物杆菌M4L1 的药敏特性Table 2 Antibiotic susceptbility of L. plantarum M4L1
2.2 植物乳植物杆菌产细菌素LP01 的抑菌特性
2.2.1 细菌素LP01 的稳定性 采用有机溶剂萃取法对M4L1 产细菌素进行初步纯化,得到细菌素半纯化产物并命名为LP01。根据以下公式计算抑菌活性的变化:抑菌活性变化率(%)=(处理组CEB 的抑菌圈直径-对照组CEB 的抑菌圈直径)/对照组CEB 的抑菌圈直径×100。酸碱耐受性测试中(图4A),LP01 在过酸(pH2)和过碱(pH10)处理后仍保持较高的抑菌活性,在pH7 时抑菌活性达到最大,与对照组相比显著增加了6.22%(<0.05)。pH8~10时抑菌活性发生了显著下降(<0.05),但最低仍保持了80.02%±0.94%的抑菌活性,与食品工业已商用的拮抗添加剂Nisin A 相比,LP01 可耐受更广泛的酸碱环境;经-20~121 ℃处理30 min 后(图4B),其抑菌活性无显著变化(>0.05);经9 个月贮藏期后(图4C),抑菌活性仅下降了9.19%;LP01 经4 种蛋白酶处理后(图4D),抑菌活性发生了不同程度的显著下降(<0.05),表明其具有蛋白质的性质。而经胃蛋白酶和胰蛋白酶处理后抑菌活性仍有70.95%±1.11%和67.45%±0.91%,体现出其良好的消化酶耐受性。综上,细菌素LP01 不仅在广泛的pH 和温度下具有良好的稳定性,且具备良好的消化酶耐受性和贮藏稳定性。
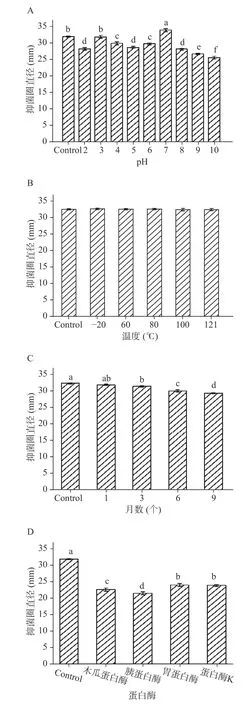
图4 细菌素LP01 的耐受性Fig.4 Tolerance of bacteriocin LP01
2.2.2 细菌素LP01 的抑菌谱 细菌素LP01 对测试中的14 株菌均有不同程度的抑制效果(表3)。其中,有8 株革兰氏阴性菌,除腐败希瓦氏菌外抑菌直径均大于25 mm,尤其是我国最重要的人畜共患“超级细菌”鲍曼不动杆菌,其抑菌直径高达(32.53±0.22)mm;另有6 株革兰氏阳性菌,尤其是冷藏食品中常见腐败菌单增李斯特氏菌和口腔疾病龋齿病原变形链球菌,其抑菌直径高达(36.67±0.29)和(28.90±0.36)mm。然而LP01 对腐生葡萄球菌抑制作用低,对真菌如德巴利汉逊酵母和酿酒酵母几乎无抑制。综上,LP01 能够抑制一些人畜共患致病菌、水产病原菌及食品腐败菌等,体现出细菌素LP01 具有较广的抑菌谱。

表3 细菌素LP01 的抑菌谱Table 3 Antibacterial spectrum of bacteriocin LP01
2.3 细菌素LP01 对嗜水气单胞菌Ah2 的抑菌效果
2.3.1 溶血与细胞毒性变化 将CEB 等比稀释后,测得LP01 对Ah2 的MIC 约为12.94 μg/mL,该数值低于大多数抑制嗜水气单胞菌的细菌源抗菌肽和经典人源抗菌肽LL-37 的MIC 值,MBC 约为25.88 μg/mL,LP01 具有良好的抑菌强度。将MIC、MBC 组用于溶血检测和细胞毒性试验观察LP01作用Ah2 前后的溶血与细胞毒性变化。结果显示(图5A、B):MIC 组观察到-溶血圈、EPC 细胞裂解死亡现象,与阳性对照相比Ah2 溶血性和毒性均有降低,MIC 有效抑制了Ah2 的生长,使之维持在较低的细菌浓度;MBC 组未观察到溶血圈、EPC 细胞大小均匀且形态完好,与阴性对照几近一致,MBC 完全杀灭了Ah2。以上表明Ah2 具有较强的细胞毒性,但经LP01 处理后,其引起的溶血和细胞毒性均有所减缓,细菌素LP01 对Ah2 具有明显的抑制效果。
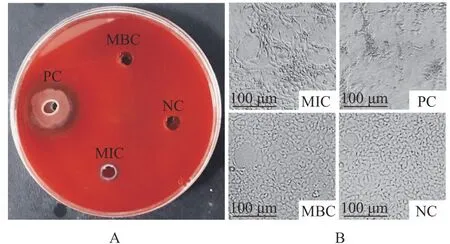
图5 细菌素LP01 对Ah2 引起的溶血活性和细胞毒性的影响Fig.5 Effect of bacteriocin LP01 on hemolysis and cytotoxicity caused by Ah2
2.3.2 显微结构变化 通过SEM 观察LP01 作用Ah2前后菌体细胞结构的变化。图像显示,经MIC 处理后(图6B1),Ah2 菌体细胞发生扭曲,表面出现褶皱,细胞质膜和细胞壁之间形成了电子透明区,与未处理的Ah2 相比(图6A1)有轻微质壁分离的现象;经MBC 处理后(图6C1、C2),细胞因相互挤压而收缩变形,细胞质内容物溶出,细胞几乎完全破裂。可见细菌素LP01 对Ah2 的细胞壁造成了一定程度的破坏,而细胞质内容物的溶解推测或许是膜通透性转变的结果。
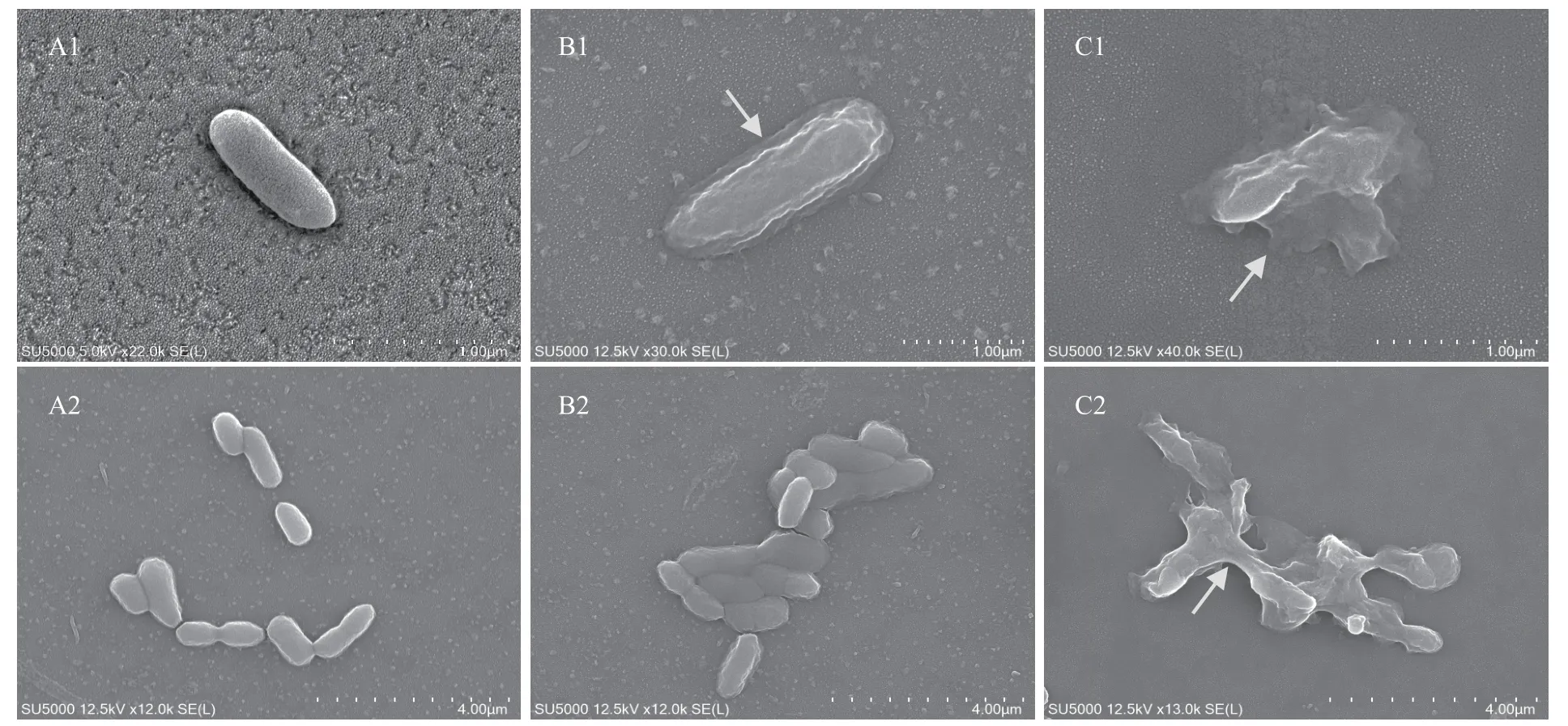
图6 指示菌Ah2 的SEM 图Fig.6 SEM images of indicator Ah2
2.4 细菌素LP01 的分子量与原位抑菌活性
紫外全波长扫描分析显示,LP01 在肽和蛋白对应吸收波长处均有吸收峰,而前者吸收峰更显著(图7),说明LP01 为肽类细菌素。Tricine-SDS-PAGE电泳显示LP01 在染色凝胶上呈现出清晰良好的谱带,判断细菌素LP01 分子量范围在3.3~4.0 kDa 内。凝胶原位活性检测显示,指示菌平板的凝胶上只出现了一条抑菌透明带(图8),和染色凝胶的谱带相吻合,直观说明该条带即为LP01 的谱带,以此确定LP01为小分子肽类细菌素。
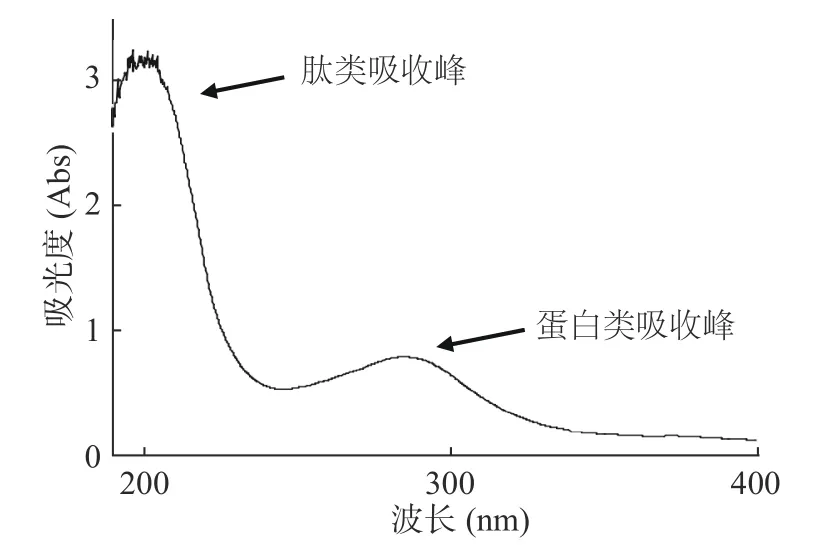
图7 细菌素LP01 的紫外全波长扫描图Fig.7 UV full-wavelength scanning of bacteriocin LP01
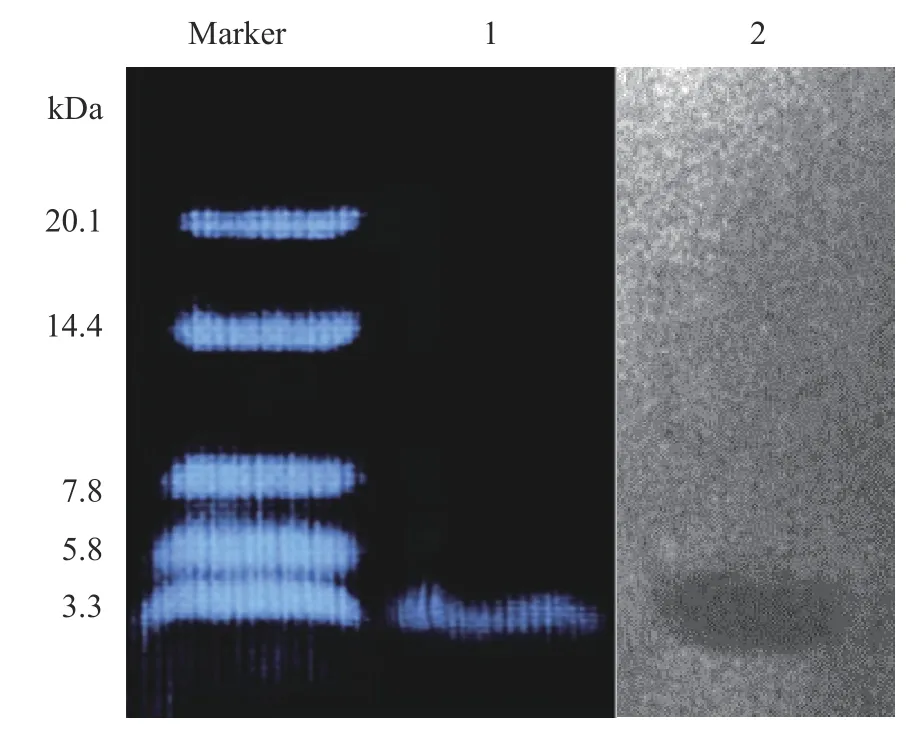
图8 细菌素LP01 的Tricine-SDS-PAGE 电泳图Fig.8 Tricine-SDS-PAGE of bacteriocin LP01
2.5 植物乳植物杆菌M4L1 的潜在细菌素基因簇
根据M4L1 的全基因组序列信息(登录号:SA MN26138624)可知,其总基因组大小为3273432 bp,其中,鸟嘌呤和胞嘧啶(G+C)占总DNA 的平均含量的44.37%;将基因片段经过组装优化形成了251 条基因组scaffolds;CDS(蛋白质编码区)共3215 个,基因平均长度为852.10 bp;非编码区rRNA、sRNA和tRNA 的数量分别为2、48 和57。另外,利用BAGEL4 挖掘菌株M4L1 可能产生的细菌素。结果显示,M4L1 细菌基因组中存在2 个潜在热点区域(Areas of Interest, AOI),检测到有三种蛋白质与来自植物乳植物杆菌的II 类细菌素序列达100%一致,分别为Plantaricin K、Plantaricin E 和Plantaricin F。其中Plantaricin F 为其双甘氨酸前导肽。Plantaricin K 所在生物合成基因簇中(图9A),有一个ORF(Open reading frame)编码具有输出细菌素功能的特定免疫蛋白;Plantaricin E 所在生物合成基因簇中(图9B),大多数ORFs 与plnD、plnI、plnH 和plnS 具有同源性,表明它们同属于pln 操纵子,参与植物乳植物杆菌细菌素的产生。另外,位于同一操纵子的Plantaricin E 基因上游有一个lanT 基因编码ABC 转运蛋白、ATP 结合蛋白和渗透酶蛋白PlnG。其中结构保守的ABC 转运蛋白是细菌素合成核心蛋白,含有该蛋白的细菌素通常具有抗菌活性。综上推测,植物乳植物杆菌M4L1 或产生不止一种细菌素,即上述关于细菌素LP01 的抑菌特性研究结果可能涉及多种细菌素。
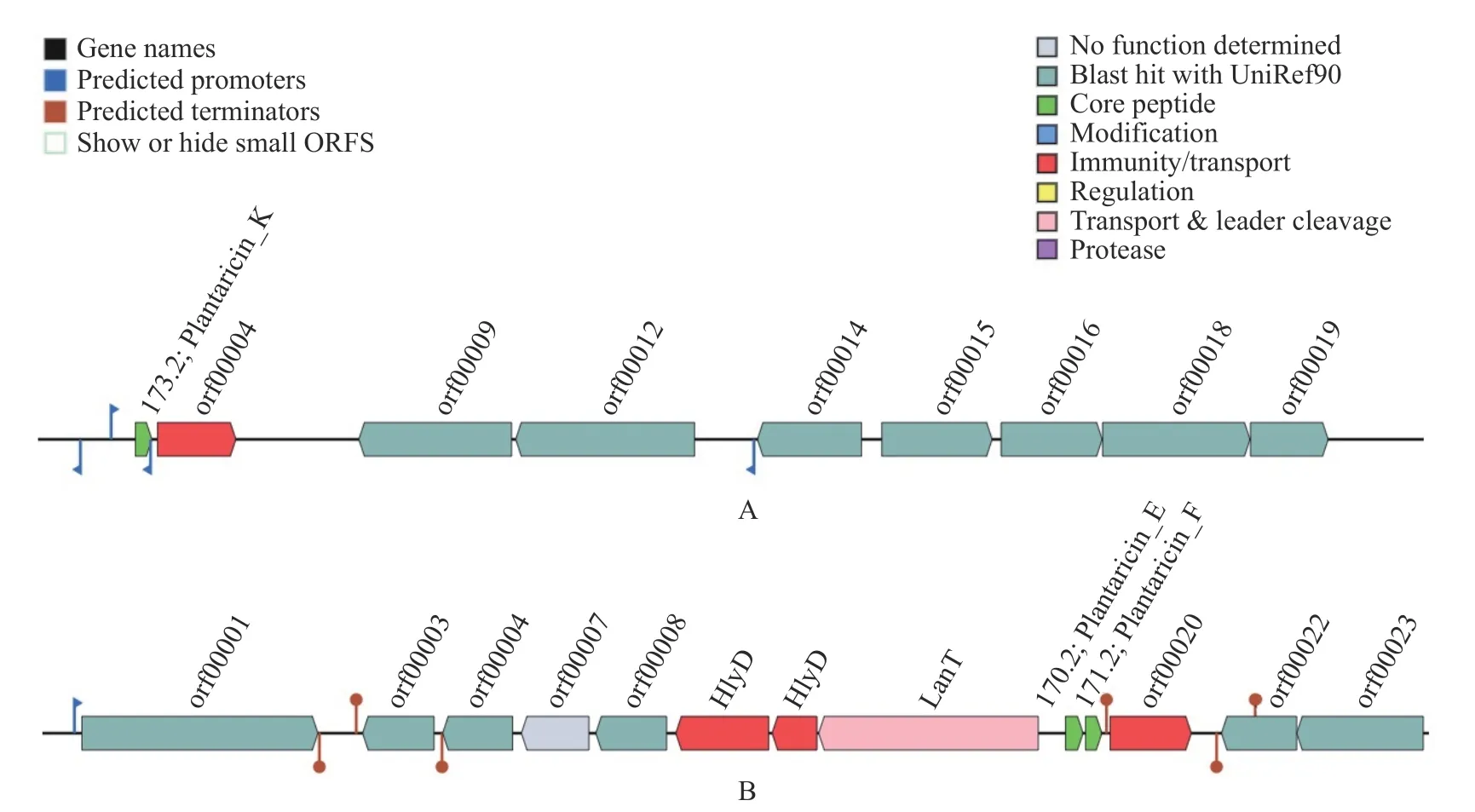
图9 植物乳植物杆菌M4L1 的细菌素基因簇图谱Fig.9 Genetic organization map of bacteriocin gene clusters of L. plantarum M4L1
3 结论
本研究从发酵腐乳中筛出一株可抑制Ah2 的优良M4L1。首先,菌株的酸碱、热、消化酶耐受性等是决定其能否应用为后生元的关键。细菌素LP01 的耐受性分析结果表明:经酸碱处理后的LP01 对Ah2 的抑菌活性最低仍保持在80.02%±0.94%;经多种消化酶处理后,抑菌活性最低仍保留了67.45%±0.91%;在-21~121 ℃几乎无抑菌活性的丧失。细菌素LP01 不仅分子量小,还表现出优良的酸碱、热、消化酶耐受性及贮藏稳定性。其次,作为一种抑菌物质,抑菌活力的范围和强度是评价其抑菌效果的重要指标。抑菌谱检测发现,细菌素LP01 具有广谱抑菌特性,能够有效抑制包括水产致病菌、食品腐败菌及人畜共患致病菌在内的多种病原菌;通过研究其抑菌效果发现,经LP01 处理后Ah2 的溶血性和细胞毒性明显降低;经进一步的SEM 观察推测,LP01 的抑菌或杀菌作用或许是细胞膜通透性改变的结果;另外,基因预测到M4L1 包含2 个潜在的细菌素合成基因簇。由此可见,作为一株生物安全菌株,植物乳植物杆菌M4L1 具备良好的产细菌素能力。因此,细菌素LP01 不仅有望作为生物防腐剂用于控制食品中存在的多药耐药菌株,还为水产动物病害与人类疾病防治药物的筛选提供了新方向。
后生元作为一种灭活益生菌,通过其代谢产物发挥益生功效。既不需要以活菌形式存在,也无需在动物胃肠道内定殖,弥补了传统益生菌的不足。本文研究的M4L1 及其细菌素LP01 具有作为保护剂拮抗多种病原体的能力,是水产病害防治潜在的后生元菌株,对促进水产养殖业健康发展具有重要的意义。后续还须对其高度纯化以深入探讨其抑菌效果、结构与作用机制等,以期得到乳酸菌更丰富的细菌素资源库。
