一种鼠骨性关节炎低温造模装置的设计及使用效果评价
2022-08-26贾彩霞严辰媛薛荣利哈小琴
贾彩霞,严辰媛,薛荣利,哈小琴,3*
(1.兰州大学公共卫生学院,兰州730000;2.联勤保障部队第940 医院检验科,兰州730050;3.甘肃省干细胞与基因药物重点实验室,兰州730050)
0 引言
骨性关节炎又称退行性关节病,是一种以关节软骨的变性、破坏和骨质增生为特征的慢性关节病[1-2]。目前,全球骨性关节炎患者超过2.5 亿,且呈现年轻化趋势[2]。世界卫生组织将肿瘤、心脑血管疾病和骨性关节炎并称为危害健康的三大杀手[3]。骨性关节炎对人类健康的危害不容忽视,它是造成中老年人群丧失劳动力的主要原因[4-5],而目前并没有能够治愈骨性关节炎的有效手段。
探究骨性关节炎的发病机制,或是寻找有效的治疗手段,动物实验都是不可或缺的部分,建立符合人类骨性关节炎病理特征的动物骨性关节炎模型,是动物实验最基础也是最重要的部分。目前,动物骨性关节炎模型的建立手段主要有手术法和非手术法[6-11],手术法主要包括交叉韧带切除和Hulth 法,非手术法主要包括冷应激、基因敲除、机械损伤和药物诱发。在建立模型时,手术方式主要是使关节不稳、应力改变,从而导致退行性病变,然而,手术通常伴随感染等并发症,使模型建立失去精准性,动物模型的病理进程特征与人类骨性关节炎会出现一定的偏差。而药物造模是在短期内快速破坏软骨等关节组织,病理特征更类似于人类的急性损伤[12-15]。相较于其他方式,冷应激建立模型是通过长时间的低温刺激,持续缓慢地破坏软骨细胞和滑膜细胞的生存环境,引起细胞外基质降解以及软骨细胞的凋亡等,从而导致关节软骨变性及退化,引起关节慢性病变[16],动物模型的病理过程更加符合人类骨性关节炎的退行性病变。
然而,在使用冷应激建立动物骨性关节炎模型时,因固定动物花费时间长、动物挣扎剧烈、单人操作困难、低温装置控温难,使得动物的固定和温度的控制始终是一个难题。现有研究中,冷应激建立动物骨性关节炎模型多是借助鼠常规固定器,将小鼠放入冰水混合槽中,需要人工密切关注温度变化,存在诸多问题,比如在同一条件及同一时间段下较难大量建立模型、低温无法稳定可控、鼠的剧烈挣扎常常导致操作者被抓伤或咬伤等[17]。基于此,本文设计一种鼠骨性关节炎低温造模装置,并对其使用效果进行评价。
1 鼠骨性关节炎低温造模装置设计
鼠骨性关节炎低温造模装置由控温箱和鼠固定器组成(如图1 所示),其制作材料主要为有机玻璃和金属。本装置的作用原理为稳定的关节低温局部刺激导致软骨细胞和滑膜细胞的正常生存环境发生改变,从而使细胞变性、凋亡。
1.1 控温箱外观结构设计
鼠骨性关节炎低温造模装置的外形是长方体,呈敞口结构,中间横向并列卡位条,其上有多个卡位槽。卡位条呈细长的长方形,两端可固定在控温箱体上。控温箱内可放置预冻过的冰袋,加入水可形成冰水混合物,进而调控温度。箱体一侧有温度显示屏,内置扁圆形温度计,可实时显示温度变化,并可根据温度显示屏上的数字变化在箱体内加入冰袋或水,以维持低温的稳定。
1.2 鼠固定器
鼠固定器主要由固定底板、防护罩、第一挡板和第二挡板组成。固定底板上有2 个固定条,每个固定条上有前后2 个固定孔。固定条内部还有2 个可移动的卡固板,卡固板的一端是半圆形,2 个卡固板可将伸出固定孔的鼠的四肢固定,卡固板的移动由螺杆控制。第二挡板上设有透气网,可流通空气,防止鼠在长时间的固定下发生窒息。第一、二挡板和拱形防护罩的设计可减少鼠的挣扎,防止操作者被抓伤、咬伤。鼠固定器结构示意图如图2 所示。
2 鼠骨性关节炎低温造模装置使用方法
第1 步,在控温箱中加入已在-80 ℃预冻过的冰袋,冰袋大小可根据实验需要进行调节;将自来水注入控温箱,调节温度显示屏上的温度至5~6 ℃;当温度上升或下降时,可加入预冻过的装有水的小型离心管或自来水,调节至适宜温度。第2 步,将小鼠放入鼠固定器中,用缠了纱布的镊子将小鼠的右后肢从固定孔穿过,调节螺杆,固定至适宜位置,露出小鼠的踝关节。第3 步,将鼠固定器固定于卡位槽上,使小鼠的右后肢浸没在冰水中,记录此刻的时间。第4 步,1 h 40 min 后,取下鼠固定器,放出小鼠,对装置进行清洗、消毒,冷冻冰袋,待下次实验继续使用。实验持续30 d,第30 天时取材观察。
3 鼠骨性关节炎低温造模装置使用效果评价
3.1 方法
3.1.1 材料
选择20 只3 月龄BALB/c 雄性小鼠[由联勤保障部队第940 医院动物实验中心提供,SPF 级,实验动物使用许可证号:SYXK(军)2017-0047;实验动物生产许可证号:SCXK(军)2017-0023;实验动物批号:20210506],平均体质量29.4 g。适应性饲养1 周后,根据随机数字表法完全随机分成阴性对照组和低温处理组2 组,每组10 只。阴性对照组的小鼠正常饮食、饮水,低温处理组小鼠的右后肢使用鼠骨性关节炎低温造模装置每天在5~6 ℃条件下低温处理1 h 40 min,持续30 d。实验方案经联勤保障部队第940 医院动物实验伦理委员会批准(2020KYLL042)。
实验中使用的主要仪器和试剂:全波长多功能微孔板分析系统(TECAN,瑞士);小鼠肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(江苏酶标生物,中国);小鼠白介素-1β(IL-1β)ELISA 试剂盒(江苏酶标生物,中国);小鼠透明质酸(HA)ELISA 试剂盒(江苏酶标生物,中国);小鼠免疫球蛋白M(IgM)ELISA 试剂盒(江苏酶标生物,中国);EDTA 脱钙液(博士德,中国)。
3.1.2 操作者使用反馈记录
单人操作,记录完成整个实验、单只鼠固定和鼠的右后肢浸没在冰水中的时间;观察低温稳定的持续时间;记录操作者被小鼠抓伤或咬伤情况。
3.1.3 小鼠后肢形态观察
为阴性对照组和低温处理组小鼠的后肢拍照,观察低温处理组小鼠的右后肢相比阴性对照组小鼠的后肢是否出现了红肿或变形。
3.1.4 关节肿胀度测量
用游标卡尺测量阴性对照组和低温处理组小鼠的右后肢踝关节周长,比较2 组数据的均值,判断低温处理组小鼠的右后肢踝关节是否出现了明显肿胀。
3.1.5 血清学指标检测
用10%的水合氯醛麻醉小鼠,自眼眶采血,以3 000 r/min 离心15 min 后取血清,按照相应试剂盒说明书测量TNF-α、IL-1β、HA 和IgM 的吸光度(optical density,OD)值。比较低温处理组与阴性对照组小鼠血清中的TNF-α、IL-1β、HA 含量,可说明小鼠踝关节是否出现炎症以及关节组织的正常功能是否发生改变,比较IgM 含量可排除类风湿性关节炎。
3.1.6病理观察
采血后,用剪刀剪去踝关节上下3 mm 外的组织,保留完整踝关节;用生理盐水清洗踝关节上的血液;用4%多聚甲醛在4 ℃条件下固定关节组织24 h后,使用格氏平衡盐溶液洗去多聚甲醛;用EDTA 脱钙液常温脱钙,4 d 换一次脱钙液,换液3 次后,每天一换,16 d 后脱水包埋,用HE 染色,在倒置显微镜下观察并拍照。
3.1.7 统计学分析
采用GraphPad Prism 8.0.1 软件进行数据分析和统计图绘制,P<0.05 为差异有统计学意义。
3.2 结果
3.2.1 操作者使用反馈结果
单人操作,1 min 内可完成单只小鼠的固定和时间记录,30 min 内可完成10 只小鼠所有实验步骤,操作简单快速,省时省力;装置组装简单,温度调节快速稳定,5~6 ℃低温可稳定保持3 h;小鼠挣扎程度小,在持续30 d 的实验过程中,操作者未出现任何抓伤或咬伤。
3.2.2 小鼠后肢形态
阴性对照组小鼠右后肢正常,无任何红肿,如图3 所示;低温处理组小鼠右后肢踝关节肿胀明显,与阴性对照组小鼠的右后肢形成明显对比,如图4 所示。

图3 阴性对照组后肢

图4 低温处理组后肢
3.2.3 关节肿胀度测量结果
2 组小鼠右后肢踝关节周长比较如图5 所示。阴性对照组小鼠的右后肢踝关节周长平均为9.83 mm,低温处理组为16.05 mm,显著长于阴性对照组(P<0.001),差异有统计学意义。

图5 2 组小鼠右后肢踝关节周长比较
3.2.4 血清学指标检测结果
2 组小鼠血清中TNF-α、IL-1β、HA 和IgM 的含量比较如图6 所示。低温处理组血清中TNF-α、IL-1β 和HA 的含量均高于阴性对照组(P 均<0.05),2 组小鼠血清中IgM 的含量差异无统计学意义(P>0.05)。

图6 2 组小鼠血清中TNF-α、IL-1β、HA 和IgM 的含量比较
3.2.5 病理结果
阴性对照组小鼠踝关节软骨面光滑,软骨细胞和滑膜细胞排列有序,未见增生、变性和退化,如图7 所示;低温处理组小鼠踝关节的关节腔变大,软骨面破损退化,软骨细胞增生、变性,滑膜组织变性粘连,如图8 所示。

图7 阴性对照组小鼠踝关节病理切片(HE 染色)
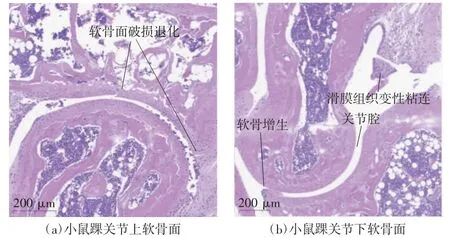
图8 低温处理组小鼠踝关节病理切片(HE 染色)
4 讨论
本文设计的鼠骨性关节炎低温造模装置结构简单、经济环保、单人可操作,操作过程快速简单,可在同一条件、同一时间段内大量建立小鼠骨性关节炎模型。操作者在整个实验过程中,未出现任何抓伤或咬伤。小鼠在固定时,情绪稳定、挣扎幅度小,整个操作过程对小鼠身体的伤害和精神上的刺激很小。且低温调节快速,低温稳定维持的时间长,可满足实验要求。低温刺激结束后,低温处理组小鼠只有穿过固定孔的右后肢出现了关节肿胀,而未穿过固定孔的左后肢无任何红肿,与阴性对照组小鼠的后肢无差别,表明本装置只会对处于低温环境的小鼠右后肢造成低温刺激,造模部位明确、精准。低温处理组小鼠完整踝关节脱钙后的病理染色结果符合骨性关节炎的病理特征。低温处理组小鼠血清学指标中TNF-α、IL-1β、HA 含量均升高,但2 组小鼠血清中IgM 含量差异无统计学意义。以上结果说明本装置使用简单、省时省力、成本低、安全可靠,能够成功建立小鼠骨性关节炎模型,使用效果好。
本研究只对本装置的小鼠固定及模型建立效果进行了评价,但本装置并不局限于小鼠,大鼠、小型兔子或其他小型动物都可以使用本装置进行固定及建立骨性关节炎模型;而且,本研究中鼠固定器的卡固板可通过螺杆进行调节,可将不同动物的四肢根据实验需要固定住不同的部位,因此该固定器也不局限于固定小鼠进行骨性关节炎模型的建立,它还可以固定其他动物,使动物的四肢穿过固定孔进行一些其他腿部操作,例如针灸、药物注射、局部手术、局部刺激、局部拍照测量[18]等,可减少动物的挣扎,降低操作者被抓伤或咬伤的概率,有效保护操作者。
综上所述,本装置为寻找骨性关节炎的治愈手段、探索病理进程机制的实验研究提供了一个动物模型建立方法的参考和依据。不过,本装置的温度调节依靠的是人工添加冰袋或冰管、自来水,过程较为烦琐,在以后的研究中,可考虑设计温度自动调节装置,实现温度的快速控制,从而节省人力、物力。
