PLCγ1基因对绵羊早期胚胎体外发育的影响
2022-08-26吴晓雪袁利明刘欣杰刘素平赛务加甫
吴晓雪,袁利明,刘欣杰,刘素平,陈 宁,赛务加甫
(石河子大学动物科技学院,石河子 832000)
哺乳动物卵母细胞从成熟发育到早期胚胎的过程十分复杂,研究人员发现,哺乳动物卵母细胞正常发育过程中存在减数分裂Ⅰ前期双线期停滞和减数分裂Ⅱ中期停滞,克服这些停滞使卵母细胞恢复减数分裂是至关重要的。哺乳动物卵母细胞减数分裂的恢复需要激活钙调蛋白Ⅱ从而提高卵母细胞内Ca浓度,卵母细胞内Ca的波动以及胚胎发育的过程中要受到多种基因的调控。刘红林等研究表明,显微注射Ca可激活小鼠MⅡ卵母细胞。研究人员发现,1被磷酸化后可以导致细胞内Ca通道开放。1被激活后,水解为磷脂酰肌醇4,5-二磷酸(phosphatidylinositol(4,5)bisphosphate, PIP2)生成第二信使三磷酸肌醇(inositol phosphate, IP3)及甘油二酯(diglyceride, DAG),继而引发细胞内Ca释放从而将细胞外信息传递给下游效应分子,参与动物中配子的形成、受精、细胞增殖、早期发育到细胞分化、分泌、收缩、光感觉等许多生物学反应的调节。研究表明,1可诱导小鼠卵母细胞减数分裂的恢复。Runft等研究发现,1参与海星卵受精时Ca的释放;在哺乳动物卵子中,1的活性是受精时Ca释放所必需的。
1是磷脂酶C(phospholipase C, PLC)的一个亚型,胞内Ca的触发机制与1的激活息息相关,1被激活后可生成IP3和DAG,生成的IP3可激活胞内Ca的释放机制,而Ca的升高是卵母细胞恢复减数分裂的关键,DAG可以直接激活蛋白激酶C,研究表明蛋白激酶C参与了卵母细胞受精过程、卵母细胞减数分裂的恢复和减数分裂Ⅰ和Ⅱ中纺锤体的调控。
本研究利用显微注射技术将pcDNA3.1-EGFP-1导入MⅡ期卵母细胞中为试验组,以显微注射空载体pcDNA3.1-EGFP作为对照组,经48 h 后统计其卵裂率,120 h后统计桑椹胚率;并利用Ca探针Rhod 2-AM监测MⅡ卵母细胞,显微注射后16、48、72、96、120 h时卵母细胞和早期胚胎体外发育过程各时期Ca波动。这些将为进一步探究1基因对绵羊早期胚胎发育机制的研究奠定基础,为提高绵羊早期胚胎体外发育能力等方面的研究提供科学依据。
1 材料与方法
1.1 重组质粒与卵巢
试验用重组质粒pcDNA3.1-EGFP-1 和pcDNA3.1-EGFP空载均为石河子大学动物科技学院实验室所保存;绵羊卵巢(=60)采自石河子市屠宰场。
1.2 主要试剂
HEPES、NaCl、KCl、NaHCO、丙酮酸钠、谷氨酰胺、石蜡油、必需氨基酸、非必需氨基酸、乳酸钠、细胞松弛素等试剂均购自美国Sigma公司;HMG购自石河子大学第一附属医院;生理盐水、抗生素均购自药店;TCM199粉末、FBS购自GIBCO公司;Rhod 2-AM 钙离子荧光探针购自新疆恒朝生物技术有限公司。
1.3 主要仪器
微量移液器(Eppendorf);超净工作台(Zhjh-1112);立式高压灭菌锅(Zeal-Gr60 da);二氧化碳培养箱(Thermo);显微镜加热板(Cryologic);倒置显微注射操作仪(Nikon);激光共聚焦显微镜(Nikon)等。
1.4 方法
1.4.1 重组质粒的验证 对实验室保存的重组质粒pcDNA3.1-EGFP-1的阳性克隆菌液进行PCR鉴定,根据Primer 5.0设计1(登录号:NC_040264.1)引物(表1),菌液PCR鉴定体系:Mix 7.5 μL,ddHO 4.5 μL,上、下游引物各1 μL, 菌液1 μL。将菌液接种于20 mL含抗性LB的液体培养基中活化,37 ℃、180 r·min过夜培养。利用DNA质粒小量提取试剂盒按照说明书提取质粒,将重组质粒pcDNA3.1-EGFP-1双酶切验证,双酶切反应体系20 μL:模板DNA 10.0 μL,ddHO 6.0 μL,1×H Buffer 2.0 μL,d Ⅲ 1.0 μL,I 1.0 μL,并将阳性菌液送至睿博兴科公司测序,将鉴定结果正确的阳性菌液接种于含抗性的LB液体培养基,37 ℃、180 r·min过夜培养并按照无内毒素质粒大提试剂盒说明书提取质粒。
1.4.2 绵羊卵母细胞的体外成熟培养 用加入抗生素的生理盐水(37 ℃预热)冲洗绵羊卵巢 2~3次, 剔除结缔组织后继续用含抗生素的生理盐水洗涤2次,将卵巢放入已预热平衡2 h的割卵液中并用镊子固定卵巢,用11 cm手术刀将卵巢表面卵泡切开,然后用捡卵针收集割卵液中胞质均匀、包裹卵丘细胞3层及以上的卵丘-卵母细胞复合体(COCs),取出预热平衡2 h的成熟液,将挑选好的COCs放入成熟液中清洗3次,然后将其放入成熟液微滴(每个微滴100 μL)中,在温度为38.5 ℃,5% CO的培养箱中体外成熟培养24 h。

表1 引物序列
1.4.3 绵羊成熟卵母细胞的选择 在倒置显微镜下观察卵母细胞成熟的情况,未成熟卵母细胞周围的颗粒细胞没有向外扩散,并且分布不均匀未分层,成熟卵母细胞周围的颗粒细胞呈放射状向外扩散且有分层现象,颗粒细胞吹打干净后可明显看到排出第一极体(图1)。
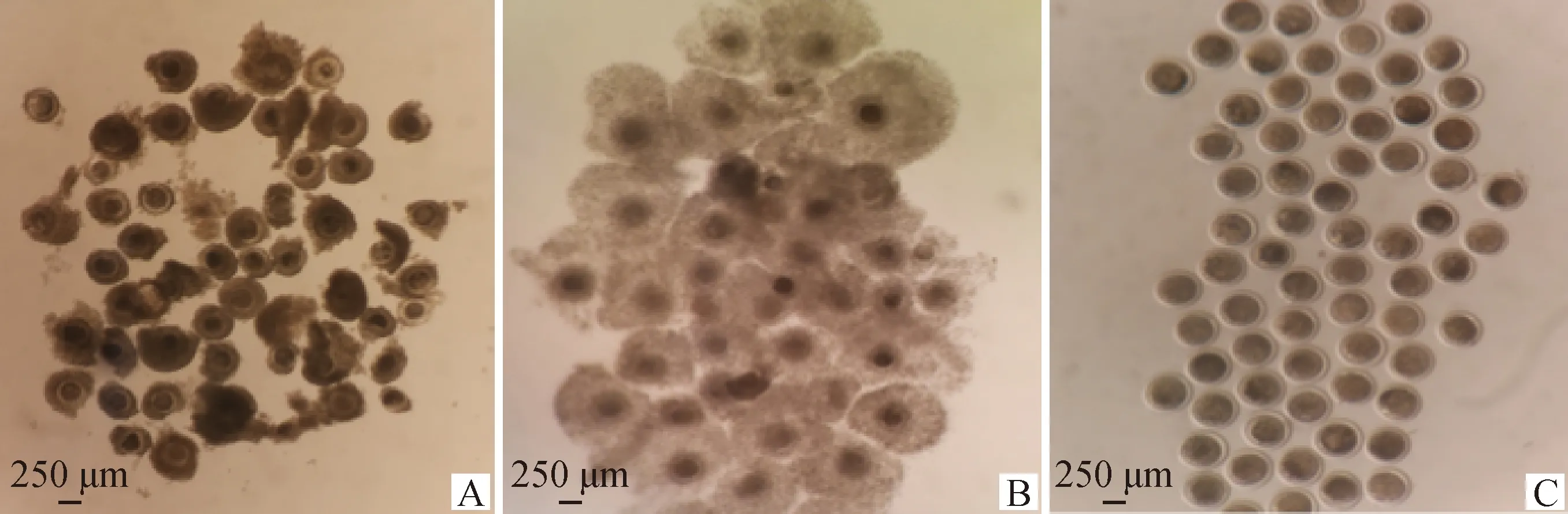
A.未成熟COCs;B.成熟COCs;C.成熟卵母细胞A. Immature COCs; B. Mature COCs; C.Mature oocyte图1 卵母细胞成熟情况(40×)Fig.1 Oocytes maturation(40×)
1.4.4 重组质粒卵母细胞内显微注射 COCs培养24 h后,将卵母细胞在透明质酸酶中作用5 min,并用移液枪反复吹打卵母细胞周围的颗粒细胞直至将颗粒细胞吹打干净,随后用成熟液洗涤3次, 挑选排出第一极体的细胞。将含有第一极体的细胞随机分为两组,分别移入操作液的微滴中。
将制备好的固定针、注射针安装在显微操作仪上,然后用固定针吸附固定卵母细胞,用注射针吸取重组质粒pcDNA3.1-EGFP-1后,注入卵母细胞胞质内,最后退出注射针,1 h内完成所有卵母细胞的显微注射操作。对照组卵母细胞显微注射pcDNA3.1-EGFP空载体,方法同上。将两组细胞分别放入SoFaa液中,在培养条件为5% CO、温度38.5 ℃和饱和湿度100%的培养箱中培养。48 h后开始统计卵裂率。
1.4.5 卵母细胞和早期胚胎Ca的测定 分别挑选MⅡ卵母细胞,显微注射16、48、72、96、120 h的卵母细胞放入PBS缓冲液中清洗3次,以除去培养基。将其放入Rhod 2-AM染色液中,在38.5 ℃,5% CO培养箱中孵育1 h,随后将其放入胚胎发育液中清洗3次,以除去染色液;最终将各时期细胞分别放入含有胚胎发育液的玻璃培养皿中,利用激光共聚焦显微镜观察Ca的分布情况和荧光强度,对比卵母细胞和早期胚胎各时期的荧光强度并进行分析。
1.5 统计学分析
所有试验均重复至少3次,采用SPSS21.0统计软件进行独立样本检验分析和单因素方差分析,<0.05表示差异显著,<0.01表示差异极显著。
2 结 果
2.1 重组质粒的鉴定
对菌液进行PCR鉴定,后将PCR产物经1%琼脂糖凝胶电泳检测得到大小330 bp的目的条带(图2),与预期相符。将pcDNA3.1-EGFP-1用d Ⅲ和I进行双酶切,酶切产物经1%琼脂糖凝胶电泳检测出现两条清晰可见的条带:一条为5 428 bp的载体线性片段,另一条为3 960 bp的目的片段(图3),其大小与预期相符。将菌液送至睿博兴科公司测序,测序结果正确可用于后续显微注射试验。
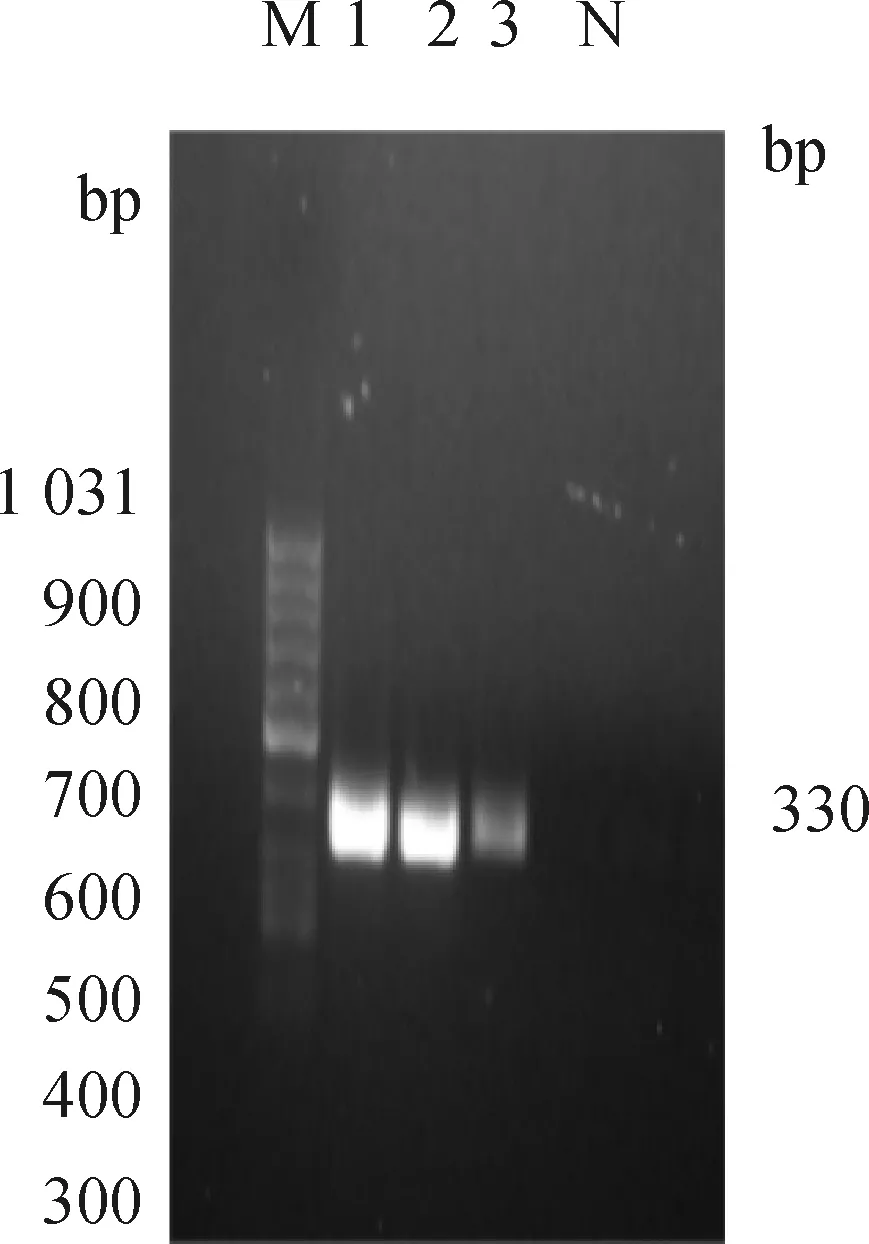
M. DNA相对分子质量标准;1~3. PCR产物;N. 阴性对照M. DNA marker (50-1 031 bp);1-3. The PCR products;N. Negative control图2 菌液PCR鉴定Fig.2 PCR identification of bacterial solution
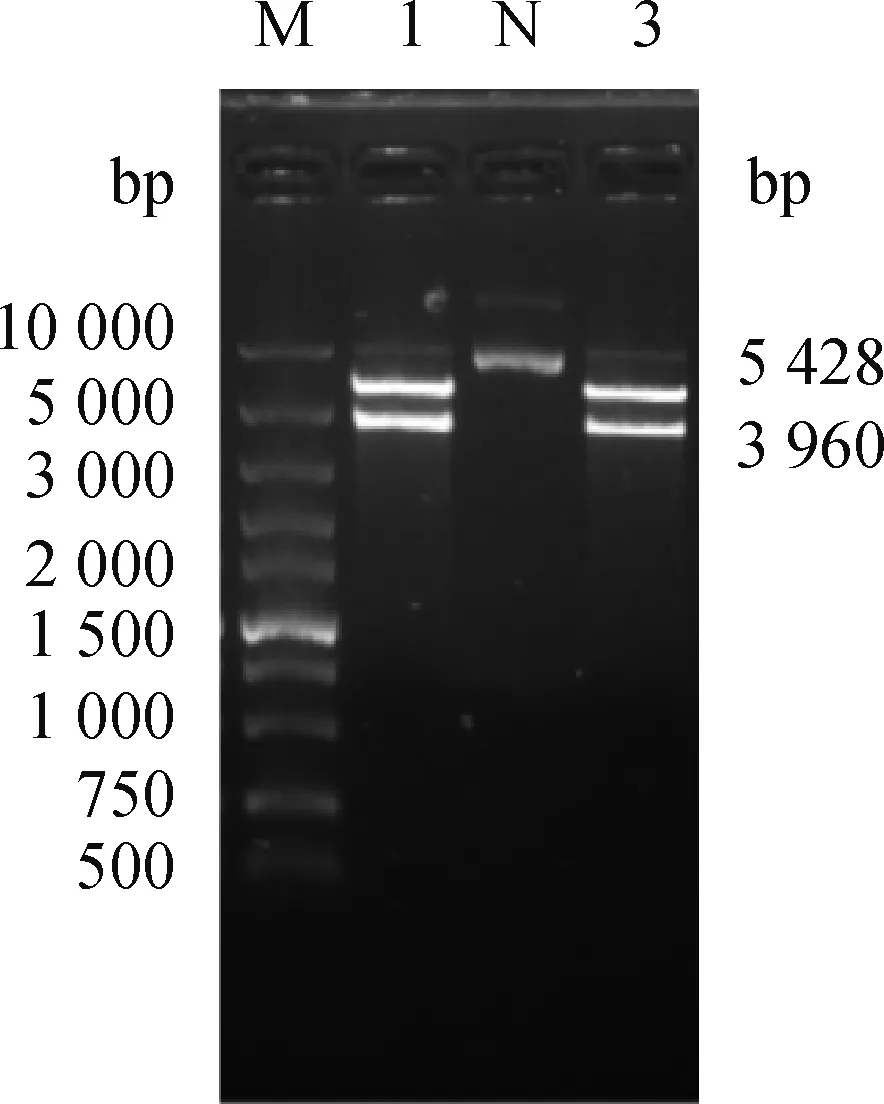
M. DNA相对分子质量标准;1、3. 双酶切产物;N. 阴性对照M.Super marker; 1,3. Double digestion products;N. Negative control图3 重组质粒双酶切鉴定Fig.3 Identification of recombinant plasmid by double digestion
2.2 卵母细胞显微注射后的卵裂率及早期胚胎发育情况
结果显示,两组卵母细胞内均可观察到绿色荧光,载体成功在胞内表达。注射pcDNA3.1-EGFP空载体的对照组卵母细胞没有卵裂现象(图4),而注射pcDNA3.1-EGFP-1重组质粒的试验组卵母细胞发生卵裂(图5)。

A. 显微注射pcDNA3.1-EGFP(明场);B. 显微注射pcDNA3.1-EGFP(暗场)A. Microinjecting pcDNA3.1-EGFP (open field);B. Microinjecting pcDNA3.1-EGFP (dark field)图4 显微注射pcDNA3.1-EGFP卵母细胞发育情况 (100×)Fig.4 Development of microinjected pcDNA3.1-EGFP oocytes (100×)
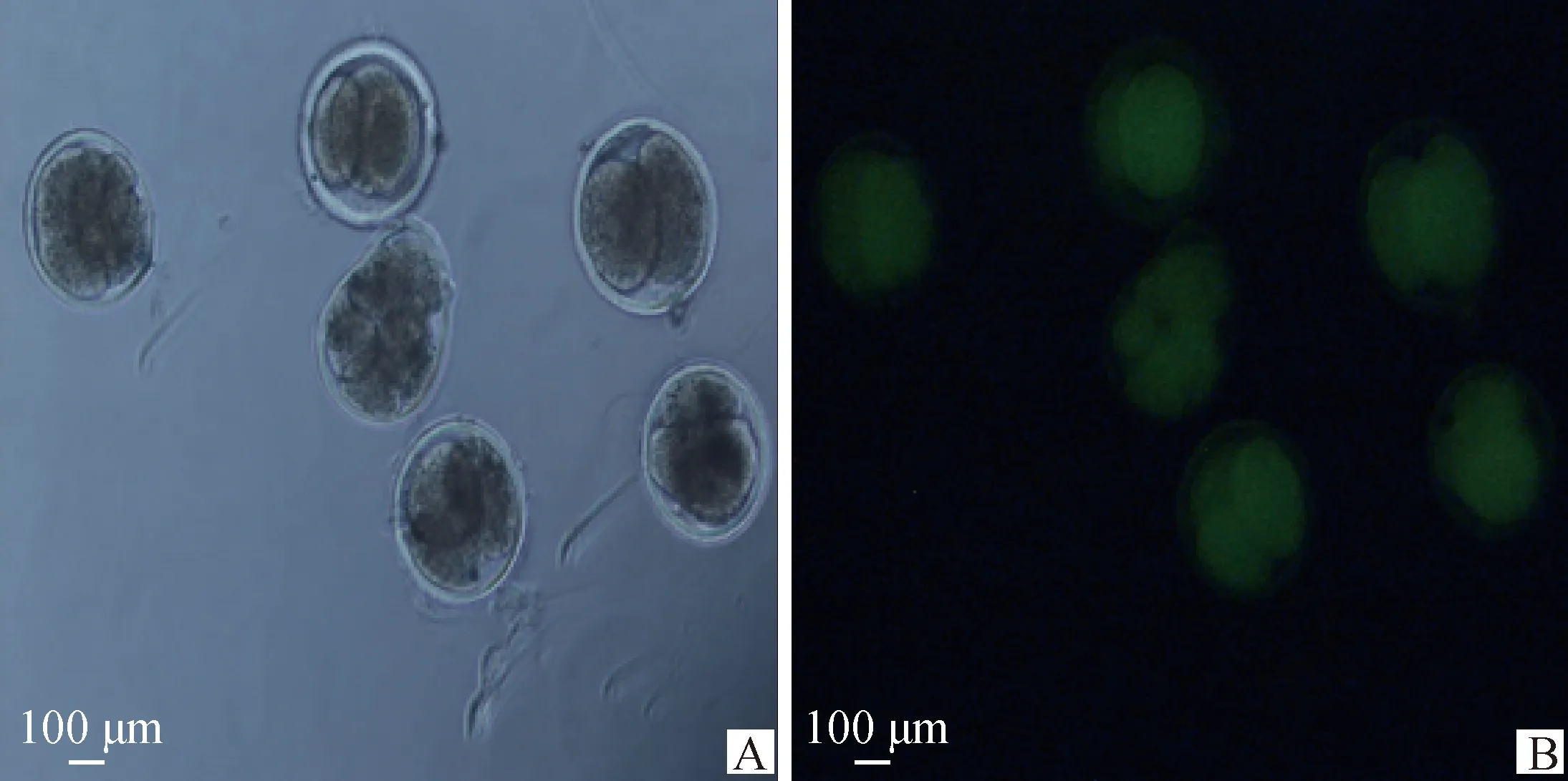
A. 显微注射pcDNA3.1-EGFP-PLCγ1(明场);B. 显微注射pcDNA3.1-EGFP-PLCγ1(暗场)A. Microinjecting pcDNA3.1-EGFP-PLCγ1 (open field);B. Microinjecting pcDNA3.1-EGFP-PLCγ1 (dark field)图5 显微注射pcDNA3.1-EGFP-PLCγ1卵母细胞卵裂情况(100×)Fig.5 Cleavage of microinjected pcDNA3.1-EGFP-PLCγ1 oocytes (100×)
2.3 卵母细胞和早期胚胎Ca2+的荧光强度
利用激光共聚焦显微镜观察卵母细胞以及早期胚胎发育不同时期Ca的波动情况(图6),结果显示,1基因可以引起早期胚胎发育过程中Ca振荡,Ca都主要分布在胞质中,MⅡ卵母细胞Ca荧光强度最低,显微注射48 h Ca荧光强度最高与MⅡ卵母细胞Ca荧光强度相比,差异极显著(<0.01), 随着胚胎的发育荧光强度开始减弱随后趋于平稳(图7)。
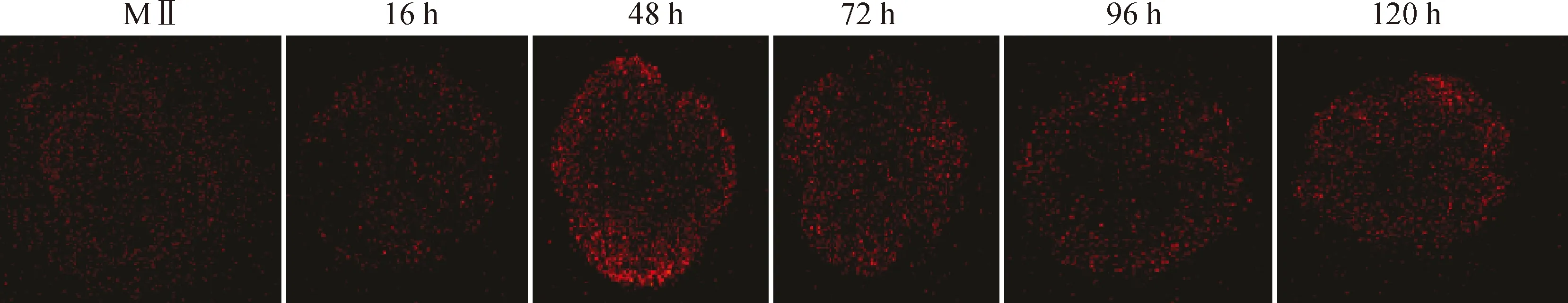
图6 激光共聚焦显微镜观察各时期Ca2+浓度变化(200×)Fig.6 Laser confocal microscopy observation of Ca2+ concentration in each period (200×)
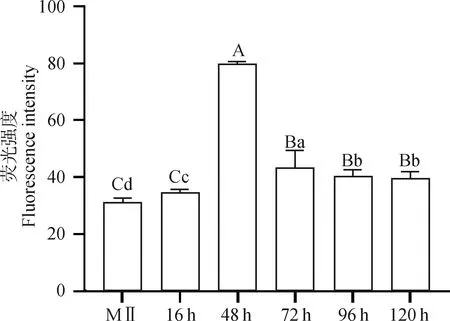
不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)Different capital letters mean very significant difference (P<0.01), different lowercase letters mean significant difference (P<0.05)图7 显微注射PLCγ1后各时期Ca2+荧光强度变化Fig.7 Changes of Ca2+ fluorescence intensity in each period injected PLCγ1
显微注射48 h,在倒置荧光显微镜下观察卵母细胞卵裂情况并进行统计分析(表2)。结果显示,注射pcDNA3.1-EGFP空载体的对照组的卵裂率为0;而注射pcDNA3.1-EGFP-1重组质粒的试验组的卵裂率为(19.67±0.2)%,差异极显著(<0.01),桑椹胚率为(9.00±0.17)%,差异显著(<0.05)。
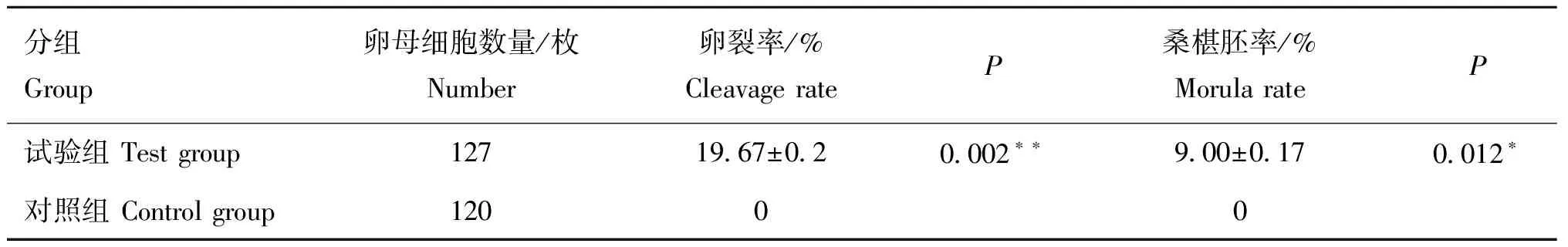
表2 卵母细胞卵裂率和桑椹胚率统计分析
3 讨 论
孤雌激活是可以实现无需精子介入的卵母细胞激活分裂和发育,是无性生殖技术的一种,其对研究胚胎发育的机制具有非常重大的意义。为获得较高的孤雌激活卵裂率和发育率,研究人员不断深入探索卵母细胞孤雌激活的方法,目前较为优良的孤雌激活方式主要是6D联合离子霉素激活。卵母细胞激活在胚胎发育过程中起到关键作用,研究发现Ca在小鼠卵母细胞激活过程中发挥重要作用,Ca的瞬时升高可以导致小鼠卵母细胞恢复减数分裂从而使其继续发育到早期胚胎。Yeste等阐明,Ca振荡在卵母细胞激活过程中发挥重要作用,维持其在卵母细胞内稳态的机制至关重要,IP3与三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptors, IP3R)结合后导致钙离子通道打开,从而使Ca从内质网释放,体细胞中IP3R的活性受到其他激酶蛋白激酶A(protein kinase A, PKA)和磷酸蛋白PP1、PP2A及钙调素的调控,IP3R在哺乳动物卵母细胞中的调控机制仍有待确定。哺乳动物精卵结合后钙离子浓度升高主要是由于精子通过与G蛋白偶联的受体作用从而激活磷脂酶C,PLC可水解PIP,产生IP3和DAG;IP3一旦产生可使内质网上储存的Ca释放进入胞质,释放出来的Ca又可以反过来激活PLC而增加IP3的产量从而形成钙波;DAG刺激蛋白激酶C的活性从而使PKC的底物蛋白磷酸化,导致卵母细胞激活,恢复减数分裂。1基因作为磷脂酶C的一个亚型,其含有SH2和SH3两个主要结构域,这两个结构域可使1基因参与小鼠卵母细胞的激活。
本研究通过显微注射技术将1基因导入绵羊MⅡ期卵母细胞,结果表明1基因可以使卵母细胞发生Ca振荡,使Ca浓度瞬时升高,激活绵羊卵母细胞并使其继续发育到桑椹胚,卵裂率为(19.67±0.2)%,桑椹胚率为(9.00±0.17)%,与对照组显微注射空载体pcDNA3.1-EGFP相比差异显著。哺乳动物卵母细胞在发育过程中会经历两次停滞期,在卵泡中的卵母细胞在第一次减数分裂的前期受阻,排出卵泡的卵母细胞会恢复第一次减数分裂,在大多数情况下恢复第一次减数分裂的卵母细胞会在第二次减数分裂再次停滞。然而,卵母细胞无论是通过受精还是孤雌激活都会引起胞内Ca振荡,诱导卵母细胞减数分裂的恢复从而使其发育成胚胎。研究表明,当激活胞内PLC1信号后,胞内Ca浓度会升高。Sette等发现,1基因参与小鼠卵母细胞恢复减数分裂的过程,1被激活后触发小鼠卵母细胞Ca释放机制从而使卵母细胞恢复减数分裂。研究表明,1可催化PIP2生成DAG和IP3,IP3可使细胞内Ca释放,若细胞内1基因缺失,细胞内Ca浓度较低且峰值出现较晚。本研究表明,显微注射1基因48 h后引起胞内Ca浓度升高,这可能与1可水解PIP2生成IP3有关。研究发现,1基因可以通过调控PTK-1信号通路激活毛翼虫卵子;1抑制剂U73122可以阻止孤雌生殖卵子的激活。因此,在MⅡ期导入1基因后可导致绵羊卵母细胞发生Ca振荡从而使绵羊卵母细胞发生卵裂。但1基因调控绵羊卵母细胞发育以及胞内Ca振荡的机制还需进一步研究。
4 结 论
综上所述,本研究发现1基因可以通过提高绵羊卵母细胞内Ca浓度诱导卵母细胞恢复减数分裂,使其发生卵裂并可继续发育到桑椹胚。
