煤化学链燃烧脱汞研究进展
2022-08-25周劲松周启昕周灵涛李博昊
刘 壮,周劲松,周启昕,周灵涛,陆 洋,李博昊
(浙江大学 能源清洁利用国家重点实验室,浙江 杭州 310027)
0 引 言
iG-CLC本质上是先气化后氧化的过程[8]。Hg作为煤中典型的重金属痕量元素,因其具有剧毒性、挥发性、迁移性和生物累积性而受到广泛关注[9-10]。iG-CLC过程Hg释放、转化及迁移路径[8]为:煤中Hg受热并主要以气相单质汞(Hg0)的形式释放。尽管在烟气冷却过程中,一部分Hg0被烟气中的氧化性成分氧化并以气相Hg2+形式存在,还有一部分Hg0吸附在飞灰或载氧体表面上并以颗粒态Hg(Hgp)的形式存在,但Hg0仍是烟气中最主要的Hg形态[11]。因此,烟气中Hg主要有Hg0、Hg2+和Hgp三种形态[12],其中Hg2+易溶于水,可通过湿法烟气脱硫装置去除[13]。Hgp也易被静电除尘器或袋式除尘器收集[14]。然而Hg0由于易挥发且难溶于水,难以被现有污染物控制设备有效去除[15]。因此,有效治理烟气中Hg0是解决Hg污染问题的关键。由于Hg0难溶于水,因此冷凝装置仅能分离出H2O(g),而Hg0继续与CO2混合,不仅会影响CO2纯度,不利于CO2富集封存,还会与铝发生汞齐反应造成铝制CO2压缩设备的腐蚀[16]。此外,由于载氧体的吸附作用,一部分吸附在载氧体表面的Hg会随载氧体进入空气反应器,并在载氧体再生过程中从空气反应器出口逸出,导致Hg重金属污染[17]。如果不能对iG-CLC过程中产生的Hg进行有效处理,不仅危害人体健康和生态环境,还会严重限制iG-CLC技术的发展。因此,有效解决iG-CLC过程中的Hg污染问题十分必要。
目前关于iG-CLC技术Hg污染的相关研究较有限。尽管传统煤燃烧过程中Hg释放、迁移和转化研究较多[18-19],但由于CLC与传统煤燃烧之间存在显著差异,直接引用传统煤燃烧过程中Hg释放、迁移和转化相关结论是不科学的。为继续推进CLC脱Hg技术的发展,笔者总结了气化介质、气化产物、载氧体和反应温度对CLC过程中Hg释放、迁移和转化的影响及作用机理,并在此基础上提出相关建议。
1 iG-CLC反应原理及优势

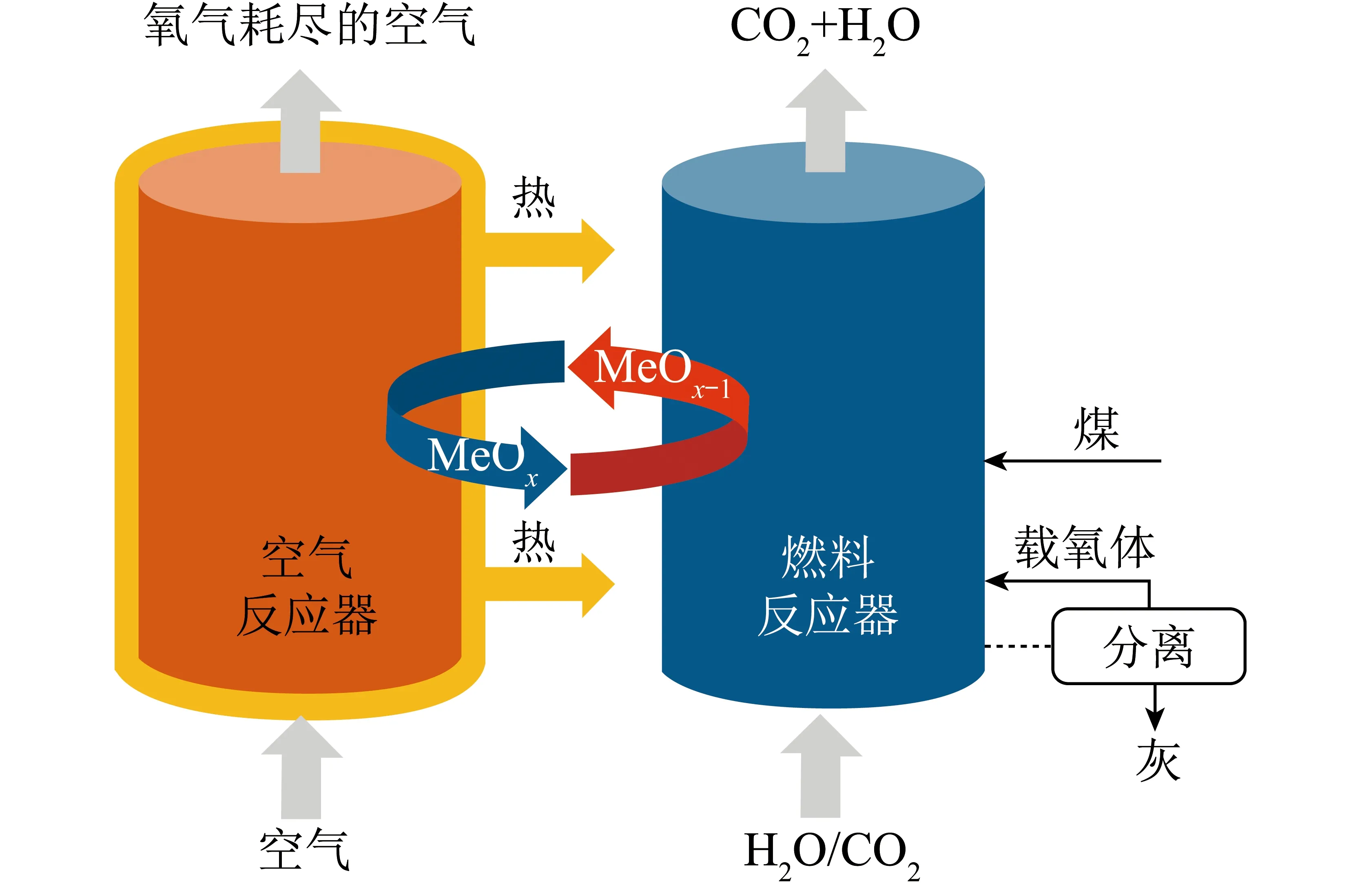
图1 iG-CLC系统[20]Fig.1 System of iG-CLC[20]

(1)

(2)

(3)

(4)
常规煤燃烧反应温度较高,一般在1 400 ℃以上,气体产物主要为CO2、H2O、O2、SO2、NO和HCl[18]。与常规煤燃烧反应相比,化学链燃烧反应温度较低,一般在1 000 ℃以下[29],气体产物主要为CO、H2、CH4、H2S、NH3和HCl[30]。常规煤燃烧烟气和化学链燃烧反应气体产物中Hg主要以气相Hg0形式存在,但化学链燃烧反应气体产物气氛主要为还原性气氛,不利于Hg0氧化,因而化学链燃烧反应气体产物中Hg0比例高于常规煤燃烧烟气。目前常规煤燃烧烟气和化学链燃烧反应气体产物中Hg脱除均以吸附剂喷射技术为主,其中以活性炭吸附剂最常用[31-32]。然而活性炭吸附剂存在反应窗口窄、再生困难、成本高昂等缺点,因而亟需经济高效的脱汞方法。
2 气化介质的影响及机理
由于煤和载氧体之间的固-固反应速率较慢,一般使用CO2和H2O(g)作为气化介质,将煤气化生成CO、H2和CH4等气体产物,通过速率较快的气-固反应提升iG-CLC的整体效率。研究发现CO2和H2O(g)除作用于煤气化外,对Hg的释放及迁移氧化也有影响。JI等[33]使用澳大利亚铁矿石作为载氧体,分别在800、850、900、950 ℃下研究了气化介质对燃料反应器中Hg释放的影响。气化介质比例对Hg释放及分布影响如图2所示。由图2(a)可知,在800、850、900、950 ℃下,随H2O/CO2体积比从0∶1增至0.5∶1.0再到1∶1,Hg总释放量逐渐增加,表明H2O/CO2体积比越高,即H2O体积分数越高,越有利于燃料反应器中Hg的释放。H2O(g)对燃料反应器中Hg释放的促进作用可能归因于其增强了煤挥发分的释放,并抑制了焦炭表面孔之间的熔融,进而改善了因孔熔融导致的Hg释放通道减少问题[34]。由图2(b)可知,在800、850、900、950 ℃ 下,随H2O/CO2体积比从0∶1增至0.5∶1.0再到1∶1,Hg0占总Hg比例逐渐增加,表明Hg2+占总Hg比例逐渐减小,H2O/CO2体积比越高,即H2O体积分数越高,越不利于燃料反应器中Hg0的氧化。H2O对Hg0氧化的抑制作用可能归因于H2O含量升高不利于HCl向Cl转化,并抑制了HgCl2生成。此外,加入H2O(g)后,Hg0的释放及氧化同样发生变化:加入H2O分子可与Hg0反应生成Hg(OH)2,Hg(OH)2易受热分解成为HgO,HgO可进一步在高温下分解为Hg0。以上因素导致H2O/CO2体积比升高对Hg0氧化的抑制作用。
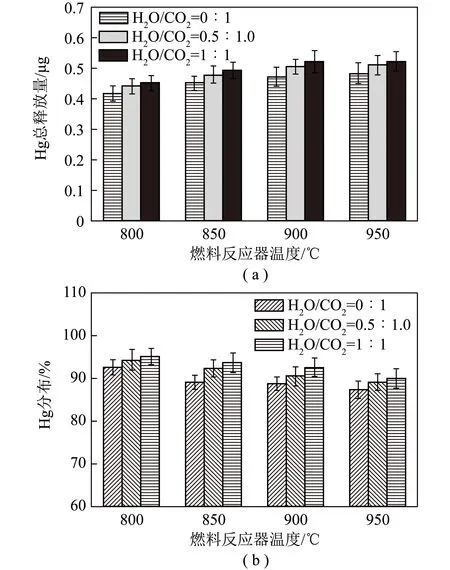
图2 气化介质比例对Hg释放及分布影响[33]Fig.2 Effect of gasification medium on Hg release and distribution[33]
刘壮等[35]借助固定床反应系统、表征分析和热力学平衡计算研究了CO2气化介质对高铁高钙煤灰载氧体炉内脱汞的影响效果及作用机理。结果表明,CO2对Hg0的均相氧化几乎不起作用,但提高了煤灰载氧体的脱汞效果,原因为CO2与煤灰中CaSO4之间的反应抑制了CO对HgO的还原,并通过促进O的生成强化了Hg0向HgO的氧化。HCl显著促进了煤灰载氧体的脱汞效果,但CO2却限制了HCl的促进作用,这归因于CO2与煤灰载氧体中Fe2O3和CaSO4等活性物质之间的反应。Hg0+Fe2O3+HCl反应体系中Hg0向HgCl2的氧化有3条路径:① Hg0被直接氧化为HgCl2;② Hg0先被氧化为HgCl,HgCl再被氧化为HgCl2;③ Hg0先被氧化为HgO,HgO再转化为HgCl2。除①~③外,Hg0+CaSO4+HCl反应体系中Hg0向HgCl2的氧化还包括路径④,即Hg0先被氧化为HgS,HgS进一步转化为HgCl2。热力学计算结果显示:CO2对Hg0+Fe2O3+HCl反应体系中路径①~③和Hg0+CaSO4+HCl反应体系中路径①~④均产生抑制作用。
3 气化产物的影响及机理
煤中主要元素有C、H、O、N和S,使煤气化产物包括CO、H2、CH4、H2S、NH3和HCl,其中CO、H2、H2S、NH3和HCl均显著影响Hg0的氧化迁移。研究发现CO、H2和NH3均会显著抑制金属氧化物的脱汞效果[36-38]。金属氧化物对Hg0的脱除作用归因于其表面活性氧对Hg0的吸附氧化作用,CO、H2和NH3的抑制作用则归因于其强还原性,能与金属氧化物表面氧发生反应(式(5)~(7)),消耗金属氧化物表面活性氧,从而抑制表面活性氧对Hg0的氧化。

(5)

(6)

(7)
不同于CO、H2和NH3,WANG等[36-37]发现在40~200 ℃,加入H2S和HCl显著增强了金属氧化物对Hg0的脱除效果。H2S的促进作用归因于H2S与金属氧化物中表面氧(O*)反应(式(8)),生成对Hg0氧化更活跃的表面活性硫[39](式(9)),从而增强了金属氧化物对Hg0的脱除效果。但H2S的促进作用也受H2S浓度影响,H2S浓度过高时,过多H2S会在金属氧化物表面生成对Hg0氧化并不活跃的环状硫或链状硫[40],此时H2S浓度增加反而会减弱H2S的促进作用,甚至抑制金属氧化物的脱汞效果。WANG等[36]发现加入HCl同样显著促进了金属氧化物对Hg0的吸附氧化。HCl的促进作用同样受HCl自身浓度的影响,HCl浓度过高时,过多HCl会占据金属氧化物表面的活性位点,此时HCl浓度升高反而会减弱HCl的促进作用,甚至抑制金属氧化物的脱汞效果。LIU等[41]在80~680 ℃研究了HCl对Fe2O3在Hg0氧化上的影响及作用机理。结果表明,在80~680 ℃,加入HCl均促进了Fe2O3对Hg0的氧化,但不同温度区间内HCl的促进作用不同,这主要归因于温度对HCl在Fe2O3表面吸附的影响。在80~280 ℃低温区间内,经HCl预吸附处理后的Fe2O3脱汞效率较未处理的Fe2O3脱汞效率显著提高,表明HCl可吸附在Fe2O3表面形成吸附态HCl,此时HCl的促进作用归因于HCl预吸附的Eley-Rideal机理,即吸附态HCl与气相Hg0之间反应生成HgCl2(式(10)~(12))。在280~580 ℃中温区间内,HCl预吸附处理后Fe2O3的脱汞效率略高于未处理Fe2O3的脱汞效率,表明此时较高的温度抑制了HCl在Fe2O3上的吸附,在一定程度上减弱了HCl的促进作用。此时HCl较弱的促进作用归因于Langmuir-Hinshelwood机理,即较少的吸附态HCl和吸附态Hg0之间反应生成HgCl2(式(13)~(15))。在580~680 ℃高温区间内,过高的温度严重抑制了HCl在Fe2O3上的吸附,此时HCl的促进作用归因于HCl对Hg0的均相氧化(式(16)~(17))。

(8)

(9)
(10)

(11)

(12)
(13)
(14)
(15)

(16)

(17)
4 载氧体的影响及机理
由于空气反应器和燃料反应器二者之间氧和热量的传递通过载氧体完成[42],因而选择合适的载氧体对于CLC至关重要[43]。除传递燃料燃烧所需氧外,一些研究者发现载氧体也对Hg0的氧化及转化产生影响。MA等[17]使用铁矿石为载氧体,研究了iG-CLC过程中Hg在挥发分和焦炭中的迁移转化规律,结果表明,尽管铁矿石载氧体对Hg的释放速率和释放量的影响较小,但铁矿石可促进Hg0向Hg2+的氧化。铁矿石对Hg0氧化的促进作用可能归因于以下2方面:① 铁矿石载氧体表面充足的活性氧可直接将Hg0氧化成HgO;② 铁矿石载氧体表面活性氧可将CO等气化产物氧化成CO2等,从而减弱了CO等还原性气体对Hg0氧化的抑制作用。此外,MA等[17]还发现在循环过程中产生的Fe3O4和铁矿石载氧体的孔隙结构均有利于Hg0的吸附以及Hg0向Hgp的转化。AN等[44]使用CuFe2O4载氧体研究了iG-CLC过程中Hg的迁移转化规律,结果表明,iG-CLC过程中Hg的分布规律与煤常规气化过程相似。CuFe2O4载氧体促进了Hg0向Hg2+的氧化以及Hg0向Hgp的转化。CuFe2O4载氧体对Hg0氧化的促进作用归因于CuFe2O4载氧体可以将NH3和HCl等气化产物氧化生成NO和Cl2等对Hg0氧化有利的产物,CuFe2O4载氧体对Hg0向Hgp转化的促进作用则可能源于CuFe2O4载氧体对Hg的吸附作用。
从图3可见,含钛高炉渣的杂质CaO、MgO、Fe、Al2O3脱除率随着盐酸浓度的提高不断升高,但盐酸浓度超过18%提高不明显;TiO2损失率随着盐酸浓度的提高也逐渐增大,在盐酸浓度为19%时,TiO2损失率达到了5%以上。盐酸浓度低,杂质溶解不完全,酸度高后期废酸处理成本高,因此合适的盐酸酸度为18%。
载氧体对Hg0氧化的作用方面,NI等[45]结合热力学计算和固定床试验对CaSO4、Fe2O3、CuO、Co3O4、Mn2O3、CeO2、Al2O3和SiO2等8种常见载氧体在HCl气氛下Hg氧化效率进行排序,结果显示8种载氧体Hg氧化效率从大到小依次为CaSO4>Co3O4(Mn2O3)>Fe2O3>CuO(CeO2)>SiO2(Al2O3)。NI等[45]发现加入载氧体可以促进HCl向Cl/Cl2转化,且Cl/Cl2产物数量可作为评估不同载氧体Hg氧化效率的标准。Hg0+HCl+载氧体反应体系Hg0氧化机理如图3所示。根据热力学计算结果,NI等[45]提出在Hg0+HCl+MxOy反应体系中,Hg0向HgCl2的氧化主要有以下3条路径:① Hg0直接被Cl2氧化为HgCl2;② Hg0先被Cl氧化为HgCl,HgCl进一步被Cl/Cl2氧化为HgCl2;③ Hg0先被O氧化为HgO,HgO进一步与Cl2O反应生成HgCl2。在Hg0+HCl+CaSO4反应体系中,除路径①~③外,还存在路径④,即Hg0先与S反应生成HgS,HgS进一步与Cl反应生成HgCl2。这为解释载氧体在HCl气氛下对Hg0的氧化作用机理提供参考。

图3 Hg0+HCl+载氧体反应体系Hg0氧化机理[45]Fig.3 Mechanism of Hg0 oxidation in Hg0+HCl+OC reaction system[45]
综上可知,载氧体对Hg0氧化的促进作用归因于其释放的活性氧,这表明载氧体的促进作用与其释氧能力密切相关,即载氧体应尽可能具备较强的释氧能力。此外,载氧体对Hg的吸附作用会使Hg随载氧体进入空气反应器,进而从空气反应器出口逸出,因此载氧体应尽可能具备较弱的吸附能力。为促进iG-CLC过程中Hg的脱除,应选择具备强释氧性和弱吸附性的载氧体。载氧体的释氧性、吸附性与载氧体的活性成分及结构密切相关。WANG等[36-37]发现以Cu、Mn、Co为活性成分的尖晶石结构具有较强的释氧能力,在以CO和H2为主的煤气还原性气氛下仍具有良好的Hg催化氧化能力。此外,Cu、Mn、Co等活性成分对Hg0的吸附属于作用较弱的物理吸附,使得以Cu、Mn、Co为活性成分的尖晶石结构载氧体成为煤化学链燃烧脱汞的良好选择。然而,目前Cu、Mn、Co尖晶石结构氧化物主要应用于低温环境下煤气中Hg的催化氧化[36-37],而Cu、Mn、Co尖晶石结构氧化物在iG-CLC高温炉内对Hg0催化氧化的相关研究仍有限。
5 反应温度的影响及机理
除气化介质、气化产物和载氧体外,反应温度也会显著影响Hg释放速率、释放量和释放形态产生。张志越等[46]发现随燃料反应器温度升高,燃料反应器中Hg释放量和Hg释放速率均增加。燃料反应器释放的Hg以Hg0为主,且Hg0占比随燃料反应器温度升高而减小,表明燃料反应器温度越高,越有利于燃料反应器中Hg0的氧化。这一现象归因于燃料反应器温度越高,越有利于反应体系中含Cl物质的分解,导致Cl/Cl2等活性成分增加,同时温度越高越有利于Cl/Cl2等活性成分对Hg0的均相氧化。燃料反应器和空气反应器温度对汞总释放量和汞分布的影响[33]如图4所示。由图4(a)可知,随燃料反应器温度从800 ℃升至950 ℃,燃料反应器中总Hg释放量从0.418 μg逐渐增至0.483 μg[33],表明温度越高越有利于燃料反应器中Hg的释放,这与LIU等[47]结论相似。这一现象归因于温度越高,越有利于Hg的挥发[48]。然而随温度继续升高,燃料反应器中总Hg释放量增加微弱,可能归因于温度越高越有利于煤的固化,导致煤比表面积减小,Hg释放通道减少[49]。由图4(b)可知,随燃料反应器温度从800 ℃升至950 ℃,Hg2+占总Hg比例逐渐增加,表明温度越高越有利于燃料反应器内Hg0的氧化,可能归因于温度升高导致有利于Hg0氧化的Cl数量增加[50-52]以及不利于Hg0氧化的CO数量减少[53]。然而与燃料反应器不同,随空气反应器温度从800 ℃升至950 ℃,空气反应器的总Hg释放量从0.051 μg逐渐降至0.043 μg(图4(c)),表明温度越高越不利于空气反应器中Hg的释放。这一现象可能归因于以下2方面:① 温度越高越有利于燃料在空气反应器中充分燃烧,并导致未燃尽碳和煤中焦炭含量减少。考虑到未燃尽碳和焦炭对Hg的吸附作用,未燃尽碳和煤中焦炭含量的减少会使通过未燃尽碳和煤中焦炭携带进入空气反应器中的吸附态Hg数量减少。② 燃料反应器温度越高,越不利于未燃尽碳和煤中焦炭对Hg的吸附作用,在一定程度上使通过未燃尽碳和煤中焦炭携带进入空气反应器的吸附态Hg数量减少。由图4(d)可知,随空气反应器温度从800 ℃升至950 ℃,Hg2+占总Hg比例逐渐增加,表明温度越高越有利于空气反应器中Hg0向Hg2+的氧化。
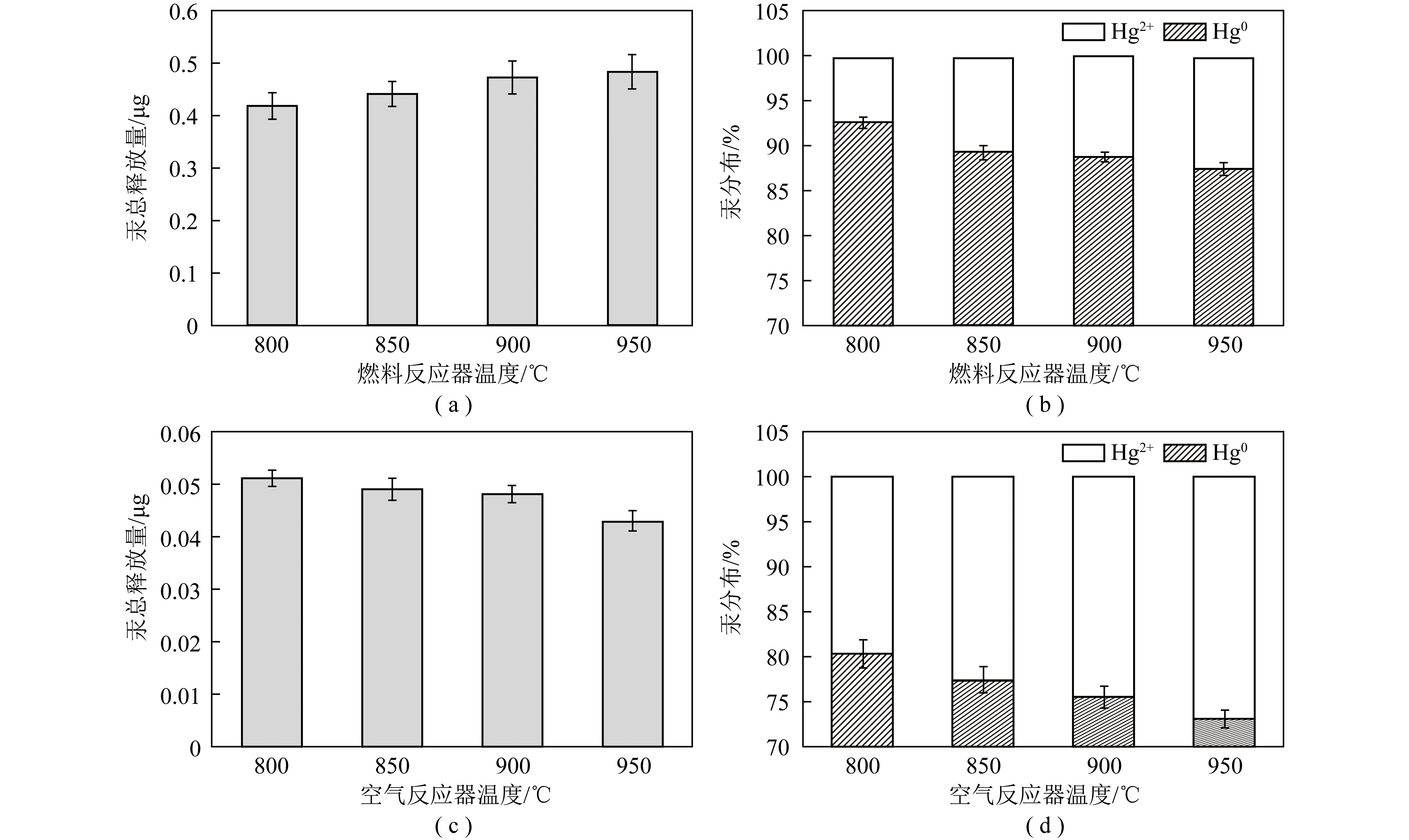
图4 燃料反应器和空气反应器温度对汞总释放量及汞分布的影响[33]Fig.4 Effects of fuel reactor and air reactor temperature on total Hg release amount[33]
6 结 论
1)关于气化介质的影响,H2O(g)不仅会通过促进煤中挥发分析出、抑制孔结构熔融及提高煤燃烧效率来增强Hg释放,还会与Hg反应生成Hg(OH)2继而分解成HgO和Hg0,以及抑制HCl向Cl转化而抑制Hg0向Hg2+氧化。CO2对Hg0的均相氧化无影响,但会抑制HCl对载氧体脱汞的促进作用。
2)关于气化产物的影响,CO、H2和NH3由于具有强还原性,会通过消耗金属氧化物表面氧而抑制Hg0氧化。H2S会与载氧体表面氧反应生成表面活性硫(40~200 ℃),而增强载氧体对Hg0的脱除效果,但H2S浓度过高时,过多H2S会在载氧体表面生成对Hg0氧化并不活跃的环状硫或链状硫,此时H2S浓度增加反而会减弱H2S的促进作用,甚至抑制载氧体的脱汞效果。HCl的促进作用随温度变化而不同,在低温段(80~280 ℃)归因于HCl预吸附的Eley-Rideal机理,在中温段(28~580 ℃)归因于Langmuir-Hinshelwood机理,在高温段(>580 ℃)则主要归因于HCl对Hg0的均相氧化。H2S和HCl的促进作用均随浓度增加而减弱,原因在于H2S浓度过高会在载氧体表面生成对Hg0氧化并不活跃的环状硫或链状硫,而HCl浓度过高则会占据金属氧化物表面的活性位点。
3)关于载氧体对Hg0氧化的促进作用总结为:① 载氧体中晶格氧对Hg0的直接氧化作用;② 载氧体将H2S氧化成活性S,活性S进而与Hg0反应生成HgS;③ 载氧体将HCl氧化成活性Cl或Cl2,Cl或Cl2进而与Hg0反应生成HgCl2。
4)关于反应温度的影响,虽然燃料反应器温度高会增强煤中Hg释放,但也可通过促进Cl的生成和抑制CO生成从而促进Hg0氧化。空气反应器温度越高,不仅有利于空气反应器中Hg0氧化,还会通过促进煤在燃料反应器中充分燃烧,减弱焦炭对Hg的吸附作用,从而抑制Hg0从空气反应器出口逸出。
7 展 望
CLC对于我国实现双碳目标具有重要意义,有效解决CLC过程产生的Hg污染问题十分必要,今后相关研究需注意以下几点:
1)H2O(g)含量不仅会影响气化速率,还会影响Hg释放及Hg0氧化。H2O(g)含量过低会对气化速率产生一定限制,含量过高则会加剧Hg的释放不利于Hg0氧化。因此,在保证气化速率的前提下,选取合适的H2O(g)含量以尽可能减少Hg的释放以及促进Hg0的氧化有待进一步研究。
2)载氧体对Hg0氧化的促进作用为实现CLC炉内脱Hg提供了方案参考和数据支撑。选择合适的载氧体不仅可以实现氧的传递,还可以增强燃料反应器内Hg0的氧化,有利于实现载氧体的“一体两用”。然而,目前针对载氧体在氧传递和Hg0氧化2方面协同效应的研究还比较有限。载氧体的主要功能在于氧在空气反应器向燃料反应器中传递,保证足够氧传递能力的前提下,如何实现载氧体在氧传递和Hg0氧化的最优效果有待深入研究。
3)空气反应器温度是影响Hg0氧化重要因素。空气反应器的主要目的在于载氧体再生。保证载氧体再生效率的前提下,选择合适的空气反应器温度以尽可能增强空气反应器中Hg0的氧化及Hg逸出仍是今后的研究热点。
