EBV-miR-BART6-3p调控STMN1表达对鼻咽癌细胞凋亡及放射敏感性的影响
2022-08-25汪锐杨颖龙国贤
汪锐 杨颖 龙国贤
(1武汉市第一医院肿瘤科,湖北 武汉 430000;2华中科技大学同济医学院附属同济医院肿瘤科)
鼻咽癌是一种起源于鼻咽部黏膜上皮的头颈部恶性肿瘤,其在我国的发病率约占全球80%〔1〕。放疗是鼻咽癌的首选治疗方法,但因部分患者表现出放疗抵抗导致其应用受限〔2,3〕。因此,深入探讨鼻咽癌患者放疗抵抗机制,寻找有效提高放疗敏感性的方法一直是研究热点。微小RNA(miRNA)是一类保守的内源性非编码RNA,被证实在鼻咽癌放疗抵抗中发挥着重要作用〔4〕。EB病毒(EBV)感染是鼻咽癌发病的重要因素,其编码的miRNAs可通过调控病毒和宿主细胞中的基因表达,在肿瘤发生和放疗抵抗过程中发挥重要作用〔5,6〕。研究指出,EBV-miR-BART6-3p可通过调控长链非编码RNA(lncRNA)LOC553103/stathmin(STMN1)轴抑制鼻咽癌细胞增殖〔7〕,而STMN1在有丝分裂纺锤体形成过程中发挥着重要作用,且在肿瘤中异常高表达,可通过调控细胞增殖、凋亡和放疗敏感性参与肿瘤的发生发展〔8,9〕。本研究猜测EBV-miR-BART6-3p可能通过调控STMN1表达参与鼻咽癌细胞凋亡和放疗抵抗,故开展体外细胞实验加以验证,旨在揭示鼻咽癌发生和放疗抵抗的分子机制。
1 材料与方法
1.1材料 荧光定量聚合酶链反应(PCR)检测试剂盒(货号:BL705A,南通艾得尔);青霉素链霉素双抗(货号:15140-122,美国Gibco);脂质体2000和Trizol试剂(货号:11668、15596018,美国Invitrogen);兔抗人STMN1和β-肌动蛋白(β-actin)单克隆抗体(货号:ab52630、ab179467,美国Abcam);miR-BART6-3p模拟物(货号:M-01-S,上海吉玛);pcDNA3.4-STMN1过表达载体质粒(货号:KL-ZL3152,上海柯雷生物);DMEM培养基、胰蛋白酶、全蛋白提取试剂盒和膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒(货号:90113、T8150、BC3710、CA1020,北京索莱宝);生物显微镜(型号:E100,尼康);细胞培养箱(型号:371型,美国Thermo);流式细胞仪(型号:FACSCalibur,美国BD);凝胶成像分析系统、实时荧光定量PCR仪(型号:Gel Doc XR+、CFX96 Touch,美国Bio-Rad);直线加速器(型号:NMSR600,东软医疗)。
1.2HNE2细胞培养、分组与转染 将购自美国ATCC的人鼻咽癌HNE2细胞接种至DMEM培养基(含1%青链霉素双抗和10%胎牛血清)中,于饱和湿度、37℃、5%CO2培养箱内常规培养,每2~3 d传代1次。将对数生长期的HNE2细胞接种至6孔板上后,培养至70%融合度时,细胞分为对照组(未处理)、miR-NC组(转染阴性对照)、miR-BART6-3p组(转染miR-BART6-3p模拟物)、miR-BART6-3p+pcDNA组(共转染miR-BART6-3p模拟物和pcDNA3.4空载体质粒)和miR-BART6-3p+STMN1组(共转染miR-BART6-3p模拟物和pcDNA3.4-STMN1过表达质粒),每组设3个复孔。按照脂质体2000说明书对HNE2细胞进行相应转染,48 h后收集各组细胞进行后续实验。
1.3实时荧光定量PCR检测HNE2细胞中miR-BART6-3p和STMN1 mRNA表达水平 采用Trizol法提取HNE2细胞总RNA后行逆转录;以逆转录产物cDNA为模板进行实时荧光定量PCR扩增。以U6或β-actin为内参,采用2-ΔΔCt法计算HNE2细胞中miR-BART6-3p和STMN1 mRNA表达水平。实验重复3次。由上海英捷公司合成的引物序列如下:miR-BART6-3p上游引物5′-GGTCACGGGCA CTCCTTGGATAGGTACC-3′,下游引物5′CCCAGTGAGCTCCACCATCAAA-3′;U6上游引物5′-CTCGC TTCGGCAGCACA-3′,下游引物5′-AACGCTTCAC GAATTTGCGT-3′;STMN1上游引物5′-CCTCTGTTTGGCGCTTTTGTGCG-3′,下游引物5′-GGCACGCTTCTCCAGTTCTTTCACC-3′;β-actin上游引物5′-CACCATGAAGATCAAGATCATTGC-3′,下游引5′-GGCCGGACTCATCGTACTCCTGC-3′。
1.4流式细胞仪检测HNE2细胞凋亡 胰蛋白酶消化收集待检测的HNE2细胞后,使用磷酸盐缓冲液漂洗细胞2次。以结合缓冲液重悬细胞,先后加入Annexin V-FITC和PI,避光15 min后,采用流式细胞仪在60 min内检测HNE2细胞凋亡率。实验重复3次。
1.5克隆形成实验检测HNE2细胞放射敏感性 胰蛋白酶消化收集待检测的HNE2细胞,调整细胞密度后根据X射线照射剂量接种至6孔细胞板上;培养达80%融合度时,分别以0、2、4、6、8 Gy剂量的X射线照射,且每个照射处理设置3个复孔;照射结束后,将细胞置于细胞培养箱内继续培养2 w左右;待有肉眼可见菌落出现时,终止培养;磷酸盐缓冲液洗涤细胞后,以4%多聚甲醛固定15 min;经吉姆萨染色20 min后,采用显微镜观察HNE2细胞克隆数,计算HNE2细胞存活分数;采用单击多靶模型拟合细胞存活曲线。实验重复3次。
1.6Western印迹检测HNE2细胞中STMN1蛋白表达水平 提取HNE2细胞总蛋白,采用二喹啉甲酸法定量蛋白浓度;将变性后的蛋白样品行电泳分离后,转至聚偏氟乙烯膜上;经5%脱脂奶粉封闭后,加入1∶1 000稀释的一抗室温孵育过夜;再以1∶2 000稀释的二抗室温孵育2 h,用化学发光剂于暗室内显影曝光;β-actin为内参,凝胶成像系统分析HNE2细胞中STMN1蛋白表达水平。实验重复3次。
1.7统计学方法 采用SPSS24.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1各组HNE2细胞中miR-BART6-3p表达水平比较 miR-NC组HNE2细胞中miR-BART6-3p表达水平与对照组(1.02±0.11 vs 0.98±0.07)差异无统计学意义(t=0.531,P=0.623);而miR-BART6-3p组HNE2细胞中miR-BART6-3p表达水平显著高于miR-NC组(24.58±3.26 vs 1.02±0.11,t=12.510,P=0.000)。
2.2miR-BART6-3p对HNE2细胞凋亡的影响 miR-NC组HNE2细胞凋亡率与对照组(7.96±1.03 vs 8.62±1.25)差异无统计学意义(t=0.706,P=0.519);而miR-BART6-3p组HNE2细胞凋亡率显著高于miR-NC组(20.25±3.10 vs 7.96±1.03,t=6.516,P=0.003)。见图1。
2.3miR-BART6-3p对HNE2细胞存活分数的影响 对照组、miR-NC组和miR-BART6-3p组HNE2细胞存活分数均呈X射线照射剂量依赖性降低(P<0.05);相同剂量X射线照射后miR-NC组中HNE2细胞存活分数与对照组无明显改变(P>0.05);而2、4、6、8 Gy miR-BART6-3p组HNE2细胞的存活分数显著低于miR-NC组(P<0.05),且增敏比SER为1.56。见表1。
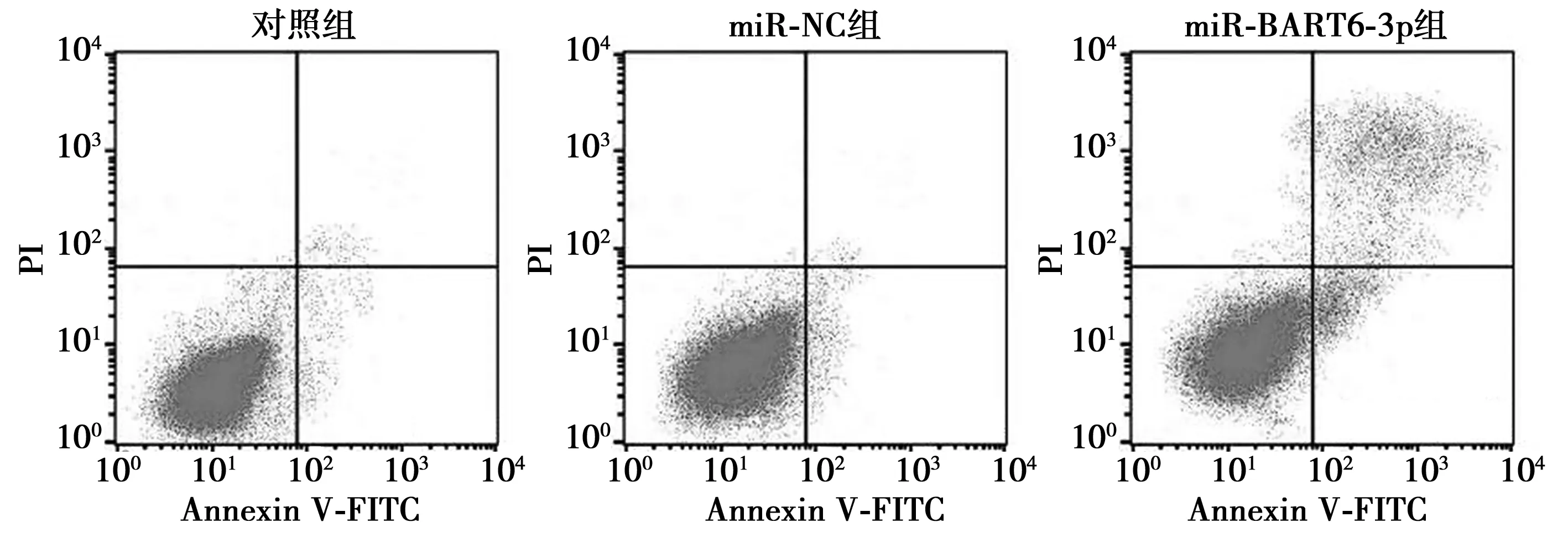
图1 流式细胞仪检测HNE2细胞凋亡
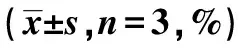
表1 各组HNE2细胞存活分数比较
2.4miR-BART6-3p对HNE2细胞中STMN1表达的影响 miR-NC组HNE2细胞中STMN1 mRNA和蛋白表达水平与对照组差异无统计学意义(P>0.05);而miR-BART6-3p组中STMN1 mRNA和蛋白表达水平显著低于miR-NC组(P<0.05)。见图2和表2。

1~3:对照组、miR-NC组、miR-BART6-3p组图2 Western印迹检测STMN1蛋白表达

表2 各组细胞中STMN1 mRNA和蛋白表达 水平比较
2.5STMN1过表达逆转miR-BART6-3p对HNE2细胞存活分数及凋亡率的影响 miR-BART6-3p组细胞凋亡率〔(20.83±2.32)%〕显著高于miR-NC组〔(7.16±1.05)%,P<0.05〕,且放射增敏比SER为1.48;miR-BART6-3p+STMN1组HNE2细胞中STMN1 mRNA和蛋白表达水平显著高于miR-BART6-3p+pcDNA组,细胞凋亡率显著低于miR-BART6-3p+pcDNA组(P<0.05)。miR-BART6-3p+pcDNA 组和miR-BART6-3p+STMN1组细胞存活分数均呈X 射线照射剂量依赖性降低(P<0.05);而miR-BART6-3p+pcDNA 组细胞存活分数显著低于 miR-BART6-3p+STMN1组(P<0.05)。且放射增敏比SER为0.75。见图3、图4和表3,表4。
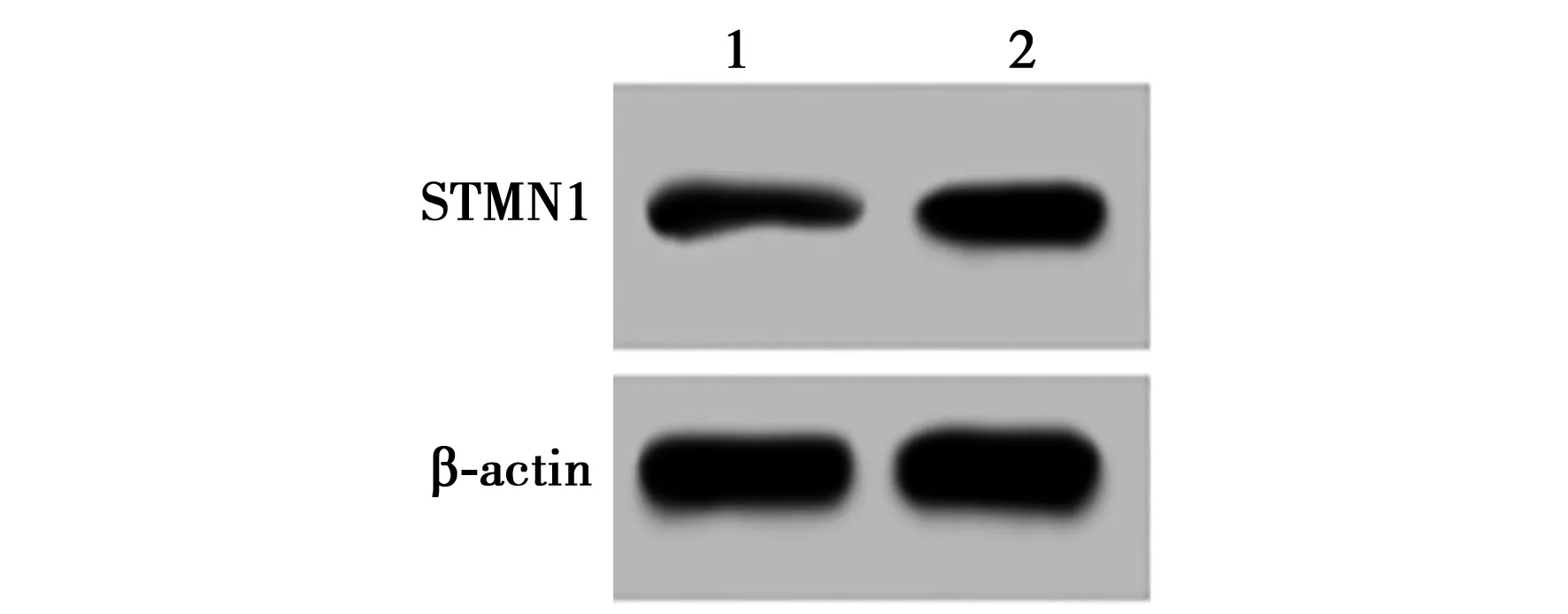
1,2:miR-BART6-3p+pcDNA组,miR-BART6-3p+STMN1组图3 Western印迹检测STMN1蛋白表达
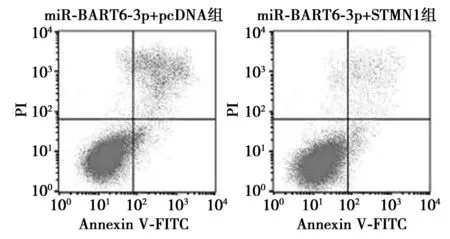
图4 流式细胞仪检测细胞凋亡
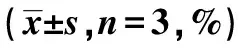
表3 STMN1过表达后HNE2细胞存活分数比较

表4 STMN1过表达后HNE2细胞凋亡率比较
3 讨 论
EBV BART miRNA(EBV-miR-BART)在鼻咽癌EBV编码的miRNA中表达量最高〔10〕,与鼻咽癌的发生发展有密切关系〔11~13〕。李剑飞等〔14〕指出,鼻咽癌中异常高表达的EBV-miR-BART4和EBV-miR-BART8-3p可作为鼻咽癌诊断防治的潜在标志物。Lin等〔15〕研究指出,EBV-miR-BART8-3p在鼻咽癌中呈高表达,可通过激活核转录因子(NF)-κB和Erk1/2通路靶向RNF38诱导鼻咽癌细胞上皮-间质转化并促进其转移。Wu等〔16〕报道指出,EBV-miR-BART4在鼻咽癌中表达上调,且其表达水平的改变与患者临床分期、淋巴结肿大程度和分化程度有关,而下调miR-BART4表达可抑制肿瘤细胞增殖、侵袭、迁移,促进细胞凋亡并增强细胞的放射敏感性。
miR-BART6-3p是EBV-miR-BART中的一员,可通过调控肿瘤细胞增殖和转移在鼻咽癌中发挥着抑癌作用〔17〕,本研究结果表明,miR-BART6-3p过表达可诱导鼻咽癌HNE2细胞凋亡并增强其放射敏感性。STMN1是一种与肿瘤发生发展密切相关的微管解聚蛋白,可通过调控微管动力,在细胞分裂、增殖和凋亡等过程中发挥着重要作用〔18〕。Hsu等〔19〕研究指出,STMN1在鼻咽癌中呈高表达,且与患者不良预后密切相关。汪文利等〔20〕研究指出,沉默STMN1表达可通过抑制SHH信号通路活化促进鼻咽癌细胞凋亡,增强肿瘤细胞对顺铂的敏感性。Sun等〔9〕研究指出,下调STMN1表达可增强鼻咽癌细胞的放射敏感性。可见,STMN1与鼻咽癌发病及放疗抵抗密切相关。Wang等〔7〕研究指出,miR-BART6-3p在鼻咽癌中可通过靶向吸附LOC553103间接调控STMN1表达;猜测miR-BART6-3p可能通过调控STMN1参与鼻咽癌细胞凋亡和放疗抵抗过程。本研究结果提示在鼻咽癌中miR-BART6-3p促凋亡及放射增敏作用可能与其调控STMN1表达有关。本研究结果表明,miR-BART6-3p可通过下调STMN1表达促进HNE2细胞凋亡并增强细胞放射敏感性。
综上,miR-BART6-3p与鼻咽癌发病及放疗抵抗密切相关,其可通过下调STMN1表达诱导鼻咽癌HNE2细胞凋亡并增强细胞的放射敏感性。
