紫藤化学成分和药理活性研究进展
2022-08-23李舂龙詹慕蓉高华刘正苟洪倩阳倩倩马赫陈钇洁罗婷江志波南泽东
李舂龙, 詹慕蓉, 高华, 刘正, 苟洪倩, 阳倩倩, 马赫,陈钇洁, 罗婷, 江志波*, 南泽东
(1.北方民族大学化学与化学工程学院, 银川 750021; 2. 北方民族大学国家民委化工技术基础重点实验室, 银川 750021; 3. 北方民族大学宁夏太阳能化学转化技术重点实验室, 银川 750021)
紫藤(Wisteriafloribunda) 是豆科(Leauuminosae)紫藤属植物,为常见的园林绿化观赏植物[1],在中国拥有2 000多年栽培历史,又名朱藤、葛藤、豆藤、黄纤藤、岩搬豆、招藤等,古称虎豆、虎桑、摄,在华北、西北、华东、华中、西南地区均有种植,在朝鲜、韩国、美国、日本等国家也有大量的种植[2]。紫藤枝叶茂密,具有减尘、降噪作用,能吸收氯气、氯化氢和二氧化硫等有毒的气体,是防治环境污染的优良植物[3]。
紫藤集观赏、医药、环保于一身,具有很高的研究价值,它的茎、叶、根、花、种子均有药用价值[2],具有抗肿瘤、抗氧化、凝集、抑菌、蛋白酶抑制等活性[4]。药用历史悠久,始载《本草拾遗》:“主水瘾病,作煎如糖,下水良”,味甘、苦,性微温。紫藤根皮和花具有解毒、止吐泻、治腹水消肿,小便不利,痛风及关节肿痛等症;紫藤茎用于治疗关节疼痛、蛲虫病及风痹痛等症;紫藤瘤有止痛、解毒、杀菌等功效,用于乳腺癌、肝炎、皮肤癌、胃癌的治疗,日本民间用作抗胃癌药[5-6]。近年,有学者对紫藤不同部位活性成分进行了简单的综述[7]。现从20世纪60年代至今对紫藤化学成分研究和药理活性两个方面的工作进行综述,以期为进一步挖掘紫藤潜在药用价值提供借鉴。
1 化学成分研究进展
紫藤不同部位化学成分的研究可追溯至20世纪60年代中期,迄今为止,科学家们从紫藤花、紫藤种子、紫藤瘤、紫藤叶、紫藤茎的甲醇或乙醇渗漉提取液中分离鉴定出149种化合物,根据化合物的类型分为黄酮类、异黄酮类、异黄酮苷、黄烷、异黄烷、三萜、木脂素、甾体等成分。
1.1 黄酮及衍生物型化合物
紫藤中黄酮及衍生物型化合物的化学结构如图1、图2和表1所示。Mohamed等[8]从紫藤叶的甲醇水提物中分离出orientin (1)、isoorientin (2)、vitexen (3)、isovitixen (4)、apigenin(5)、luteolin(6)、chrysoeriol-7-O-[2″-O-(5′′′-O-caffeoyl)-β-D-apiofuranosyl]-β-D-glucopyranoside(7),其中括号中的数字对应表1中的序号;Tai等[9-10]从紫藤豆荚果皮中分离出kaempferol (8)、kaempferol 3-O-β-D-glucopyranoside (9)、kaempferol 3-O-β-D-apiofuranosyl-(1→6)-β-D-glucopyranoside (10)、kaempferol 3-O-rutinoside (11)、kaempferol 7-O-β-D-glucopyranoside (12)、kaempferol 3,7-di-O-β-D-glucopyranoside (13)、kaempferol 3,4′-di-O-β-D-glucopyranoside (14);王国凯等[11]从紫藤瘤95%的乙醇渗漉溶液中获得了槲皮素-3-O-β-D-吡喃葡萄糖苷(quercetin-3-O-β-D-glucopyranoside,15)、扁蓄苷(avicularin,16);Dawidar等[12]从紫藤茎的正丁醇提取物中分离出7-O-[2-O-(6-deoxy-α-L-mannopyranosyl)-β-D-glucopy ranosyl]-5,6,7,4′-tetrahydroxy flavone (17);吴培云等[13]从紫藤瘤中分离出7,4′-二羟基-二氢黄酮 (7,4′-dihydroxy-dihydroflavone,18)、3,7-二羟基-4′-甲氧基-二氢黄酮醇(3,7-dihydroxy-4′-methoxyl-dihydroflavanonol,19);王国凯等[11]从紫藤瘤中分离出5,7-二羟基-4′-甲氧基双氢黄酮,也称为异樱花素 (isosakuranetin,20);Wang等[14]从紫藤瘤中的80%乙醇液中分离出Wisterone B (21)、Wisterone C (22)、Wisterone D (23)。
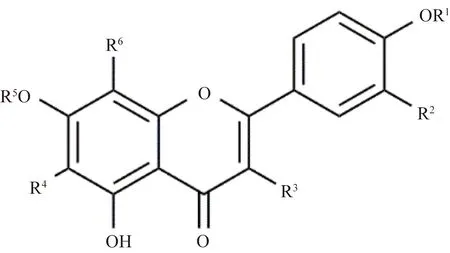
图1 紫藤中代表性黄酮结构Fig.1 Structure of representative flavonoids in Wisteria floribunda
1.2 异黄酮类化合物
紫藤中异黄酮类化合物的化学结构如图3和表2所示。Konoshima 等[5]从紫藤的甲醇提出物中分离出阿佛洛莫生 (afromosin,24);刘劲松等[15]从紫藤瘤的95%乙醇的石油醚部位分离出芒柄花黄素 (foxmononetin,25);Konoshima[16]从紫藤瘤的甲醇提取物中分离出 7-O-acetylafromosin (26)、7-O-acetylformononetin (27)、7-O-methylafromosin (28)、7-O-methyl-formononetin(29);彭志茹等[17]从紫藤茎的甲醇提取物中分离得到7,3′,4′-三羟基异黄酮 (7,3′,4′-trihydroayisoflavanone,30)、樱黄素 (prunetin,31)、7,3′,5′-三羟基-4′-甲氧基异黄酮 (gliricidin,

图2 紫藤中其他黄酮结构Fig.2 Other structures of flavones from Wisteria floribunda
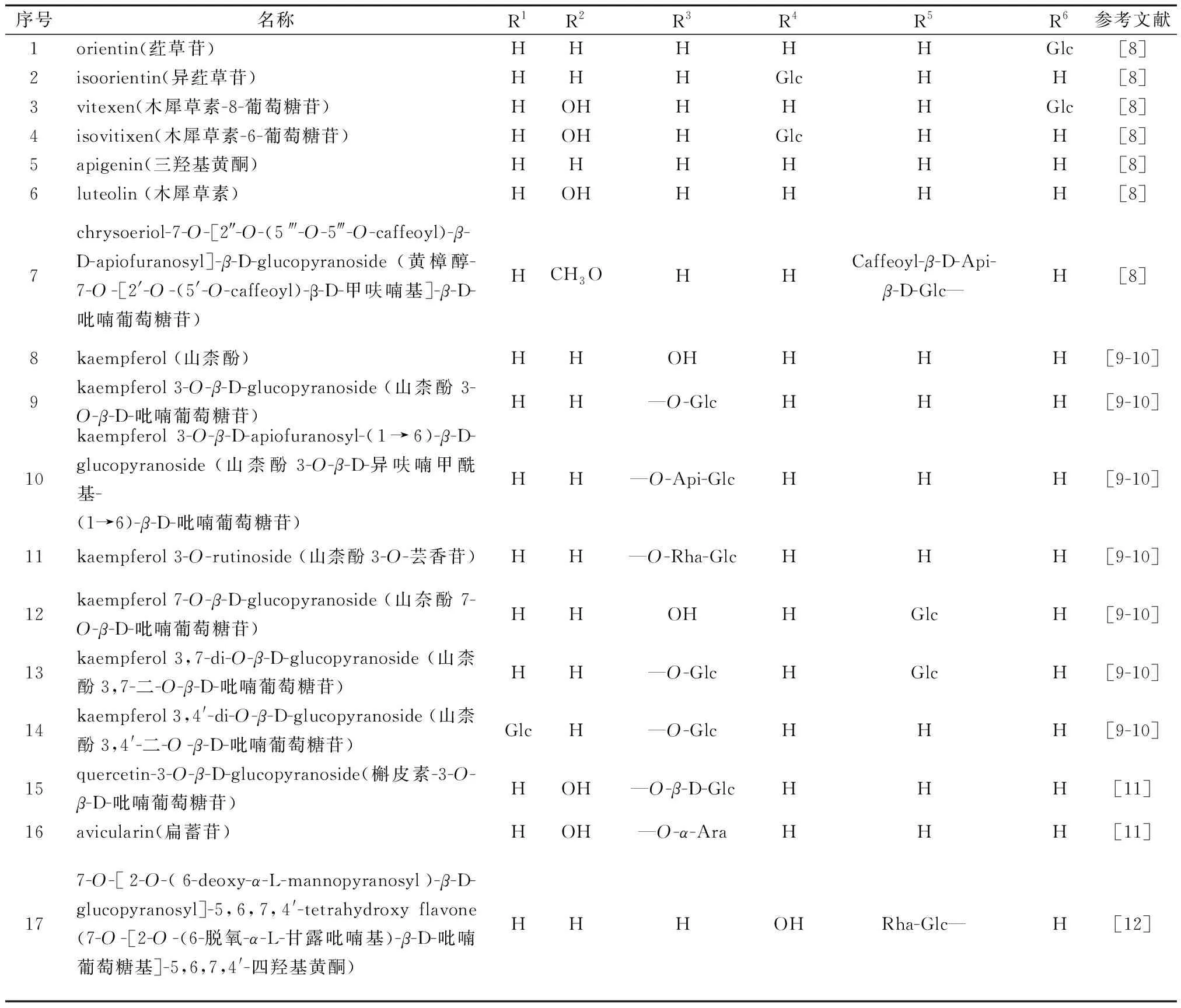
表1 紫藤中黄酮类成分结构信息Table 1 Informations of flavones from Wisteria floribunda
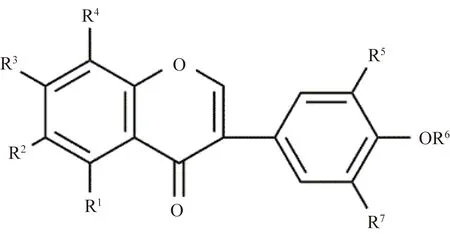
图3 紫藤中代表性异黄酮结构Fig.3 The structure of isoflavones from Wisteria floribunda
32);后来Konoshima等[6]从紫藤瘤中分离出鹰嘴豆芽素A (biochanin A,33)、8-甲雷杜辛 (8-O-methylretusin,34)、irisolidone (35);Kaneko[18]从紫藤瘤甲醇提取物中分离出6-methoxy-7,8,4′-trihydroxyisoflavone (36)、daidzein (37)、genistein (38)、glycitein (39)、kakkatin (40)、afromosin (41)、calycosin (42)、odoratin (43);Wang等[14]从紫藤瘤中的80%乙醇液中分离出7-methoxy-3′,4′-methylenedioxyisoflavone (44)、5′,7-dihydroxy-3′-methoxyisoflavone (45)。
1.3 异黄酮苷类化合物
紫藤中异黄酮苷类化合物的化学结构如图4和表3所示。Konoshima等[16]从紫藤瘤甲醇提取物中分离出wistin (46);彭志茹等[17]从紫藤茎的甲醇提取物中分离得到鸢尾黄素-7-O-β-D-(6″-O-乙酰基)-葡萄糖苷 [tectorigenin-7-O-β-D-(6″-O-acetyl)-glucoside,47]、鸢尾苷 (teotoridin,48)、染料木苷 (gexristin,49)、降紫香苷 (sissotrin,50)、葛花宁 (kakkanin,51)、苦参醇O (kushenol O,52);Kaneko等[18]从紫藤瘤甲醇提取物中分离出isotectroigenin 7-O-β-D-glucopyranoside(53);Konoshima等[19]从紫藤瘤的80%热甲醇提取物中分离出芒柄花苷 (ononin,54);Shibata等[20]从紫藤热甲醇提取物中分离出wistin methyl ether(55)。

表2 紫藤中异黄酮类成分结构信息Table 2 Informations of isoflavones from Wisteria floribunda
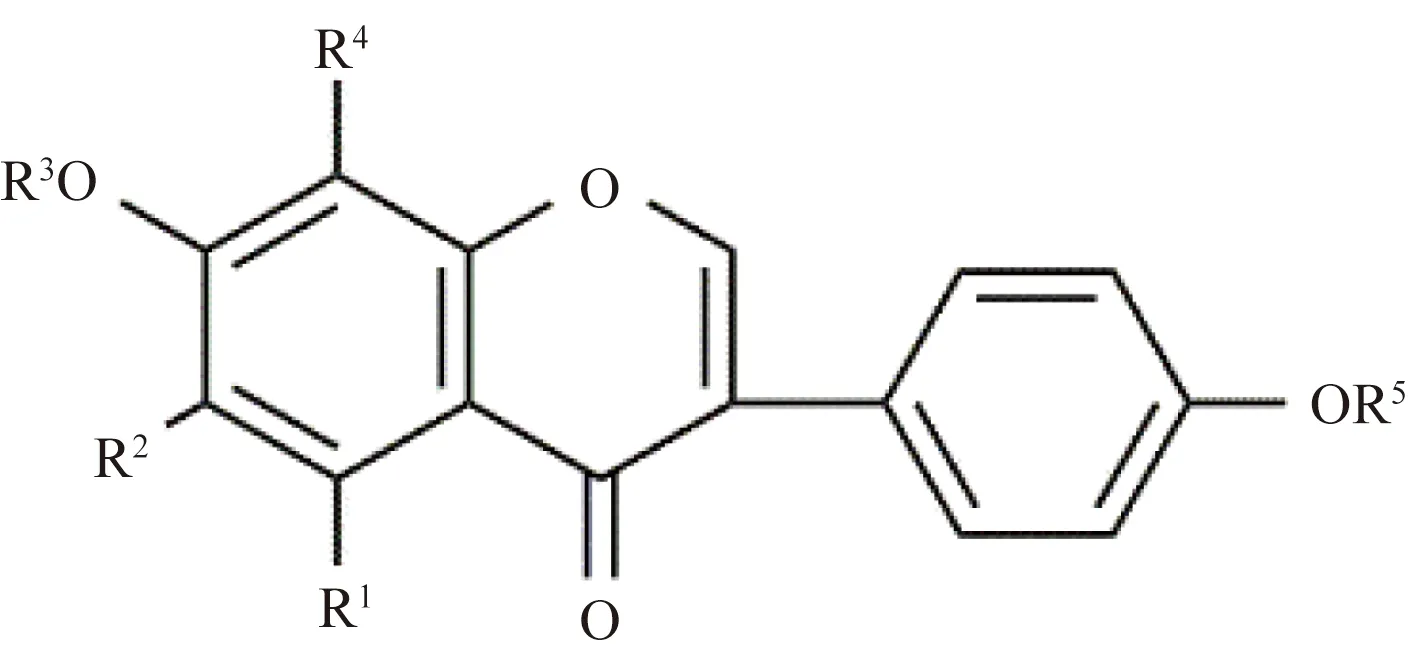
图4 紫藤中代表性异黄酮苷结构Fig.4 The structure of isoflavone glycosides from Wisteria floribunda
1.4 三萜类化合物
紫藤中三萜类化合物的化学结构如图5、图6及表4所示。1989年Konoshima等[21]从紫藤瘤中分离得到triterpenoid trimethylether (56)、wistariasapogenol B (57)、triterpenoid monoacetyl trimethylether (58)、triterpenoid tetraacetate (59)、triterpene diacetate (60)、wistariasapogenol A (61)、wistariasapogenol A triacetate (62)、sapogenol (84)、sapogenol diacetate (85);2012年Liu等[22]从紫藤瘤的95%乙醇渗漉液的石油醚部位分离得到12-齐墩果烯-3,22,24-三醇 (soyasapogenol B,63)、白桦脂酸 (betulinic acid,86)、羽扇豆醇 (lupeol,87)、11α,12α-环氧蒲公英赛醇 (11α,12α-oxidotaraxerol,90)、12-齐墩果烯-3β, 24-二羟基-22-酮 (22-oxo-3β, 24-dihydroxyolean-12-ene,91)、12-齐墩果烯-2α,3β,23-三醇 (2α,3β,23-trihydroxyolean-12-ene,92)、12-齐墩果烯-3α,21β-二醇 (3α,21β-dihydroxy-olean-12-ene,93);Konoshima等[19]从紫藤瘤的80%热甲醇提取物中分离出wistariasaponin B1 (64)、wistariasaponin B2 (65)、wistariasaponin A(66);Benchadi等[23]从紫藤根的65%乙醇水溶液超声提取分离出wistariasaponin C (67);Konoshima等[24]从紫藤瘤中分离得到soyasaponin I(68), soyasaponin II(69)、wistariasaponins D (70);Champy等[25]从紫藤根中分离出wistariasaponins G (71)、3-O-α-L-rhamnopyranosyl-(1→2)-β-D-Xylopyranosyl-(1→2)-β-D-glucuronopyranosyl-22,28-O-di-acetylolean-l2-ene-3β, 16β,22β,28-tetrol (99);Konoshima等[26]从紫藤瘤中分离得到wistariasaponins G ester (72)、wistariasaponins D methyl ester (73)、dehydrosoyasaponin I(74)、dehydrosoyasaponin I methyl ester (75)、soyasapogenol E (76);Kinjo等[27]从紫藤茎的甲醇提取物中分离出wistariasaponin YC1(77)、wistariasaponin YC2(78)、wistariasaponin B3 (79)、wistariasaponin A2(80)、wistariasaponin A3(81);Uchiyama等[28]从紫藤根中分离出Millettiasaponin A (82);Champy等[29]从紫藤根中分离出3-O-β-D-xylopyranosyl-(1→2)-β-D-glucurono-pyranosyl-22-O-acetyl-3β, 22β, 24-trihydroxyolean-12-en-30-oic acid (83);Mohamed[8]从紫藤叶的甲醇水提物中分离出齐墩果酸oleanolic acid(88),hedragenin (89);王国凯等[11]从紫藤瘤活性部位用95%乙醇渗漉液中分离出12-齐墩果烯-3-酮-22,24-二醇 (olean-12-ene-3-oxo-22,24-dio1,94);陈爱民等[30]从紫藤瘤的 95%乙醇渗漉液的石油醚部位分离出蒲公英赛酮 (taraxerone,95)、蒲公英赛醇 (taraxerol,96)、木栓酮 (friedelin,97)、表木栓醇 (epifriedelanol,98)。

表3 紫藤中异黄酮苷类成分结构信息Table 3 Informations of isoflavone glycosides from Wisteria floribunda
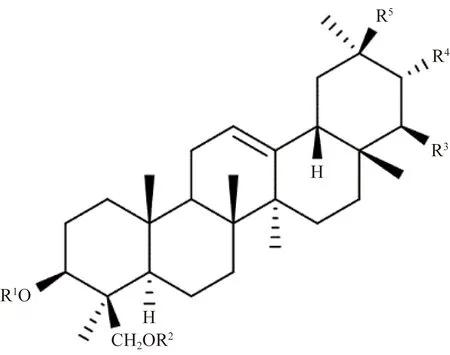
图5 紫藤中代表性三萜类结构Fig.5 The structure of triterpenes from Wisteria floribunda
1.5 黄烷类化合物
紫藤中黄烷类化合物的化学结构如图7和表5所示。Tai等[9-10]从紫藤豆荚果皮的甲醇渗漉液中分离得到dulcisflavan (100)、(+)-afzelechin (101)、 (+)-afzelechin 5-O-β-D-glucopyranoside (102)、(+)-catechin (103)、(-)-epiafzelechin (104)、(-)-epiafzelechin 7-O-β-D-glucopyranoside (105)、(-)-epicatechin (106)、dulcisflavan (107)。
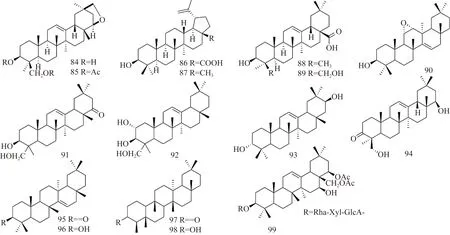
图6 紫藤中其他三萜类结构Fig.6 Other structures of triterpenes from Wisteria floribunda

表4 紫藤中三萜类化合物类成分结构信息Table 4 Informations of triterpenes from Wisteria floribunda
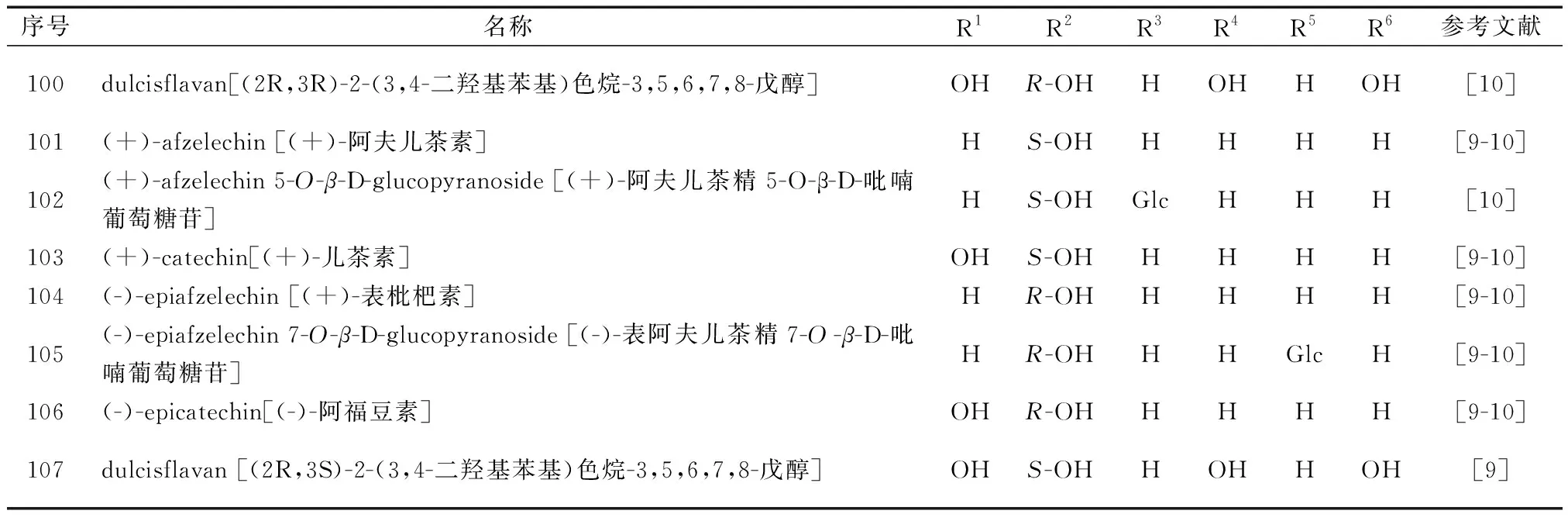
表5 紫藤中黄烷类化合物类成分结构信息Table 5 Informations of flavanes from Wisteria floribunda
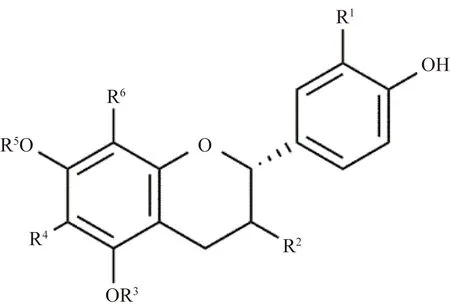
图7 紫藤中代表性黄烷类结构Fig.7 The structure of flavanes from Wisteria floribunda
1.6 异黄烷类化合物
紫藤中异黄烷类化合物的化学结构如图8所示。刘劲松等[15]从紫藤瘤的95%乙醇的石油醚部位分离出驴食草酚[(3S)-vestitol,108]、 (3S)-7,1′-二羟基-8,3′-二甲氧基异黄烷[(3S)-7,1′-dihydroxy-8,3′-dimethoxy-isoflavan,109]、异豆素[(±) isoduartin,110]、11β-羟基-11β, l-二氢美迪紫檀素 (11β-hydroxy 11β,1-dihydromedicarpin,111)、3-羟基美迪紫檀素 (3-hydroxy-medicarpin,112)、美迪紫檀素[(6aS,11aS)-medicarpin,113];Konoshima等[6]从紫藤瘤中分离得到 pendul-one (114)、isomucronulatol (115)、vestitol (116)、sativan (117)、medicarpin (118);Grosvenor等[31]从紫藤瘤80%乙醇提取液中分离出3′,5′-dihydroxy-7,2′,4′-trimethoxyisoflavan(coluteol,119), 7,4′,6′-trime-thoxy-isoflavan-2′,5′-quinone(colutequinone B,120)。
1.7 木脂素
紫藤中木脂素的化学结构如图9所示。Tai等[9]从紫藤豆荚果皮的甲醇渗漉液中分离得到丁香树脂醇(syringaresinol,121)、(-)-松脂醇[(-)-pinoresinol,122];王国凯等[11]从紫藤瘤中分离出松脂醇(pinoresinol,123);吴培云等[13]从紫藤瘤的80%乙醇提取液中分离得到表丁香脂素(episyringaresinol,124)。
1.8 甾体
紫藤中甾体的化学结构如图10所示。2012年Liu等[22]从紫藤瘤的95%乙醇渗漉液的石油醚部位分离得到β-谷甾醇棕榈酸酯 (β-sitosterol palmitate,125)、α-菠甾醇 (α-spinasterol,126)、麦角甾-5,7,22-三烯-3β-醇[( 22E, 24R)-ergosta-5,7,22-trien-3β-ol,127]、(22E, 24R)-5α,8α-过氧麦角甾-6,22-二烯-3β-醇[(22E, 24R)-5α,8α-epidioxy-ergosta-6,22-dien-3β-ol,128];王国凯等[11]从紫藤瘤95%的乙醇渗漉溶液中获得了星鱼甾醇 (stellasterol,129);吴培云等[13]从紫藤瘤的80%乙醇提取液中分离得到豆甾醇 (stigmasterol,130);Tai等[9]从紫藤豆荚果皮的甲醇渗漉液中分离得到sitosterol (131)、daucosterol (132);陈爱民等[30]从紫藤瘤的 95%乙醇渗漉液的石油醚部位中分离出β-胡萝卜苷 (β-daucosterol,133)、β-谷甾醇 (β-sitosterol,134)[32]。
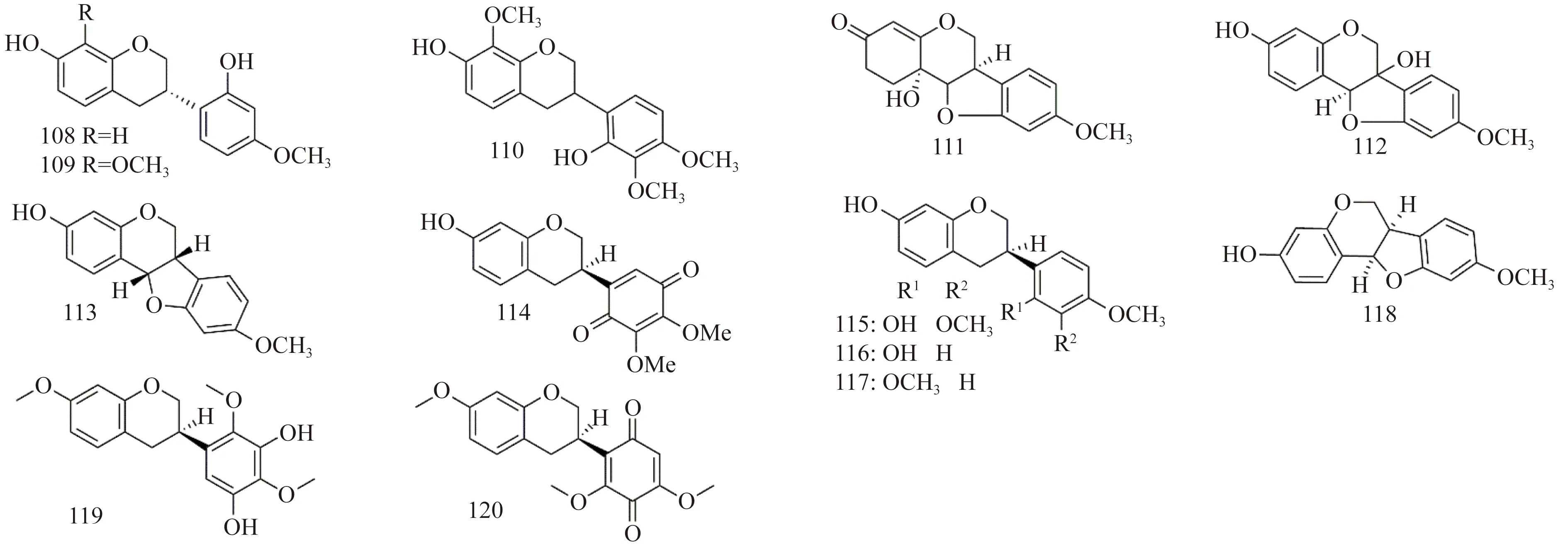
图8 紫藤中异黄烷类结构Fig.8 The structures of isoflavanes from Wisteria floribunda
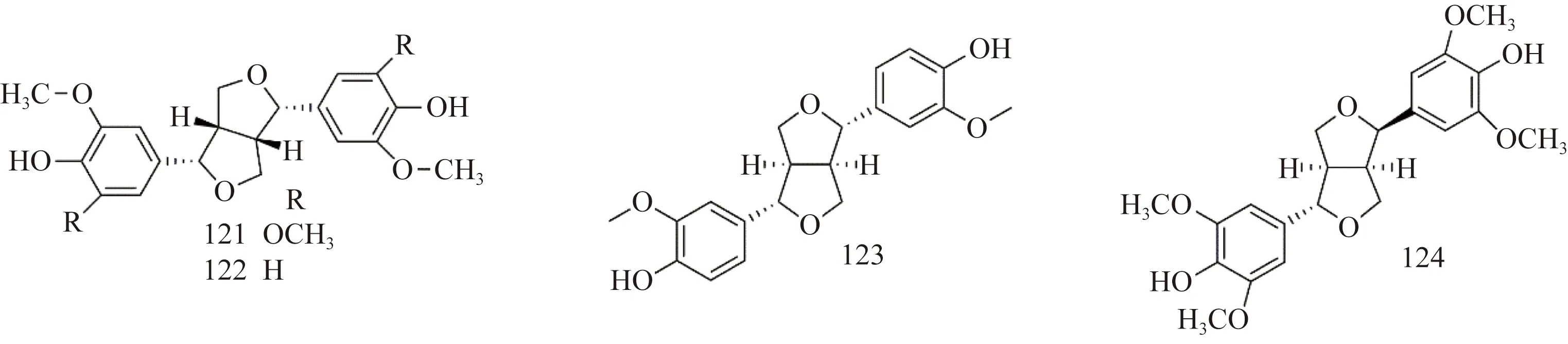
图9 紫藤中木脂素类结构Fig.9 The structures of lignans from Wisteria floribunda

图10 紫藤中甾体类结构Fig.10 The structures of sterols from Wisteria floribunda
1.9 其他化合物
紫藤中其他化合物的化学结构如图11所示。刘劲松等[15]从紫藤瘤的95%的乙醇渗漉液中分离出对羟基苯甲醛 (p-hydroxy-benzaldehyde,135)、香草醛 (vanillin,136)、5-羟基-7-甲氧基色原酮 (5-hydroxy-7-methoxychromone,137);王国凯等[11]从紫藤瘤95%的乙醇渗漉溶液中获得了邻苯二甲酸二丁酯 (dibutyl phthalate,139)、双丙酮醇 (diacetonealcohol,140)、2′,4′,4-三羟基查尔酮 (2′,4′,4-trihydroxychalcone,141);吴培云等[13]从紫藤瘤的80%乙醇提取液中分离得到间二苯酚 (resorcinol,138)、2′,4′-二羟基-4-甲氧基查尔酮 (2′,4′-dihydroxy-4-methoxylchaicons, 142)、4,4′-二羟基-2′-甲氧基查尔酮(4,4′-dihydroxy-2′-methoxylchaicone,143)、对羟基苯酚 (p-hydroxyphenol,144)、3,4,5-三甲氧基-苯甲酸 (3,4,5-trimethoxylbenzoic acid,145)、丁香酸 (syringate,146);Joulain等[33]从紫藤花中分离出(6-methoxy-4H-l-benzopyran-7-ol,147)、(6,7-dimethoxy-4H-l-benzopyran,148);Tai等[9]从紫藤豆荚果皮的甲醇渗漉液中分离得到(3,4-dimethoxy benzaldehyde,149)。
2 药理作用研究进展
紫藤是中国的传统中药,收录于《中华本草》,具有利水、除痹、止痛、解毒、杀菌等多种功效,常用于治疗浮肿、关节疼痛、肠寄生虫等病。通过对其进行药理研究进行综述,可为合理用药和新药研发提供理论依据。
2.1 抗氧化作用
酚类和黄酮具有清除自由基的作用,能降低多种疾病如关节炎、心脏病、衰老及癌症等发病率[34]。紫藤中含有丰富的黄酮类和酚类物质,Oh等[35]研究发现日本紫藤花的醇提和水提产物有很强的抗氧化性、还原能力及清除自由基活性。Mohamed等[8]从紫藤叶的甲醇水提物中分离出芹菜素、黄酮糖苷和木樨草素等,这些物质有抗氧化活性,对Hep-G2肿瘤细胞株具有显著的细胞毒性。Dawidar等[12]采用DPPH自由基清除能力测定紫藤茎的乙酸乙酯和二氯甲烷的提取液具有抗氧化活性。曹先爽等[36]研究紫藤种子的石油醚提取液有抗氧化活性,DPPH半抑制质量浓度为4.15 g/L。李会端[37]使用纤维素酶辅助法对紫藤叶、茎、花和果荚分别进行总黄酮提取,各部位提取液具有较强的清除自由基的活性。
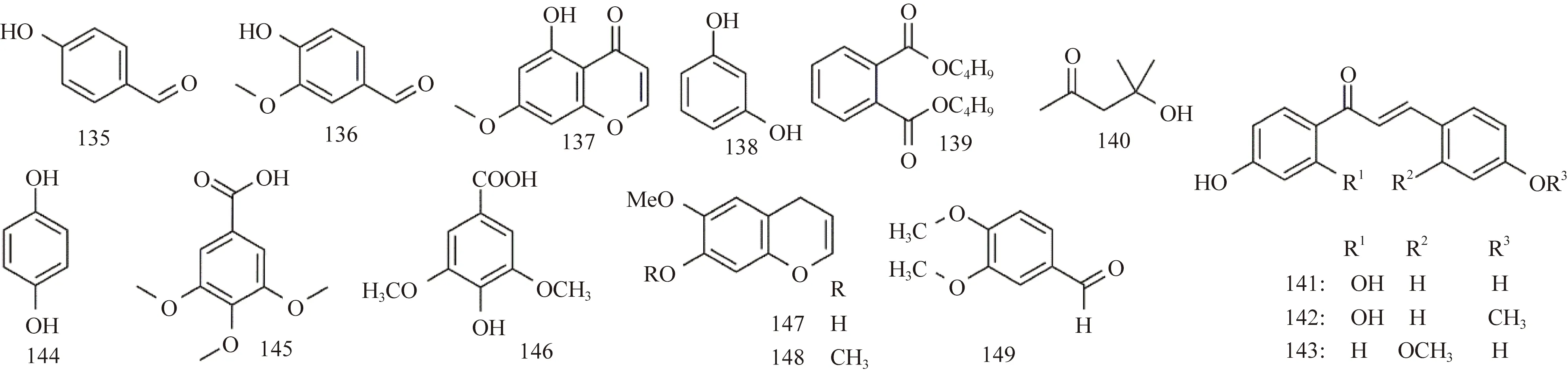
图11 紫藤中其他类化合物结构Fig.11 Other structures of compounds from Wisteria floribunda
2.2 抗癌、抗病毒作用
紫藤药用历史悠久,中医用于胃癌治疗。在日本民间医术中,藤瘤汁液用作抗炎剂[38]。1992年,Konoshima等[5]从紫藤瘤中分离出大豆皂苷I (soyasaponin I)和非洲霉素 (afromosin)对小鼠皮肤肿瘤的生长有明显的抑制作用,两者联合使用对两阶段皮肤癌变有增强的抑制作用。1997年,Konoshima等[6]在Raji细胞中测试了从紫藤瘤中分离出8种异黄酮对12-O-tetradecanoyl-phorbol-13-acetate (TPA)诱导的Epstein-Barr病毒(EBV)激活的抑制活性,其中pendulone对TPA诱导的Raji细胞周期效应具有强烈的抑制作用。在化学致癌过程中pendulone可能是有价值的化学预防剂,紫藤瘤在防癌方面拥有很好的开发潜质。
Tai等[9]从紫藤豆荚果皮的甲醇渗漉液中分离得到黄酮、三萜类、木脂素类等,这些活性化合物能通过抑制血管平滑肌细胞周期蛋白D1的表达来抑制血管平滑肌细胞的增殖,从而可能在减轻血管闭塞性疾病方面具有治疗潜力;随后Tai等[10]分离出黄酮和黄烷类化合物,体外实验具有抗炎作用, (+)-catechin、(-)-epicatechin、kaempferol 3-O-β-D-glucopyranoside 对HepG2细胞内被kappa-B激活核因子诱导的α-肿瘤坏死因子(TNF-α)的抑制作用最高,半抑制浓度值分别为14.1、16.5和11.9 μmol/L。2005年,Heo等[39]基于紫藤瘤提取物开展小鼠B16F1细胞的伤口愈合试验,提取物抑制CD44 mRNA表达,并增加RhoA-GTP蛋白的活性,抑制小鼠B16F1黑色素瘤细胞的迁移。2011年,Mohamed等[8]从紫藤叶的80%甲醇水提物中分离出apigenin、luteolin有抗Hep-G2肿瘤细胞活性。2015年,Dawidar等[12]发现紫藤茎提取物对HePG2、MCF-7、HCT-116有一定的细胞毒性,其紫藤茎石油醚提取物对MCF-7的抑制率的半抑制浓度为16.7 μg/mL。
植物凝集素与糖分子结合,可诱导细胞凝集,干扰细胞的代谢,具有治疗肿瘤[40]的功效,在肿瘤细胞和临床免疫研究具有广泛的应用[41-42]。豆科植物中的凝集素含量较多,科研工作者对紫藤种子中的凝集素研究较多[43-44]。1994年,陈凡等[45]通过紫藤种子的蛋白粗提液分离出紫藤凝集素,氨基酸组成主要含天冬氨酸、谷氨酸。凝集素对糖类的特异性和选择性,Agrawal等[46]研究紫藤种子中N-乙酰半乳糖胺特异性植物凝集素对MCF-7乳腺癌细胞株的抗增殖活性,研究发现凝集素WFL 329 μg/mL (2.8 μmol/L)对MCF-7产生显著的浓度依赖性抗增殖作用,发现细胞凋亡与乳酸脱氢酶(lactate dehydrogenase,LDH)渗漏、细胞周期阻滞和活性氧自由基(reactive oxygen species,ROS)产生有关。通过激活caspase-3可放大细胞凋亡信号,导致细胞死亡,从而为凝集素在肿瘤研究和进一步应用奠定了基础。
紫藤凝集素阳性Mac-2结合蛋白水平作为乙型肝炎[47-48]、丙型[49-50]肝炎患者引起肝癌病情严重程度的诊断指标,预测纤维化非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和NASH肝硬化的发生[51-52],作为健康体检中肝纤维化的筛查工具[53-55],肝硬化诊断生物标志物[56],预测早期肝癌[57],诊断胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的血清生物标志物[58],有助于鉴别儿童原发性硬化性胆管炎[59],预测HBV相关肝癌发生的风险[60],反映慢性胰腺炎的严重程度[61],反映系统性红斑狼疮的活动性[62],作为前列腺癌诊断和预后的新标志物[63],胆管癌和肝内胆管癌的生物标志物[64]。因此,紫藤凝集素阳性Mac-2结合蛋白在肝炎、肝纤维化、肝硬化以及肝癌等方面有很广的应用前景。
2.3 抑菌作用
朱立成[65]从紫藤种子中纯化出抗真菌肽WsAFP1和WsAFP2,对油菜菌核病菌(Sclerotiniasclerotiorum)和烟草赤星病菌(Alternariaalternata)的生长具有较强抑制作用。Xu等[66]从紫藤瘤的不同溶剂提取液中研究农作物抑菌活性,正丁醇、石油醚、乙酸乙酯提取物在5 mg/mL浓度中对小麦赤霉、辣椒枯萎病菌的抑菌率在50%左右,对油菜菌核菌抑菌效果最好,抑制率为100%。姜艳华等[67]从紫藤叶片丙酮提取物对白菜软腐病菌和香瓜枯萎病菌有显著的抑菌效果。
3 讨论与展望
紫藤栽培历史悠久,在中国各个地区都有分布,其茎、叶、果实、根、花都含有多种化学成分,药用历史悠久。从近十多年紫藤的研究进展来看,其化学成分在治疗痛风、关节疼痛、蛲虫病、杀菌、杀虫等方面有很好的应用前景,紫藤凝集素阳性Mac-2结合蛋白可以作为乙型肝炎、丙型肝炎、肝硬化、肝纤维化、肝癌等生物标志物,有很广的应用前景。
前期研究表明紫藤含有丰富的化学成分,已经发现149种成分中黄酮(黄烷醇)及其苷类物质占有较大比例,符合豆科植物的特征。并且,药理活性研究表明这些成分在抗氧化、抗病毒和抗肿瘤等方面表现出较强的生物活性,提示紫藤黄酮值得深入研究。大豆皂苷是豆科植物较为常见的三萜糖苷类成分,具有显著的结构特征,同时是通过一个葡萄糖酸(GlcA)与苷元相连接,如从紫藤中发现的化合物66~75和77~83(表4)。早期对大豆皂苷的研究主要局限于对抗营养因子及不良风味因子方面,认为大豆皂苷具有对抗营养和不良口感等性质而主张在大豆的加工过程中将其去除。然而,后来许多学者发现大豆皂苷具有显著的降低胆固醇、抗血栓等药理功效,如Konoshima等[5]从紫藤瘤中分离出大豆皂苷I对小鼠皮肤癌细胞生长具有明显的抑制作用。特别是对大豆皂苷的化学结构,如2,3-dihydro-2,5-dihydroxy-6-methyl-4H-pyran-4-one结合皂苷的发现使得大豆皂苷的研究取得了较大的进展。近年来,中外的大量研究结果显示,大豆皂苷的毒副作用很小。这既为传统豆类食品提供了安全可靠的佐证,也为大豆皂苷的广泛应用提供了安全保障。因此,对紫藤中丰富的大豆皂苷的化学成分和药理活性的研究仍然具有重要的意义。
紫藤在中国主要作为观赏植物,虽然对紫藤化学成分及药理活性进行多方面的研究,但是对于紫藤成药性方面的研究不够系统,还有很多工作需要深入研究。后续研究可以从以下几方面开展:首先,尽管人们已经从紫藤的不同部位分离得到了149种单体成分,但是对这些成分的成药性研究工作仍然十分匮乏。因此,对该方面的工作的进一步深入细致的研究,将为推动紫藤的临床药用奠定基础。其次,随着科学技术的发展和检测技术的进步,自动化成簇研究复杂样品的化学成分的方法已经在植物化学研究中得到了体现。基于已知化合物结构特征网络化聚类分析结构类似的分子网络化技术具有高效系统地发掘新结构天然产物的能力。因此,借助于现代分析技术对紫藤的复杂化学组成的分析将为全面准确评估紫藤的作为食品和药品的安全性和有效性方面提供化学保障。通过对紫藤的化学成分和药理活性的研究进展进行综述,将为紫藤深入细致的药学和食品学方面的研究提供参考。
