剪切波弹性成像评价VX2肝癌模型兔TACE后瘤周纤维化
2022-08-23何慧洲程芝梅王黎洲
何慧洲,程芝梅,张 帅,王黎洲,李 苒,许 敏,周 石*
(1.贵州医科大学影像学院,贵州 贵阳 550000;2.贵州医科大学附属医院介入放射科国家放射与治疗临床研究中心分中心,贵州 贵阳 550000)
原发性肝癌发病率呈上升趋势[1-2]。肝纤维化与肝癌关系密切,多数肝癌患者有肝纤维化或肝硬化背景,且肝癌发病率随肝硬化程度加重而增加[3]。肝癌患者肿瘤周围肝组织(以下简称瘤周)通常存在广泛纤维化,可能是组织缺氧引起的细胞外基质增多所致,而TACE可进一步加重组织缺氧[4-5]。临床研究[6-7]发现TACE术后肝癌患者肝损伤和肝纤维化程度加重,类似现象亦见于动物模型中[4,8]。DONG等[9]的体外细胞实验结果显示,TACE可活化肝星状细胞,促进纤维化。本研究以超声剪切波弹性成像(shear-wave elastography, SWE)检测肝癌模型兔组织硬度及TACE后瘤周纤维化情况,观察SWE评价肝纤维化的价值。
1 材料与方法
1.1 动物及主要试剂 12只雄性新西兰兔,7~8周龄,体质量(2.55±0.16)kg,购自贵州医科大学动物实验中心[许可证:SYXK(黔)2018-0001],根据动物伦理委员会批准的实验方案进行操作。碘佛醇注射液和罂粟乙碘油注射液(江苏恒瑞医药股份有限公司),吡柔比星(浙江瀚晖制药有限公司),放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer,RIPA)组织/细胞裂解液、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)凝胶和羊抗兔二抗(北京索莱宝公司),胶原Ⅰ抗体(NOVUS biologicals com, USA),胶原Ⅲ抗体(上海爱必信生物科技有限公司),增强型化学发光试剂(enhanced chemiluminescence, ECL)曝光液(江苏亲科生物研究中心有限公司)。
1.2 建立VX2肝癌模型 以迈瑞M6Vet便携式超声仪引导经皮穿刺兔肝左叶,植入VX2肝癌组织块以建立兔VX2肝癌模型,之后以明胶海绵封堵穿刺针道[10]。
1.3 TACE 采用完全随机法将模型兔分为TACE组和Sham组,每组6只。于建模后2~3周采用小动物麻醉机进行诱导麻醉,保定后置于 Siemens MEGALIX Cat Plus 125/20/40/80数字减影血管造影机(digital substraction angiography, DSA)台面,以面罩吸入维持麻醉。剥离右侧股动脉,以导引导管(145-5091-150,Micro Therapeutics Inc)及导丝(M001508110, FATHOMTM-14, Boston Scientific) 行选择性肝固有动脉造影,观察局部肿瘤染色[10-11];之后对TACE组经导管泵入碘化油与2 mg/ml吡柔比星乳剂,至碘油沉积于肿瘤内时结束栓塞,记录栓塞剂用量;对Sham组予生理盐水2 ml。术后观察兔一般状态及有无发热、腹泻、腹股沟区感染等。
1.4 SWE 术前及术后2周采用声科Aixplorer彩色多普勒超声仪,以频率4~15 MHz浅表探头行腹部超声检查,以常规超声观察肿瘤大小,计算肿瘤体积;启动SWE,测量肿瘤、瘤周及肝右叶组织硬度,重复测量3次,取平均值。
1.5 检测血清肝、肾功能指标 术后2周经兔中央耳动脉采血, 3 000 r/min离心10 min,收集血清并保存于-80℃冰箱内,以全自动生化分析仪(Chemray 240,深圳雷杜生命科技有限公司)检测丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、肌酐(creatinine, Cr)及血尿素氮(blood urea nitrogen, BUN)水平。
1.6 病理检查 取血后处死兔并取肿瘤和瘤周组织,行苏木精-伊红(hematoxylin-eosin, HE)染色,观察肝细胞形态;行Masson染色, 根据Metavir评分[6]进行肝纤维化分级,并于显微镜下观察胶原分布及纤维化程度。
1.7 检测蛋白表达 采用Western blot法,以RIPA组织/细胞裂解液提取瘤周肝组织总蛋白,再以SDS-PAGE凝胶电泳分离并转至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF),5%脱脂奶粉室温封闭1 h,加入胶原Ⅰ、胶原Ⅲ和β-actin一抗4℃孵育过夜,室温下与二抗共孵育1 h,以ECL发光液显色后采用凝胶成像系统获取蛋白表达灰度条带,采用ImageJ软件分析条带灰度值。
1.8 统计学分析 采用SPSS 23.0统计分析软件。以±s表示正态分布的计量资料,以成组样本t或校正t(即t’)检验进行组间比较;对计数资料行χ2检验。采用Spearman相关分析评估相关性。P<0.05为差异有统计学意义。
2 结果
12只均建模成功,经股动脉插管行肝动脉造影成功率100%(12/12),见图1。TACE组碘油乳剂用量为0.5~1.2 ml,平均(1.02±0.27)ml。2组术后均未见明显并发症。

图1 肝动脉造影示VX2肝癌兔模型肿瘤富血供,可见“抱球征”(箭)
2.1 常规超声和SWE 术前2组肿瘤体积差异无统计学意义(P>0.05)。术后2周TACE组肿瘤回声不均匀,CDFI未探及明显血流信号;Sham组肿瘤体积明显增大,显著大于TACE组(P=0.03),以低回声为主,CDFI见短条状血流信号。见表1。
表1 超声显示肝癌模型兔肿瘤体积(cm3,±s)

表1 超声显示肝癌模型兔肿瘤体积(cm3,±s)
组别肿瘤体积术前术后2周TACE组2.30±1.313.68±1.67Sham组2.75±1.977.10±2.96t值-0.47-2.47P值0.650.03
术前2组肿瘤、瘤周及肝右叶组织硬度差异均无统计学意义(P均>0.05);术后2周TACE组肿瘤及瘤周硬度均高于Sham组(P均<0.05),见表2、图2。
表2 肝癌模型兔肿瘤、瘤周及肝右叶组织硬度比较(kPa,±s)

表2 肝癌模型兔肿瘤、瘤周及肝右叶组织硬度比较(kPa,±s)
组别肿瘤瘤周肝右叶术前 TACE组44.17±6.998.98±0.906.52±0.84 Sham组45.22±16.588.17±0.905.95±0.97 t值-0.141.561.09 P值0.890.150.30术后2周 TACE组57.48±13.7810.61±0.886.99±0.79 Sham组40.76±2.088.96±0.886.62±0.67 t值2.943.250.89 P值0.02<0.010.40
2.2 血清肝、肾功能指标 术前2组血清ALT、AST、BUN及Cr差异均无统计学意义(P均>0.05);术后2周,TACE组ALT、AST均高于Sham组(P均<0.05),组间BUN、Cr差异均无统计学意义(P均>0.05)。见表3。
表3 肝癌模型兔血清ALT、AST、BUN及Cr比较(±s)

表3 肝癌模型兔血清ALT、AST、BUN及Cr比较(±s)
组别ALT(U/L)AST(U/L)BUN (mg/dL)Cr(μmol/L)术前 TACE组41.08±11.2739.18±12.7820.86±1.8779.82±14.68 Sham组42.47±7.4336.10±8.7019.52±4.8068.84±12.87 t值-0.250.490.641.38 P值0.810.640.540.20术后2周 TACE组130.81±74.51151.20±91.9623.39±6.1676.89±16.07 Sham组54.23±10.4231.70±11.8817.60±2.1270.35±8.41 t值2.493.162.180.88 P值0.030.020.070.40
2.3 病理结果 HE染色显示TACE组瘤周肝细胞水肿明显(图3),Sham组瘤周偶见肝细胞水肿。Masson染色显示TACE组瘤周胶原纤维多于Sham组,瘤周出现条索状纤维束并包绕肿瘤(图4),Metavir分级中位数为F3(F2~3);Sham组见汇管区周围纤维化,Metavir分级中位数为F1(F0~1);TACE组瘤周纤维化程度高于Sham组,差异有统计学意义(Z=3.05,P<0.01)。TACE组胶原Ⅰ和胶原Ⅲ蛋白表达水平均高于Sham组(图5),差异有统计学意义(t=6.78,P<0.01;t=5.92,P<0.01)。

图3 TACE组和Sham组HE染色图(×200) A.TACE组,瘤周肝细胞水肿明显,细胞体积增大,胞质淡染; B.Sham组,瘤周肝细胞形态正常,偶见水肿

图4 TACE组和Sham组Masson染色图(×50) A.TACE组,瘤周出现条索状纤维束,并包绕肿瘤,Metavir分级F3; B.Sham组,汇管区周围纤维化,Metavir分级F1

图5 Western blot法检测瘤周胶原蛋白表达 A.电泳图; B.胶原Ⅰ和胶原Ⅲ蛋白表达量柱状图(**:与Sham组比较,P<0.01)
2.4 相关性分析 Spearman相关性分析结果显示,瘤周肝纤维化Metavir分级与其硬度值呈正相关(r=0.67,P=0.02),见图6。
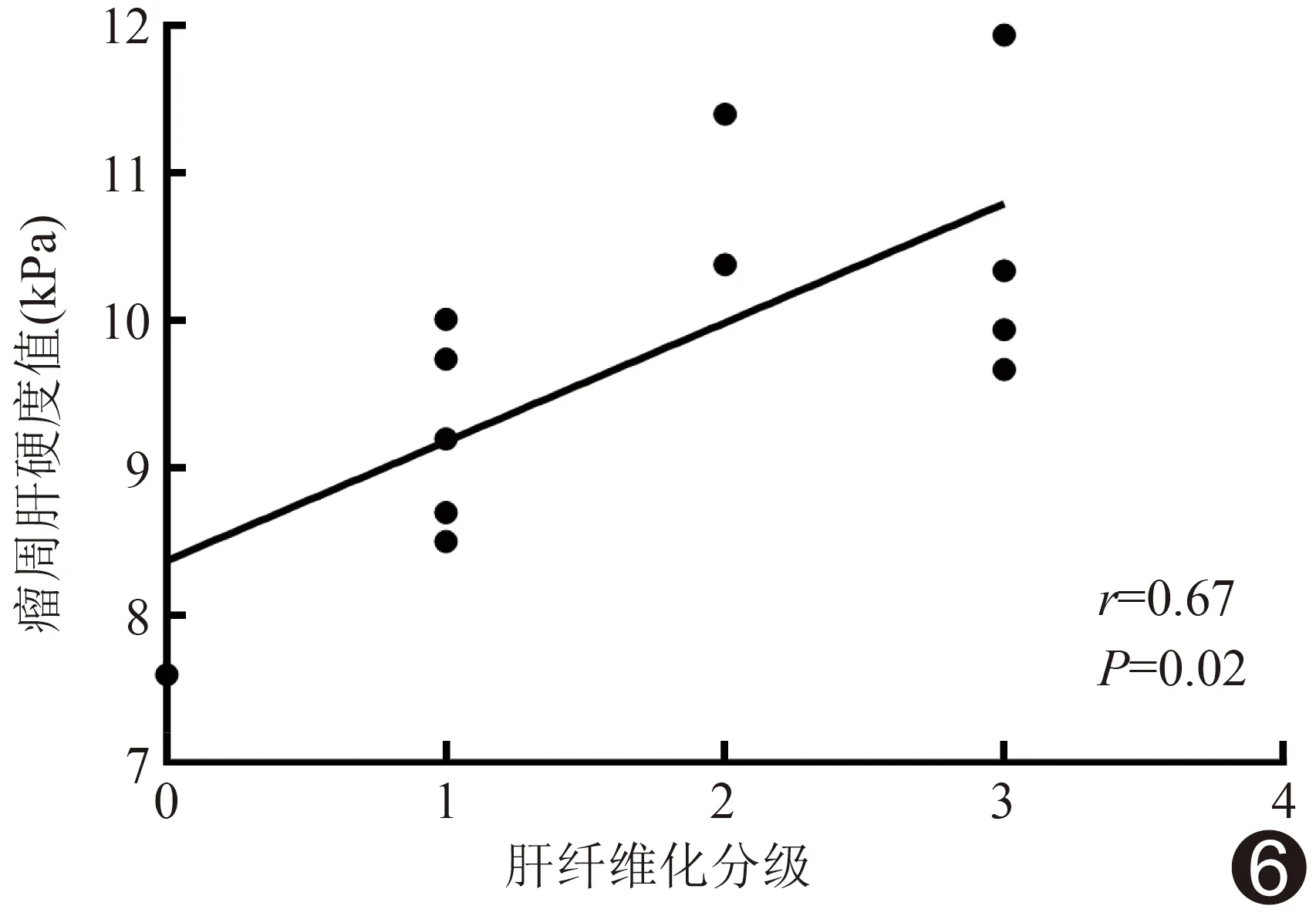
图6 瘤周肝纤维化分级与其硬度值的相关性散点图
3 讨论
临床多数肝癌患者需接受多次TACE治疗。本研究建立兔VX2肝癌移植瘤模型,并以TACE进行治疗,结果显示TACE后肝损伤及瘤周纤维化加重,与既往研究[4,7]结果相符,提示化疗栓塞剂促进肝损伤、加重肝纤维化[7,11]。有学者[12]认为介入治疗后肝纤维化加重可能与预后有关;亦有研究[13]发现肝脏硬度可能影响消融治疗疗效,而肝脏硬度较高是TACE治疗后肝癌早期复发的独立危险因素[14-15]。瘤周层粘连蛋白表达增加可能是TACE后瘤周纤维化程度增加的机制之一[16]。
超声弹性成像是评估组织硬度的常用手段。肝脏硬度与肝纤维化程度相关[17],故SWE可用于评估肝纤维化程度[18]。本研究采用SWE检测VX2肝癌模型兔的肿瘤、瘤周及肝右叶组织硬度,发现术前TACE组与Sham组之间肿瘤、瘤周及肝右叶组织硬度差异均无统计学意义,而术后2周TACE组肿瘤及瘤周硬度均高于Sham组;且TACE组瘤周肝细胞水肿明显,而Sham组偶见肝细胞水肿; TACE组瘤周出现条索状纤维束并包绕肿瘤,其Metavir肝纤维化分级高于Sham组;TACE组胶原Ⅰ和胶原Ⅲ蛋白表达水平均高于Sham组,进一步证实TACE治疗肝癌可加重瘤周纤维化。 Spearman相关性分析结果显示,瘤周肝纤维化Metavir分级与其硬度值呈正相关,提示SWE可用于评价瘤周纤维化。但本研究所示瘤周纤维化Metavir分级与其硬度值的相关系数r略低于既往研究[19](r=0.726),可能与研究对象不同有关:既往研究[19]以SWE评价人肝纤维化,本研究以肝癌模型兔为观察对象,检查时不能配合屏住呼吸,可能影响检测结果。
综上,TACE可加重VX2肝癌模型兔瘤周纤维化;SWE可用于评估其肝纤维化程度。
