蓝激光成像技术联合微探头超声内镜预测早期结直肠癌浸润深度的诊断价值*
2022-08-23莫波杜超乔丽娟杨明陈虹彬徐辉
莫波 杜超 乔丽娟 杨明 陈虹彬 徐辉
(中国人民解放军西部战区总医院消化内科,四川 成都 610083)
结直肠癌(Colorectal cancer,CRC)是世界第三大恶性肿瘤,近年来结直肠癌的发病率和死亡率均呈上升趋势[1-2]。早期CRC即癌组织仅局限于黏膜层或黏膜下层,不论有无淋巴结转移。内镜黏膜切除术(Endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(Endoscopic submucosal dissection,ESD)的发展促进了早期CRC的微创切除[3-5]。不论是淋巴转移,还是血道转移均是结直肠癌的常见情况[6]。在选择微创切除还是外科手术时, 病变是否发生转移是至关重要的因素[7]。深黏膜下层癌(SMD)病变有10%的经淋巴转移的危险,目前认为早期CRC中,黏膜内癌(M)及浅黏膜下层癌(SMs)是内镜下微创切除的适应证[8-11]。因此,明确CRC病变浸润深度,对于选择合适的手术治疗方式至关重要。超声内镜检查(Endoscopic ultrasonography,EUS)能够清晰显示结直肠管壁各层结构,已经被广泛应用于结直肠癌的术前浸润深度评价[12]。而蓝激光成像 (Blue laser imaging,BLI) 内镜是由日本富士公司研发的新型内镜系统,具有更亮、更高的分辨率以及多种观察模式,目前已应用于消化道早期肿瘤的诊断与浸润深度的评价[13]。本研究旨在探索蓝激光成像技术联合微探头超声内镜预测早期结直肠癌浸润深度的诊断价值。
1 资料与方法
1.1 一般资料 回顾性纳入2018年1月~2020年12月在中国人民解放军西部战区总医院经结肠镜及病理明确诊断为早期结直肠癌(CRC)的患者289例,检查结果均由本院消化内科早癌组副高以上医师判定。纳入标准:①活检证实腺癌,包括维也纳分类的第4或第5类[14]。②常规内镜检查诊断为早期CRC,包括黏膜下浸润。③根据巴黎分型定义的隆起病变(有蒂型Ⅰp型、亚蒂型Ⅰsp型和无蒂型Ⅰs型)、扁平病变(0-Ⅱa浅表隆起,0-Ⅱa平坦型,0-Ⅱc浅表凹陷型)[15]以及侧向发育型肿瘤(Laterally Spreading Tumor,LST)。④年龄20~90岁。排除标准:在内镜检查期间有必要肝素化的患者,伴有严重心肺和肾功能不全,并伴有严重的便秘;不能接受内镜检查或手术的衰弱患者。本研究获得医院伦理委员会审核批准,患者及家属均签署知情同意书。
1.2 器械 使用的内镜Fujifilm放大肠镜EG-L590ZW,BLI主机VP-4450,光源XL-4450。内镜超声型号EU M2000,Olympus UM,频率2R-20 MHz。Olympus260肠镜,260主机。
1.3 研究方法
1.3.1 检查方法 BLI检查:患者空腹10 h以上,术前口服2 L聚乙二醇电解质散清洁肠道及二甲硅油散,选择适当体位后,插入蓝激光肠镜寻找记录病变部位、大小、形态,切换成 BLI-bright 模式行远景、近景、低倍放大、高倍放大观察并记录病变部位、腺管开口、血管形态、病变边界、病变大小等。 EUS 检查:充分准备后,插入具有活检孔道的直视内镜于肠道内寻找病灶,并吸尽空气,注入无菌水,插入20 MHz超声微探头,待病变处充盈水后开始扫查,连续多层次扫查病灶及病灶周围区域。 BLI+EUS检查:首先按照上述方法行BLI检查,留取图像对浸润深度进行判断随后用水充盈法对病变进行EUS检查,最后留取超声图像并对浸润深度进行判断。当患者出现蓝激光成像与超声检查诊断结果不一致时,由两名高年资内镜医师进行商议,最终形成一致意见。
1.3.2 主观感受的判断 自行制定的判断标准:由患者本人对检查的可耐受性打分,耐受程度最差为1分, 最好为10分,结果由专人统计。
1.3.3 检查时间 所有患者肠镜到达病灶后,开始行蓝激光或超声内镜检查开始计时,直至检查结束,结果由专人统计。
1.3.4 判断标准 BLI诊断标准:根据工藤的pit pattern分型,使用了五个模式,包括Ⅰ型(圆点状腺管开口),Ⅱ型(星芒状或乳头状开口),非肿瘤型,Ⅲs型(小圆点状或管状,比正常小),ⅢL型(略圆或管状,比正常大),Ⅳ型(规则树枝状),Ⅴi型(不规则腺管开口),ⅤN型(无腺窝结构)[16]。据最近的报道,边缘高度不整,内腔高度不一,轮廓不清,抓痕征,间质征,被定义为高度不整Ⅴi型(Ⅴi-H),无这些特征的Ⅴi型被定义为轻度不整Ⅴi型(Ⅴi-L)。Ⅲs型、ⅢL型、Ⅳ型有规则的腺窝,临床上将Ⅴi-L定义为M-SMs浸润深度,Ⅴi-H和ⅤN型定义为SMD[17-18]。EUS诊断标准:结直肠管壁在高频超声探头下可以清晰地显示出5层结构,根据回声的不同由里向外依次为第一层高回声层—黏膜浅层;第二层低回声层—黏膜肌层;第三层高回声层—黏膜下层;第四层低回声层—固有肌层;第五层高回声层—外膜层。根据回声高低均匀情况、各层分界是否清晰、各层是否中断综合判断病变累及层次。根据Cho等[19]的modified分型,早期CRC的EUS成像分为M-SMs和SMD,第一层和第二层范围内的低回声肿块和第三层上层的轻微不规则定义为M-SMs癌,明显侵入并渗透到第三层的低回声肿块被定义为SMD癌。典型病例图见图1~4。

图1 蓝激光成像 pit pattern分型Vi-L型 SMs

图2 蓝激光成像 pit pattern分型Vi-H型 SMD

图3 微探头超声内镜检查 SMs

图4 微探头超声内镜检查 SMD
1.3.5 病理学方法 根据中国早期结直肠癌筛查及内镜诊治指南,对患者进行EMR、ESD或手术切除。切除标本固定在福尔马林中,切片成2 mm厚包埋在石蜡中,每个切片由本院的病理学家根据日本结直肠癌研究会的指南和维也纳分类进行组织学类型和浸润深度的评估[14]。根据日本结直肠癌研究会的指南[9],从黏膜肌层到最深的癌症区域,以微米为单位测量垂直黏膜下浸润深度,黏膜下浸润深度<1000 μm被定义为pSMs,黏膜下浸润深度≥1000 μm定义为pSMD。最后的组织学诊断在本研究作为诊断的标准。

2 结果
2.1 基本资料 本研究共纳入符合上述标准的患者289例,均为单发病变,其中女性144 例,男性145例,年龄在 39~84岁,平均(61±9.9)岁。其中BLI组108例、EUS组96例、BLI+EUS组85例。289例结直肠癌部位分别为直肠、乙状结肠、降结肠、横结肠、升结肠。根据 BLI及EUS结果判别病变浸润深度,决定治疗方案。最后289 例行 ESD治疗,完全切除283例,水平切缘及垂直切缘均阴性,3例脉管浸润、3例垂直切缘阳性、1例垂直及水平切缘均累及,追加外科手术。3组患者的性别、年龄、病灶大小、病变大体形态、病变部位、病理诊断结果比较差异无统计学意义(P>0.05),见表1。
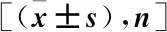
表1 入组患者基础资料比较
2.2 不同内镜检查方法所用时间与患者主观感受的比较 BLI检查所用时间明显少于EUS检查,而患者主观感受则明显优于EUS检查,见表2。
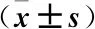
表2 不同内镜检查所用时间与患者主观感受评分结果分析
2.3 不同内镜诊断结果与病理结果的比较 BLI、EUS、BLI+EUS与病理诊断一致的病例分别为80.5%(87/108)、79.1%(76/96)和88.2%(75/85),Kappa 值分别为0.576、0.574和0.761。BLI+EUS与病理诊断一致性较好(Kappa>0.6)。不同内镜下的具体诊断效能结果见表3。

表3 3组患者内镜分期诊断结果与病理诊断分期结果比较
2.4 一致组与非一致组基线特征比较结果 将289例患者分为一致组(内镜诊断结果与病理诊断结果一致)与非一致组(内镜诊断结果与病理诊断结果不一致),将两组患者性别、年龄、大体形态、病变部位、病变大小、病灶浸润深度等方面进行单因素分析,结果显示,性别、病变部位在两组间比较差异无统计学意义(P>0.05);年龄、大体形态、病灶大小以及浸润深度在两组间比较差异具有统计学意义(P<0.05),见表4。

表4 一致组与非一致组基线结果比较
3 讨论
近年来随着内镜技术的不断发展,因其具备创伤小、并发症少、疗效佳等优势而受到临床的广泛应用,当前手术治疗早期结直肠癌中主要以EMR与ESD术为主[20]。如果无蒂CRC诊断为浸润深度在SMs以内,即使是一个大的肿瘤也可以通过内镜治疗,如ESD[21-22]。通常认为LGIN、HGIN、SMs通常建议采用全瘤ESD或EMR进行全切,并利用组织学诊断评判淋巴结转移的风险分级及治愈的可能性[23]。由于SMD可能有淋巴结转移的风险,多行外科手术治疗。因此,术前准确的评估肿瘤浸润深度非常重要,可以有效预防内镜下治疗术后残余肿瘤,避免额外追加手术。
放大色素内镜检查(Magnifying chromoendoscopy,MC)及EUS是目前判断早期CRC浸润深度的主要诊断工具,其中超声内镜评估结肠病变浸润深度和淋巴结转移概率已被广泛认可。EUS通过消化道壁的断层扫描来诊断浸润深度,通常使用20 MHz的高频微型探头来判断进入消化壁的深度,CRC被描述为EUS上的低回声区域,填充第三层(黏膜下层)的低回声肿块提示深层黏膜下浸润(浸润深度≥1000 μm)。2012年富士公司在日本正式推出蓝激光内镜(LASEREO)系统。LASEREO内镜系统一改过去惯用的卤素灯或氙气灯光源,蓝激光成像技术(blue laser imaging,BLI)采用两种不同波长的激光,白光用波长450 nm激光及BLI用波长410 nm激光,BLI用激光的波长短,光谱窄,呈现的窄带光图像能够突出黏膜表层的微血管及微结构的对比,从而实现对病变细微结构的观察。BLI在用于早期结直肠疾病中也是很有益处的,可以结合已有的内镜下分型进行内镜下组织病理诊断[13]。而BLI作为新型的电子MC技术,对CRC浸润深度的诊断有一定价值。
既往有两项前瞻性研究将MC与EUS预测CRC的浸润深度进行比较,结果均显示EUS始终优于MC(91.8%vs63.3%,P=0.0013;93%vs59%,P<0.001)[24-25],对浸润深度的诊断有较高的准确性。然而,这些研究有以下问题:首先,MC的SMD定义与本研究的定义略有不同;其次,在这两项研究中,由于在MC之后进行EUS,所以EUS比MC获得的信息多。另有回顾性研究比较MC与EUS对CRC浸润深度的影响,准确度相似(EUS:MC,75%vs87%,P=0.0985,EUS:MC,82.1%vs81%,P=0.7785)[26]。目前将BLI联合EUS对早期结直肠癌浸润深度测量效果进行研究的文献还较少,本研究通过分析289例早期CRC患者289处病灶,BLI联合EUS检查组诊断结果显示,相比于只行BLI检查,分期不当减少11例,其中低估减少7例,高估减少4例。对M-SMs、SMD及总体分期准确率分别由84.2%、73.6%、80.5%提升至91.4%、84.2%、88.2%。相比于只行EUS检查,分期不当减少10例,其中低估减少7例,高估减少3例。提示BLI-ME联合EUS检查较单独采用两种检查对早期结直肠癌浸润深度的预测有着更高的准确率。蓝激光成像技术、微探头超声内镜检查、蓝激光成像技术联合微探头超声内镜组与病理诊断一致的病例分别为80.5%(87/108)、79.1%(76/96)、88.2%(75/85)相较于蓝激光成像技术检查与病理诊断的一致性(Kappa=0.576),以及超声内镜检查与病理诊断的一致性(Kappa=0.574),蓝激光成像技术联合超声内镜检查与病理诊断的一致性较好(Kappa=0.761)。将289例患者按照内镜诊断结果与病理诊断结果是否一致,其中238例患者内镜结果一致,51例患者非一致,单因素结果分析显示两组患者年龄、大体形态、病灶大小以及浸润深度在两组间差异具有统计学意义(P<0.05)。提示BLI联合EUS检查较单独采用两种检查对早期结直肠癌浸润深度的预测有着更高的准确率。但蓝激光成像技术所用时间明显缩短(P<0.05),且患者主观感受明显优于超声内镜检查。
随着近年来临床工作者对于结直肠癌前病变及早期结直肠癌镜下诊断认识的逐步提高,同时检查仪器性能不断增强,多种新型内镜技术的诞生对微细结构的放大倍数日益增加能更加清晰的显示肠道微结构及微血管的变化情况,使得我们在病变早期就能准确诊断出来,并对其进行干预治疗,提高了结直肠癌患者的生存率。在今后的临床及科研工作中,我们可从以下方面来提高早期结直肠癌的诊断率,提高消化内镜医师对癌前病变及早期结直肠癌疾病的认识:①平素多参与内镜医师培训相关知识或至上级医院进修以提高对上述疾病的诊断能力。②在做肠镜、色素放大内镜、超声内镜等检查之前严格按照要求做好充足的肠道清洁,以利于术中详细观察病变,得到清晰的内镜图片,提高病变的诊断准确率。③在常规结肠镜检查时,可按照普通结肠镜、BLI、EUS的顺序安排检查,以评估病灶及浸润深度,从而指导下一步治疗,避免医疗资源浪费,取得最佳效果。
4 结论
蓝激光成像技术联合微探头超声内镜检查更加有助于预测早期结直肠癌病灶的浸润深度,具有准确率高的特点,从而能更好地指导治疗,体现了其在早期结直肠癌病变诊断中的优势,可在临床进一步推广应用。
