HtrA1基因敲除对小鼠葡萄糖代谢及胰岛功能的影响
2022-08-19高新雨倪嘉成白宁宁高琼媚李华婷方启晨
高新雨 倪嘉成 白宁宁 张 菁 高琼媚 李华婷 杨 颖 方启晨
随着人民物质生活水平的提高,2型糖尿病患病率逐年增高[1]。胰岛素分泌缺陷和胰岛素敏感性减低是2型糖尿病发病的重要病理生理机制,其中胰岛β细胞功能障碍为糖尿病发病的关键环节[2]。胰岛是分布于胰外分泌部腺泡间的一种内分泌细胞团,高度血管化是其主要特征之一。胰岛毛细血管为胰岛提供充足的营养和氧气,完善的血管功能维持对胰岛存活和功能发挥起着极其重要的作用[3]。HtrA1(high temperature requirement protease A1)是一种在生物体各种组织中普遍存在的具有分泌特性的丝氨酸蛋白酶[4],近年的研究发现其参与血管结构[5]及新生调控[6]。鉴于胰岛血供对胰岛功能维持的重要性,推测HtrA1缺失可能会对胰岛功能产生影响。本研究旨在探讨HtrA1基因敲除是否会影响小鼠胰岛功能及糖代谢。
1 材料与方法
1.1 实验材料
1.1.1 动物饲养 C57BL/6J背景的HtrA1基因敲除小鼠购自日本Chio Oka教授实验室(Nara Institute of Science and Technology),于上海骏实实业有限公司无特定病原体(specific pathogen free,SPF)级动物房中进行繁殖培育。小鼠自由饮水和饮食,饲养环境温度为22~24 ℃,维持12 h亮暗交替周期。本研究中涉及的动物实验均已通过上海交通大学附属第六人民医院动物福利与伦理委员会的批准(伦理号为2017-0159)。
1.1.2 基因鉴定 小鼠2周龄时,提取鼠尾基因组DNA进行基因鉴定,提取试剂盒购自南京诺唯赞生物科技有限公司。HtrA1基因鉴定PCR引物序列:野生型(wild type,WT)上游引物为5’-ACG CTC CTG TCT TTG CTA CT-3’,下游引物为5’-TGT GCA CGC CGT CGT ACT GT-3’;HtrA1基因敲除型上游引物为5’-AAT GGG CTG ACC GCT TCC TCG TGC TT-3’,下游引物为5’-TGT GCA CGC CGT CGT ACT GT-3’。PCR产物片段长度分别为299bp和665bp。
1.2 小鼠实验 取6周龄雄性野生型小鼠(WT小鼠)和HtrA1基因敲除小鼠(KO小鼠),按照同窝随机对照原则分组,分别给予高脂饮食(脂肪占总热量的60%,货号为D1233,由美国Research Diets公司提供)或普脂饮食(脂肪占总热量的5%,由上海斯莱克实验动物有限公司提供)。记录喂养16周(22周龄小鼠)时,普脂饮食组及高脂饮食组WT小鼠(均为6只)、KO小鼠(均为5只)的体重,以及喂养期间摄食量,以观察HtrA1基因敲除对小鼠体重的影响。
1.3 腹腔内注射葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT) 18周龄(普脂或高脂喂养12周)小鼠(普脂饮食组WT、KO小鼠各7只,高脂饮食WT小鼠6只、KO小鼠7只)禁食、不禁水12 h后,腹腔内注射葡萄糖(2 g/kg,上海信谊金朱药业有限公司),分别于空腹及注射后10、20、30、45、60、90、120 min取尾静脉血,应用ACCU-CHEK Performa血糖仪[罗氏诊断产品(上海)有限公司]检测血糖水平。
1.4 葡萄糖刺激胰岛素分泌(glucose stimulates insulin secretion,GSIS)试验 18周龄(普脂或高脂喂养12周)小鼠(WT小鼠、KO小鼠各5只)禁食、不禁水12 h后,采集空腹尾静脉血,采用ELISA法(ELISA试剂盒由香港大学提供)检测空腹胰岛素水平。进一步对21周龄(高脂喂养15周)小鼠(WT小鼠、KO小鼠各4只)进行GSIS试验,小鼠禁食、不禁水12 h后,腹腔内注射葡萄糖(3 g/kg,上海信谊金朱药业有限公司),分别于空腹及注射后15、30 min时行小鼠尾尖采血,分离血浆冻存。采用ELISA法(ELISA试剂盒由香港大学提供)检测胰岛素水平。
1.5 胰岛分离及GSIS试验 为进一步证实HtrA1基因敲除对胰岛细胞的影响,分离小鼠胰岛在细胞水平行GSIS试验,采用颈椎脱臼法处死普脂饮食组小鼠(WT小鼠、KO小鼠各3只),于胆总管近端缓慢注入0.25 mg/mL胶原酶(美国Sigma公司)溶液5 mL,使胰腺充分膨胀后迅速将其摘除,置于体式显微镜下挑取胰岛,以10个胰岛细胞/孔接种于24孔板,棕榈酸0.5 mmol/L(美国Sigma公司)处理24 h后,以含2.8 mmol/L葡萄糖的Kerbs-Ringer缓冲液(KRB平衡液)饥饿处理1 h,弃培养基,PBS液洗涤2次,加入含有2.8 mmol/L、20 mmol/L葡萄糖的KRB平衡液(上海信谊金朱药业有限公司)孵育1 h,收集上清液,测定胰岛素水平。
1.6 胰腺组织免疫荧光染色 取22周龄(高脂喂养16周)小鼠胰腺组织(WT小鼠、KO小鼠各3只),以4%多聚甲醛溶液固定、石蜡包埋等处理后行组织切片。将胰腺切片与鼠抗胰岛素一抗(1∶200稀释,武汉赛维尔生物科技有限公司)、兔抗胰高血糖素一抗(1∶200稀释,武汉赛维尔生物科技有限公司)于4 ℃孵育过夜,之后与连接荧光基团的488-山羊抗小鼠二抗(1∶400稀释,武汉赛维尔生物科技有限公司)、CY3-山羊抗兔二抗(1∶400稀释,武汉赛维尔生物科技有限公司)孵育进行胰岛素(绿色)和胰高血糖素(红色)免疫荧光双染。将胰腺切片与鼠抗胰岛素一抗(1∶200稀释,武汉赛维尔生物科技有限公司)和兔抗CD31一抗(1∶200稀释,武汉赛维尔生物科技有限公司)于4 ℃孵育过夜,之后与连接荧光基团的488-山羊抗小鼠二抗(1∶400稀释,武汉赛维尔生物科技有限公司)和CY3-山羊抗兔二抗(1∶400稀释,武汉赛维尔生物科技有限公司)孵育进行胰岛素(绿色)和CD31(红色)免疫荧光双染。应用Zeiss Axio-Imager荧光显微镜(德国卡尔蔡司公司)摄片,采集物镜(×20)下图像。应用ZEN 2.0软件(德国卡尔蔡司公司)参照Pysz等[7]的方法对胰岛中CD31水平进行定量,比较胰岛中CD31的平均荧光强度,以荧光密度与胰岛面积之比表示。
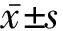
2 结 果
2.1 两组KO小鼠与WT小鼠的体重和喂养期间摄食量比较 高脂饮食组WT和KO小鼠的体重分别为(44.27±3.29)、(43.34±3.14) g,摄食量分别为(19.33±1.36)、(19.43±1.36) g;普脂饮食组WT和KO小鼠的体重分别为(31.45±2.24)、(29.54±1.67) g,摄食量分别为(24.49±5.01)、(21.50±3.07) g。高脂饮食组或普脂饮食组的KO与WT小鼠的体重和摄食量的差异均无统计学意义(P值均>0.05)。
2.2 两组KO小鼠与WT小鼠IPGTT结果比较 普脂饮食组KO小鼠糖负荷10、20、120 min时的血糖水平显著高于同组WT小鼠(P值均<0.05),空腹血糖及糖负荷后30、45、60、90 min时的血糖水平与同组WT小鼠的差异均无统计学意义(P值均>0.05)。高脂饮食组KO小鼠糖负荷10、20、30、45 min时血糖水平均显著高于同组WT小鼠(P值均<0.05),空腹血糖及糖负荷后60、90、120 min时血糖水平与同组WT小鼠的差异均无统计学意义(P值均>0.05)。见表1。
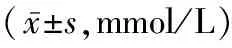
表1 高脂饮食组和普脂饮食组WT小鼠与KO小鼠糖负荷各时间点血糖水平的比较
2.3 KO小鼠与WT小鼠空腹胰岛素水平和GSIS试验结果比较 18周龄高脂饮食组KO小鼠和WT小鼠的空腹胰岛素水平分别为(0.58±0.05)、(1.34±0.21) mmol/L,普脂饮食组的空腹胰岛素水平分别为(0.53±0.08)、(0.51±0.04) mmol/L,普脂饮食组WT小鼠与KO小鼠空腹胰岛素水平的差异无统计学意义(P>0.05),高脂饮食组KO小鼠空腹胰岛素水平显著低于WT小鼠(P<0.05)。21周龄高脂饮食组空腹及注射葡萄糖后15 min时KO小鼠的胰岛素水平均显著低于WT小鼠(P值均<0.05),KO小鼠与WT小鼠注射葡萄糖后30 min时胰岛素水平的差异无统计学意义(P>0.05)。见表2。
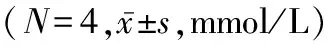
表2 高脂饮食组WT小鼠与KO小鼠空腹和注射后15、30 min时胰岛素水平的比较
2.4 KO小鼠与WT小鼠胰岛细胞GSIS试验结果比较 高糖刺激(20 mmol/L葡萄糖)后,KO小鼠和WT小鼠胰岛细胞的胰岛素分泌水平分别增高为相应基础水平(2.8 mmol/L葡萄糖)的(3.36±0.24)、(5.90±1.53)倍,经高糖刺激的KO小鼠胰岛细胞的胰岛素分泌能力显著低于WT小鼠(P<0.05)。
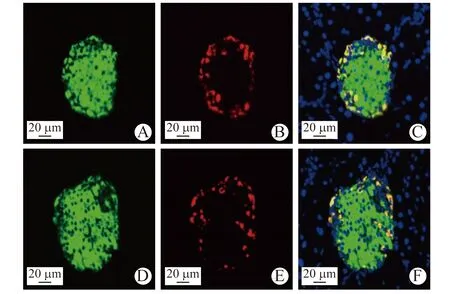
2.5 高脂饮食组WT小鼠与KO小鼠免疫荧光染色结果比较 高脂饮食组小鼠胰岛组织胰岛素、胰高血糖素染色结果显示,KO小鼠与WT小鼠间胰岛结构完整性及胰高血糖素表达均无明显差异。见图1。 高脂饮食组KO小鼠与WT小鼠胰岛内CD31平均荧光强度分别为(1.71±1.07)、(3.28±1.59) AU,高脂饮食组KO小鼠胰岛内CD31表达水平显著低于同组WT小鼠(P<0.05)。见图2。
A WT小鼠胰岛组织胰岛素 B WT小鼠胰岛组织胰高血糖素 C WT小鼠胰岛组织胰岛素与胰高血糖素Merge图像 D KO小鼠胰岛组织胰岛素 E KO小鼠胰岛组织胰高血糖素 F KO小鼠胰岛组织胰岛素与胰高血糖素Merge图像图1 WT小鼠与KO小鼠胰岛组织胰岛素和胰高血糖素免疫荧光双染(×200)
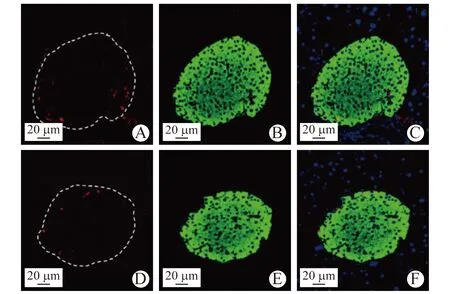
A WT小鼠胰岛组织CD31 B WT小鼠胰岛组织胰岛素 C WT小鼠胰岛组织CD31与胰岛素Merge图像 D KO小鼠胰岛组织CD31 E KO小鼠胰岛组织胰岛素 F KO小鼠胰岛组织CD31与胰岛素Merge图像图2 WT小鼠与KO小鼠胰岛组织胰岛素和CD31免疫荧光双染(×200)
3 讨 论
HtrA1基因编码一个由480个氨基酸组成的多肽,相对分子质量约为50 000 Da[8],最初在大肠杆菌中被发现[9],广泛存在于各种微生物和哺乳动物体内,人与小鼠间高度同源,在大多数组织中均有表达[10]。近年研究发现,HtrA1参与血管结构和新生的调控。2006年Dewan等[11]研究发现,HtrA1启动子变异致HtrA1基因表达上调与年龄相关性黄斑变性的发病密切相关,其特点为色素上皮层下血管新生活跃。2011年Jones等[6]研究发现,HtrA1 转基因过表达小鼠视网膜及脉络膜中血管内皮生长因子(vascular endothelial growth factor,VEGF)表达明显上调,并表现出脉络膜新生血管形成活跃。相反,Hasan等[12]报道HtrA1基因敲除导致母鼠血管重构缺陷,引起胎盘发育不良和胚胎子宫内生长迟缓,最终可能引发先兆子痫;CARASIL病是一种人类缺血性脑小血管疾病,其主要的发病原因是HtrA1基因突变导致蛋白功能低下,引发血管结构发生变化所致[13]。以上研究结果提示,缺乏或者过量的HtrA1均可导致血管生成异常,而适宜水平的HtrA1对正常血管的生长发育及功能维持是必需的。另有研究[14]发现,HtrA1基因缺失导致血管生成减少伴VEGF表达下调。VEGF又称血管通透因子(vascular permeability factor,VPF),是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移和增殖、血管形成等作用[15]。CD31又称为血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31),在内皮细胞间连接处高表达[16],为微血管内皮细胞的标志物[17],参与调节微血管内皮细胞间的连接稳定性及完整性[18]。以往研究[19]发现,糖尿病胰岛微血管内皮细胞受损主要表现为线粒体超微结构异常及CD31表达异常。研究[20]证实,胰岛细胞功能紊乱是糖尿病进展的根本机制,胰岛微血管内皮细胞参与构成的胰岛微循环对于维持胰岛β细胞功能至关重要[21-22]。因此,HtrA1基因可能通过VEGF调控胰岛微血管内皮细胞影响胰岛细胞功能,进而影响全身糖代谢。
本研究IPGTT结果显示,普脂饮食组KO小鼠糖负荷10、20、120 min时的血糖水平显著高于同组WT小鼠,高脂饮食组KO小鼠糖负荷10、20、30、45 min时的血糖水平均显著高于同组WT小鼠;GSIS试验结果显示,高脂饮食组空腹、注射葡萄糖后15 min时KO小鼠的胰岛素水平显著低于WT小鼠,经高糖刺激的KO小鼠胰岛细胞的胰岛素分泌能力显著低于WT小鼠。上述结果显示,HtrA1基因敲除损害小鼠葡萄糖耐量,且降低高脂喂养条件下基础胰岛素水平和葡萄糖刺激下胰岛素分泌,表明HtrA1基因敲除损害了小鼠胰岛功能。本研究结果显示,高脂饮食组KO小鼠胰岛内CD31表达水平显著低于同组WT小鼠,提示HtrA1基因可能通过VEGF调控胰岛细胞血管微循环,直接影响胰岛细胞功能,进而影响全身糖代谢。然而,HtrA1基因是否通过VEGF和(或)其他因素调控胰岛微血管内皮细胞影响胰岛功能、调控的具体机制,以及HtrA1基因对胰岛微循环的影响是否同样存在于人类尚需进一步研究。由于HtrA1基因参与组织血管功能的调控,除外胰腺组织外,HtrA1基因敲除可能会影响其他血供丰富组织,尤其是胰岛素作用靶组织的功能,尚待进一步研究探讨。
综上所述,HtrA1作为一种丝氨酸蛋白酶,其可能通过调控胰岛微循环参与调控胰岛细胞功能及全身的糖代谢。HtrA1基因敲除可导致小鼠机体糖代谢紊乱及胰岛功能异常,其机制可能与胰岛细胞血管功能有关。本研究结果为深入了解HtrA1在胰岛功能中的作用,探讨糖尿病预防新靶点开发奠定了一定的基础。
