基于临床、影像组学和计算机视觉特征鉴别肺鳞癌和腺癌
2022-08-19方家杨梁长宇陶俊利尹柯陈博辉王振宇张久权
方家杨,梁长宇,陶俊利,尹柯,陈博辉,王振宇,张久权
重庆大学附属肿瘤医院影像科,重庆 400030;*通信作者 张久权 zhangjq_radiol@foxmail.com
肺癌是全球发病率最高的恶性肿瘤,其癌症相关死亡率居第一位[1]。非小细胞肺癌占肺癌的80%~85%,主要包括鳞癌和腺癌。腺癌多为周围型,常见于不吸烟的女性;鳞癌多为中央型,常见于吸烟男性[2]。腺癌比鳞癌的治疗方式更多,但比鳞癌更易发生脑转移[3-4]。病理学检查是确诊腺癌和鳞癌的“金标准”,需要通过穿刺或手术获得组织学标本,该方法有创、受限于肿瘤的特异性,且在某些情况下不能进行。
目前CT常规用于肺癌的临床诊断、放疗计划和疗效评估[5]。传统的影像学特征对肺癌病理分型提供的信息有限,随着影像组学的发展,对肿瘤的影像评估已从定性特征转变为定量特征[6]。影像组学可以从影像图片中提取高通量的定量信息,但这些特征是表浅的,易受噪声和低阶的影响;而计算机视觉(computer vision,CV)特征旋转不变,且对噪声不敏感[7]。
目前有少量研究利用影像组学和纹理分析预测肺癌的病理类型[8-10],但其预测性能不能完全令人满意。本研究使用临床特征、影像组学特征和CV特征建立鉴别肺鳞癌和腺癌的模型,以期为非侵入性的表征肺鳞癌和肺腺癌提供思路。
1 资料与方法
1.1 研究对象 回顾性纳入2012年3月—2019年10月于重庆大学附属肿瘤医院就诊的肺癌患者578例,其中女166例,男412例;年龄50.2~72.8岁;腺癌431例,鳞癌147例。纳入标准:①病理诊断明确;②进行治疗前在影像存储与传输系统上有层厚≤1 mm的增强CT图像以及完整的临床资料。排除CT图像上肺癌病灶与邻近的阻塞性肺炎或肺不张组织难以区分者。本研究经过本院伦理委员会批准(CZLS2021182-A),豁免患者知情同意书。
1.2 CT检查 采用32排CT(Somatom GO UP)或64排CT(Philips Brilliance)进行标准胸部增强扫描。扫描范围从肺尖到肾上腺,扫描过程中患者屏住呼吸。动脉期扫描在注射对比剂(碘佛醇,320 mg/ml,江苏恒瑞制药)后15 s进行。经肘前静脉注射对比剂,剂量1.5 ml/kg,速度2.5~3.0 ml/s。扫描参数:管电压120~130 kV;管电流54~200 mAs;层厚0.8~1.0 mm;层间距0.5~0.7 mm;矩阵512×512;卷积核B40,standard(B)。
1.3 图像分割与体征提取 由1名具有10年放射诊断经验的主治医师在增强图像的肺窗上逐层进行肿块勾画(窗宽1 500 Hu,窗位-600 Hu),不包括气管、血管、坏死及钙化等(图1)。所有图像处理及特征提取过程均由内部软件根据IBSI参考手册进行标准化[11]。采用最大-最小尺度算法将所有CT图像归一化到相同的尺度范围。最终提取1 589个影像组学特征,包括形态学特征、局部强度特征、基于强度的统计特征、强度直方图特征、强度体积直方图特征、灰度共生矩阵特征(gray level co-occurrence matrix,GLCM)、灰度运行长度矩阵特征(gray level run length matrix,GLRLM)、灰度大小区域矩阵特征(gray level size zone matrix,GLSZM)、灰度距离区域矩阵特征、邻域灰度差分矩阵特征和邻域灰度依赖矩阵特征。从分割的图像中提取的CV特征包括有向梯度直方图特征(histogram of oriented gradients,HOG)、haar样特征(HAAR)、局部二值模型特征(local binary pattern,LB)和加速鲁棒特征。所有4 806个CV特征均在Python 3.7上计算得到。随机选取80例患者的图像,由同一名医师和另一名具有8年影像诊断经验的主治医师1个月后重新逐层勾画肿瘤,计算观察者内和观察者间相关系数(ICC),以判断观察者内和观察者间所获取特征的一致性。ICC>0.75代表一致性较好。

图1 肺癌患者CT图像病灶勾画
1.4 特征筛选与模型构建 所有患者按3∶1随机分为训练组434例和验证组144例。训练组的特征选择采用由粗到细的策略。采用Mann-WhitneyU检验或t检验选出能区分鳞癌和腺癌的稳健特征。所有特征根据其P值按升序排列,并选出前5%的特征。然后计算每对特征的Pearson相关系数,保留|r|>0.85和P值较小的特征。最后利用基于随机森林的Boruta算法检测关键特征进行鳞腺癌预测。选取SGD对主要特征构建模型。利用影像组学特征构建模型1,将CV特征加入模型1形成模型2,将所有临床资料加上radiomics-score(R-score)及CV-score形成模型3。采用5折交叉验证确定模型参数。各模型性能在验证组进行验证。
1.5 统计学分析 使用SPSS 20.0软件,计量资料以±s表示,组间比较采用独立样本t检验;计数资料用比例和百分比表示,组间比较采用χ2检验。采用受试者工作特征(ROC)曲线评价各模型的预测性能,采用Delong检验评价曲线下面积(AUC)的差异。ROC曲线和Delong检验在Python 3.7.7和R 4.0.3上进行。决策曲线用于评价模型的临床价值。为了给临床提供预测的定量工具,在预测性能最好的模型的训练组中建立诺模图,并在验证组进行验证。用校正曲线和Hosmer-Lemeshow检验评价诺模图的校正。最后通过回归分析得到校正曲线。P<0.05为差异有统计学意义。
2 结果
2.1 患者基本情况 训练组和验证组患者基本临床资料差异均无统计学意义(P>0.05),两组患者的基本资料见表1、2。

表1 训练组和验证组肺癌患者基本资料组内比较
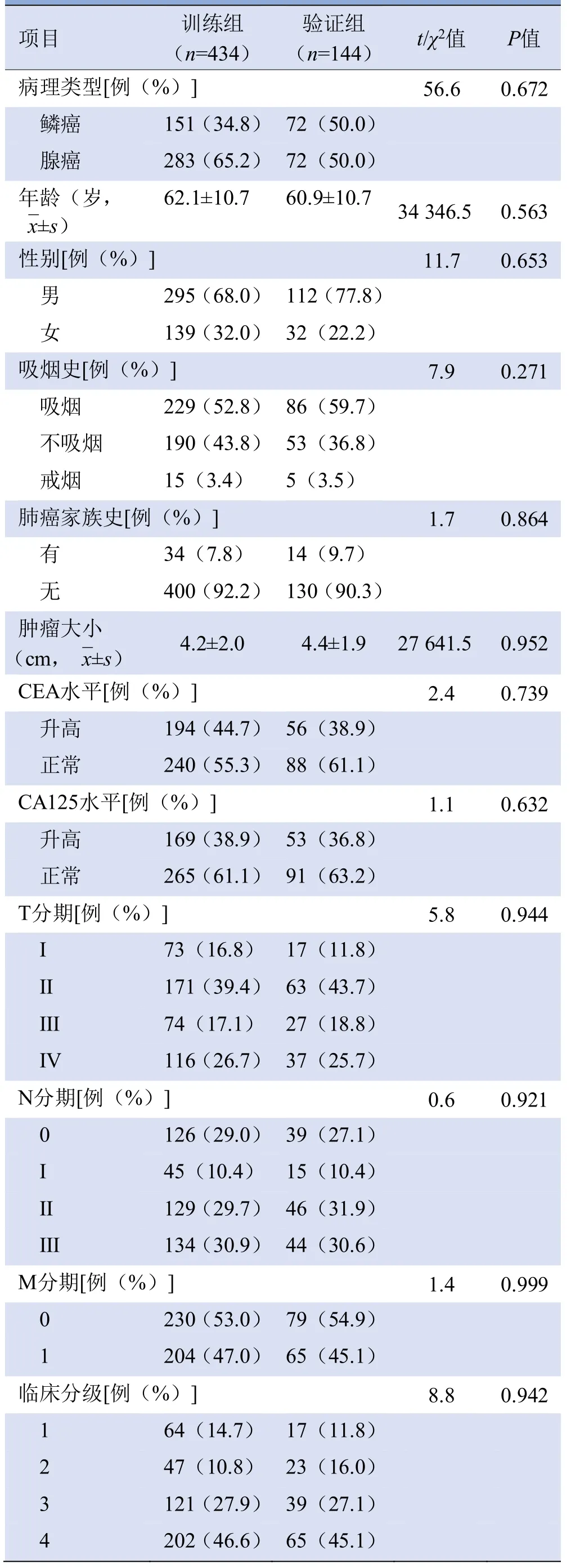
表2 训练组和验证组肺癌患者基本资料组间比较
2.2 观察者间和观察者内一致性 观察者间及观察者内的一致性均较好(ICC=0.80、0.85)。
2.3 模型建立与验证 主要的8个影像组学特征及16个CV特征见表3。3个预测模型的敏感度、特异度、准确度和AUC值见表4,ROC曲线见图2。在训练组和验证组中,Delong检验示模型3的AUC值均显著高于模型1和模型2(P≤0.04)。在训练组中,模型2的AUC值显著高于模型1(P<0.01),在验证组中,模型2的AUC高于1模型,但两者差异无统计学意义(P=0.47)。

图2 3种模型预测肺鳞癌和腺癌准确度的ROC曲线。A、B分别为训练组和验证组

表3 主要影像组学特征和CV特征
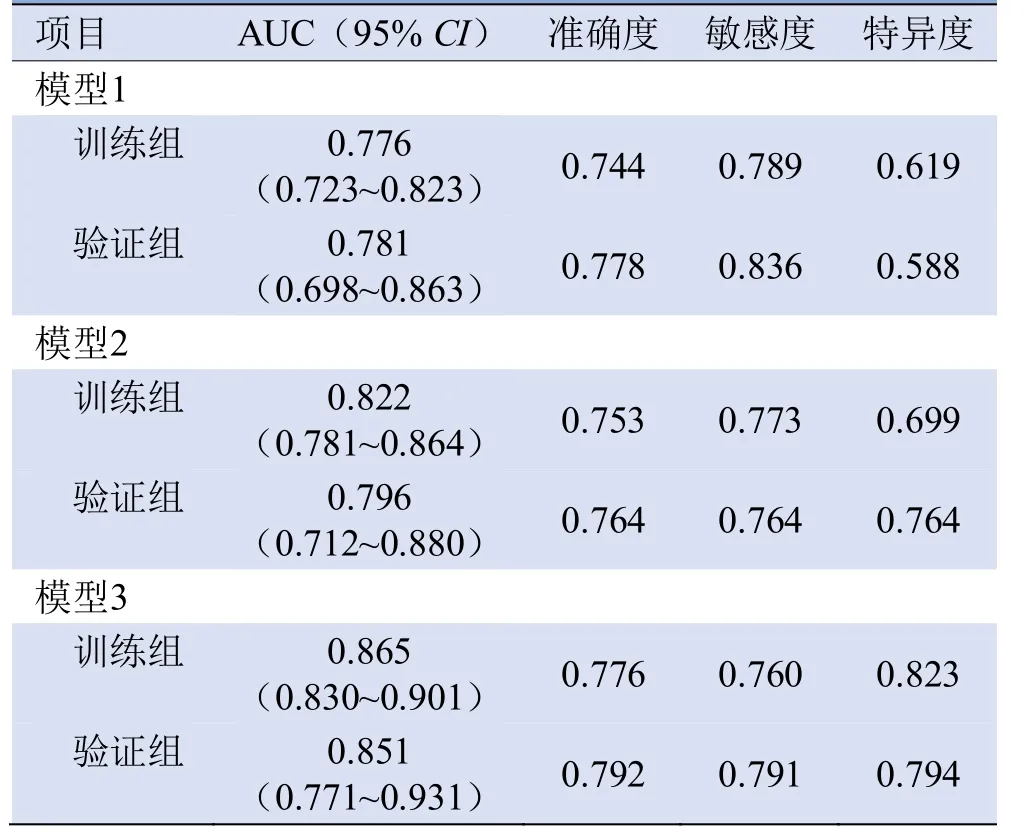
表4 3个预测模型性能
2.4 临床实用性 基于临床特征、R-score和CV-score在模型3的训练组中建立了诺模图(图3),Hosmer-Lemeshow检验显示模型的拟合优度较好(训练组P=0.20,验证组P=0.35)。诺模图的校正曲线见图4。决策曲线(图5)显示模型3在风险阈值为0.4~1.0时,预测性能最优,优于模型2和模型1。

图5 基于3种模型的决策曲线分析
3 讨论
本研究使用影像组学特征、CV特征和临床特征建立区分肺鳞癌和腺癌的预测模型,结果表明在训练组和验证组中联合影像组学特征、CV特征和临床特征形成的模型3对于鳞癌和腺癌的鉴别能力高于用影像组学特征建立的模型1和用影像组学特征和CV特征建立的模型2。
约80%~85%的新确诊肺癌为非小细胞肺癌,其中鳞癌和腺癌占90%以上,多数患者确诊时已失去手术机会。中晚期非小细胞肺癌的5年生存率仅为8%~12%。腺癌较鳞癌更容易发生淋巴结及远处转移。鳞癌晚期的一线治疗方式首选化疗,而腺癌患者的表皮生长因子受体突变、间变性淋巴瘤激酶融合等基因改变是决定是否应用靶向治疗的重要因素[12]。多数晚期非小细胞肺癌患者发现时已不适合手术切除,且部分患者基础状态差,不耐受支气管镜活检或CT引导下穿刺活检等有创检查;同时由于肺癌病灶内有较大的异质性、活检标本通常较小、在取材过程中易受到挤压等外在因素的影响,部分病例诊断困难。因此,无创性地对病灶进行表征显得尤为重要。
影像组学是通过计算机提取高通量的定量影像组学特征,以反映肿瘤的异质性并构建可行的预测模型[13]。目前的研究方向主要为应用影像组学特征和语义特征建立鳞腺癌预测模型。Wu等[14]提取了5个影像组学特征建立预测模型,其AUC值为0.72。Linning等[15]在平扫、动脉期及静脉期各提取3个影像组学特征建立预测模型,其AUC值分别为0.801、0.834和0.864。郑迎梅等[16]发现仅用肿瘤的CT表现如毛刺、分叶、空洞/空泡等无法鉴别肺鳞癌和腺癌。本研究首次将临床特征、影像组学特征和CV特征相结合,建立了鉴别鳞癌和腺癌的预测模型,取得了较好的诊断效能,训练组和验证组的AUC分别为0.865和0.851。而单独用影像组学特征建立的模型1,其训练组和验证组的AUC分别为0.776和0.781。
目前,CV已广泛应用于图像处理,并用于诊断食管癌、子宫内膜癌等[17-18]。由于没有预学习过程,CV特征受噪声影响非常小,且其具有低计算复杂性的特点,能够获得肿瘤更加详细的、不能被数学公式定义的信息。本研究结果表明,CV特征在鉴别肺鳞癌和腺癌中对影像组学特征有增益作用,影像组学特征与CV特征所形成的模型2在训练组和验证组的AUC值分别为0.822和0.796。因腺癌和鳞癌的许多临床特征具有差异,如腺癌常发生于不吸烟的女性、鳞癌的肿瘤倍增时间短、肿瘤体积常较腺癌大,因此本研究将患者的所有临床资料加入模型2形成模型3。决策曲线显示将临床特征、组学特征与CV特征结合能产生比单独的组学特征及组学特征和CV特征结合更多的临床获益。诺模图是一种基于回归模型而创建的图形计算工具,不仅可用于预测肿瘤发生风险的概率,而且还可用于肿瘤的预后评估[19]。本研究在模型3中建立了诺模图,将每个变量结合起来,用于预测每个患者的鳞癌和腺癌分类,以方便临床决策。
本研究的局限性:①本研究为单中心回顾性研究,需要多中心研究进一步验证研究结果;②因前期研究表明语义特征不能鉴别鳞癌和腺癌,本研究未将语义特征加入模型中。
总之,将肺癌病灶的影像组学特征、CV特征和患者的临床资料相结合可以较好地鉴别肺鳞癌和腺癌,本研究为无创性地表征肺癌病灶提供了可行性。
