人工智能在眼科药物研发的契机与挑战
2022-08-19陈健祺综述刘冬林浩添审校
陈健祺 综述 刘冬,林浩添 审校
(1.中山大学中山医学院,广州 510080;2.中山大学中山眼科中心,眼科学国家重点实验室,广东省眼科视觉科学重点实验室,广州 510060)
近年来,随着人口老龄化以及用眼方式的改变,干眼、青光眼、黄斑变性以及糖尿病性视网膜病变等眼部疾病的发病率持续升高[1],导致眼科药物的市场需求持续增长。据统计,全球眼科药物市场的增长速度是整个制药行业的2.5倍[2]。然而,目前新药研发面临着“周期长、成本高、成功率低”的三重困境。IQVIA等机构发布的报告[3]指出:2018年一款新药研发平均周期达12.5年,平均成本达26亿美元,平均成功率仅为11.4%。鉴于眼的生理结构精密复杂,且存在泪液稀释、血液流动、淋巴清除和血眼屏障等屏障系统,眼科药物研发面临着更大的挑战。尽管近年来出现了以雷珠单抗为代表的新一代抗VEGF药物作为亮点,但眼科药物的开发仍长期缺乏创新[4]。以抗青光眼药物为例,作为眼科制剂市场的主导力量,自1996年拉坦前列素推出之后,再无新的抗青光眼药物上市[2]。由此可见,亟需新的技术手段加速眼科新药的研发进度。近年来,人工智能(artificial intelligence,AI)发展迅速,正引领医学模式从精准医学向智慧医学转变。在眼病诊断领域,一批基于AI的诊疗平台如CCCruiser[5]、iGlaucoma[6]以及IDx-DR[7]相继问世,表现出了较大的应用优势,而在眼科制药领域,AI技术同样为新药研发的“降本增效”提供了巨大机遇,有望赋能眼药靶点发现、化合物筛选、药物动力学模型创新与临床试验开展等(图1)。本文将对AI在眼科药物研发的契机与挑战进行综述。
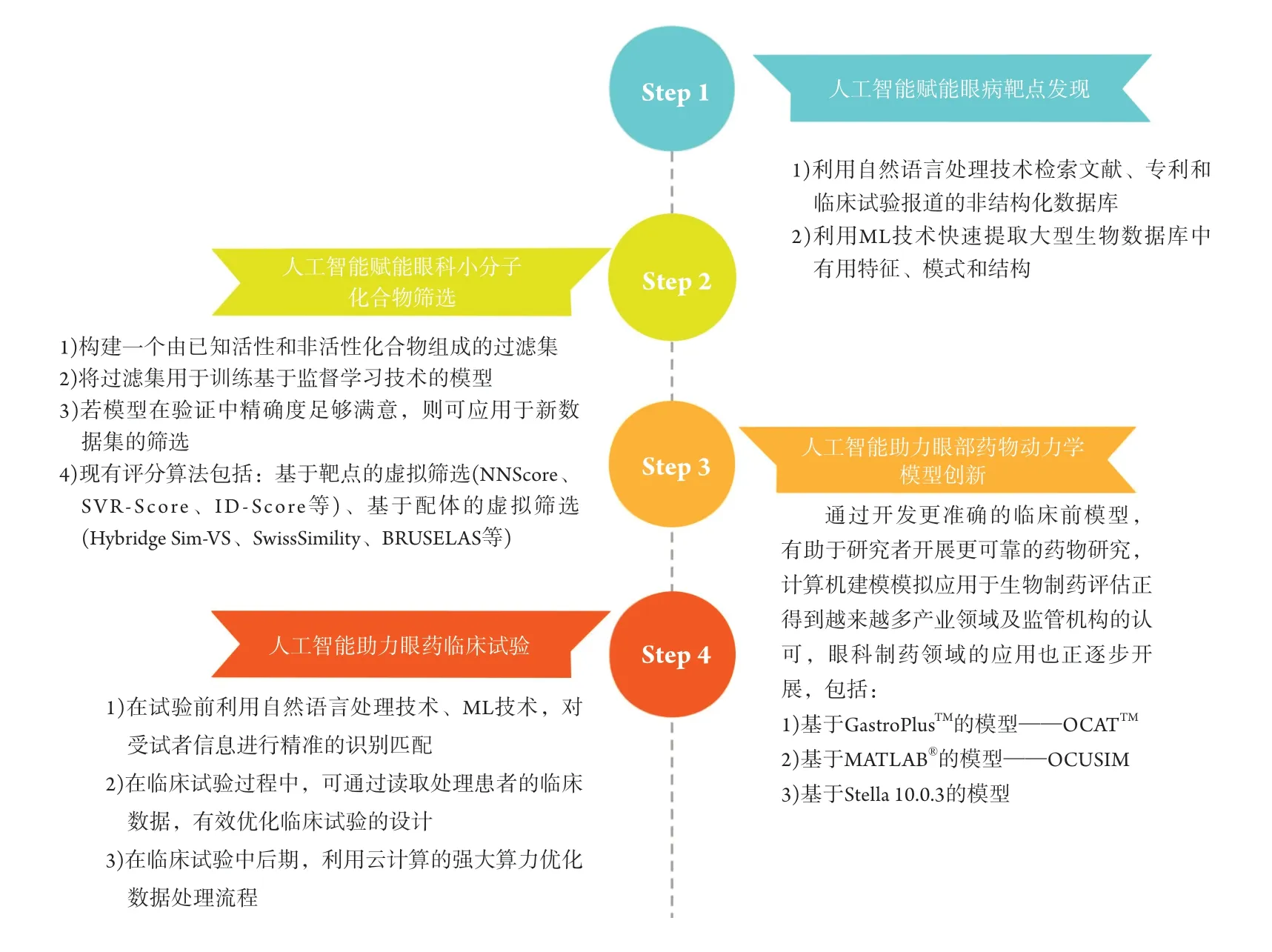
图1 人工智能在眼科药物研发的契机Figure 1 Opportunities of artificial intelligence in ophthalmic drug discovery and development
1 AI 在药物研发的初探
作为一门诞生较晚但发展迅速的学科,AI旨在构建一个模拟人类思考和解决真实世界问题的技术。在AI领域,机器学习(machine learning,ML)和深度学习(deep learning,DL)因在药物研发领域应用潜力较大而备受关注。ML令计算机从前期数据自动获取经验,指导其学习并完成结果输出的任务,在新药研发领域被广泛用于分类和回归预测,包括决策树算法、随机森林算法、支持向量机算法、k-最近邻算法及朴素贝叶斯分类器算法等[3]。DL则克服了ML必须预先给定识别特征和基于模板匹配的局限性,模拟人脑神经网络,从大量未归类未标记的原始数据中学习,自行提取有效信息。因此,DL为从海量数据体系提炼规律特征并输出结果提供了可能。随着计算机性能的提升和数据量的积累,DL在新药研发中的应用越来越广[8]。在DL算法中,循环神经网络(recurrent neural network,RNN)具有处理序列数据以及记忆的能力,可用于处理基因和蛋白序列数据[9];自编码器(auto encoder,AE)可通过对输入数据的重构生成学习模型,可应用于药物分子生成[10];深度神经网络(deep neural network,DNN)、卷积神经网络(convolutional neural network,CNN)等则常通过定量结构活性关系分析,预测药物分子的物理化学性质以及代谢过程。Wong等[11]研究指出:AI技术的应用可使新药研发的成功率从12%提升到14%,同时每年在全球范围内节省研究费用约550亿美元。2021年,Insilico Medicine首次利用AI新药靶点发现平台PandaOmics和AI分子生成设计平台Chemistry42,获得了全球首例完全由AI驱动发现的治疗特发性肺纤维化的新靶点,并生成了相关的临床候选新药。该新药成功通过多次人类细胞和动物模型试验验证,而从靶点发现、分子生成到传统实验验证,需时不到18个月,总成本仅数百万美元[3]。可见,AI在药物研发领域存在巨大优势,能够显著提高效率并降低成本。
2 AI 在眼科药物研发的应用契机
2.1 AI 赋能眼病靶点发现
眼科药物研发的早期阶段尤其是围绕靶点的发现,是影响研发成功率的关键阶段,基于目标的筛选和表型筛选是两种最常用的临床前策略[2]。与表型筛选相比,基于目标的筛选指向性更强、效率更高,在20世纪90年代后应用越发普遍。然而,该筛选方法在药物监管批准中往往面临更多的阻碍,通过率相对更低[12],这归因于该筛选方法需要对作用目标及机制有着更为详细的了解。研发领域也逐渐认识到在新型的筛选模式下,深入了解疾病的病理生理学、临床表现及病程对于靶点发现的重要性[13]。
以葡萄膜炎为例,其作为一种以眼内炎症为特征的异质性疾病,在最初的治疗模式中专家偏向于使用多种免疫抑制类药物,而后期的动物模型和体外研究[14-15]则进一步揭示了葡萄膜炎基于的一系列免疫途径,包括IL-1β、IL-6和IL-17的分泌,提示相关分子通路有望成为靶点。基于对靶点的深入认知,一批针对性的单抗被纳入了研究范畴,如IL-17A单抗苏金单抗、IL-6单抗托珠单抗等[16-20],并在实验室研究中体现出了一定的效果。在AI的辅助下,上述深入了解眼病并发掘分析靶点的效率将有望得到提高。一方面,研究人员可以通过自然语言处理技术检索文献、专利和临床试验报道的非结构化数据库,以发掘潜在的疾病机制,从而发现新的靶点,如IBM Watson系统通过分析海量文献寻找疾病关联以推动新药研发,Interrogative Biology平台通过分析病人与正常人样本以寻找新靶点。另一方面,在ML技术的帮助下,大型生物数据库中有用特征、模式和结构的提取也更加便捷,可更高效地进行疾病网络分析、药物相互作用分析以及药物-靶点作用分析,相关的数据库包括了DisGeNET(确定基因-疾病关联)、STRTCH(确定药物-靶标关联)及STRING(确定分子途径)等[21]。鉴于AlphaFold2算法已完成了对人类蛋白质组中绝大多数蛋白质结构预测,未来将有更多的靶点蛋白丰富AI的数据集,配合上相关算法的优化迭代,ML从数据库中提取有效信息的成功率有望进一步提高。
2.2 AI 赋能眼科小分子化合物筛选
在确定和验证了眼病靶点之后,研发工作的下一步是筛选合适的药物分子以实现与靶点的结合并发挥作用。传统的小分子药物多来源于化合物高通量筛选,但化合物库的规模与结构多样性不足,常常导致化合物库与目标蛋白不匹配,最终导致筛选总体成功率偏低。
近半个世纪以来,为了提高筛选的成功率,计算机辅助药物设计(computer-aided drug discovery,CADD)被广泛使用,这种被认为更有效、目的导向的筛选方法在靶点明确时从化合物库中筛选契合片段,在靶点结构不明确时采用虚拟筛选方法(virtual screening,VS),即对与参考配体具有相似结构的化合物进行筛选。然而,CADD仍是衍生自既有知识经验的积累,其可拓展性仍然相对局限。相比之下,ML辅助下的VS,则可以有效摆脱数据库的局限性,实现从海量化合物中筛选高潜力候选药物。将ML用于辅助VS,首先需要构建一个由已知活性和非活性化合物组成的过滤集,并将其用于训练基于监督学习技术的模型,若该模型在验证中精确度足够满意,则可应用于新数据集的筛选。ML的辅助使化合物检索更快、覆盖范围更广,可高效富集潜在有效分子。目前已有多种评分算法开发成功,在基于靶点的VS中,可应用的有基于神经网络的NNScore[22],以及基于支持向量回归法的SVR-Score[23]和ID-Score[24];在基于配体的VS中,则有Hybridge Sim-VS[25]、SwissSimility[26]及BRUSELAS[27]等。利用ML技术,可有效减少新药研发过程中的时间和成本[28]。
2.3 AI 助力眼部药物动力学模型创新
鉴于使用人眼进行侵入性的研究受到伦理学限制,眼科药物的临床前药动学研究多基于动物模型,如啮齿类动物、家兔、非人灵长类等。然而,动物模型存在着多方面的局限性。首先,在眼部结构的体积上,人与动物之间即存在显著差异。人玻璃体的体积为4 mL,而大鼠、家兔及猴玻璃体体积分别为50 μL、1.5 mL和1.9 mL,其扩散路径长度的差异会影响药物分布,同时体积的差异也将影响到药物清除半衰期[29]。其次,在进行结果测量时,复杂而独特的眼部解剖结构使得研究人员难以从动物模型中直接获得准确的药动学信息,如眼内药物分布以及清除情况等,而侵入性的取材方式,也存在化合物重分布的风险。上述弊端将导致临床前药动学试验的结果在外推于人类时存在局限性。
因此,许多专家认为,通过开发更准确的临床前模型,有助于研究者开展更可靠的药物研究[30-31],而计算机建模模拟应用于生物制药评估正得到越来越多产业领域及监管机构的认可,目前主要用于口服药物的开发[32-34],眼科制药领域的应用也正逐步开展。生物制药建模程序如GastroPlus™和Simcyp等可从经验训练数据集中导出内置模块方程,以实现在实验数据有限的情况下,利用其中物理化学特征完成基于眼部结构的预测建模。基于GastroPlus™的软件模块OCAT™即为目前最先进的眼部建模程序,该程序内置提供了家兔、猴以及人类的眼部生理功能数据,涉及的眼室包括睑结膜、球结膜、角膜前、角膜上皮、角膜基质、房水、虹膜睫状体、前后巩膜、前后玻璃体液、视网膜、脉络膜及视网膜色素上皮,不同眼室间药物的吸收转运由被动扩散、载体介导和对流流动来描述,而鼻泪管引流、血管化组织吸收、黑色素结合等也被考虑其中[35]。其他程序如MATLAB®则可以进行终端的灵活定制,以扩展出匹配药物输送系统的生物制药模型,如基于MATLAB®的OCUSIM。OCUSIM利用用户输入的药物物理化学参数,结合默认的或个性化定制的眼部组织参数,可评估模型眼的药物动力学参数。在试验中,OCUSIM模拟了患者采用滴眼或眼内注射包括曲安奈德在内的几种化合物,成功预测了眼组织(房水、虹膜睫状体、玻璃体)及血清中的药物的浓度及随时间变化的关系[36],并通过扩散、对流及有限元模型对房水及玻璃体中的物质传递进行了数学描述[37]。随着研究的开展,更多的软件模块被用于建模,眼科模型日趋丰富,如Deng等[38]利用Stella 10.0.3软件构建了一个药动学模型,模拟了药物制剂和理化性质对匹罗卡品溶液和氟甲松龙悬浮液药动学的影响,模型根据药物流动路径分为药物固体、药物溶剂、角膜上皮药物、房水药物4个部分,在动物活体验证中预测值与真实值吻合度较高,对多种制剂的预测具有较高的准确性。在眼病模型创新方面,AI可以提供一些先进且快捷的解决方案,在短期内可能还不能替代动物模型在药效学研究的作用,但有望成为药动学研究的重要参考,以期以较低的成本为后续实验提供信息与思路,成为临床前试验的“智慧助手”。
2.4 AI 助力眼药临床试验
临床试验是新药研究中周期最长,成本最高的环节,且成功率通常不高,进入临床试验的每十种药物通常只有一种能进入市场。近年来,通过对临床试验的反思,研究人员发现在许多疾病中相同的表型基于不同的发病机制,可能需要对应不同的治疗策略。因此,传统的基于表型分组的临床试验模式,可能由于信噪比的降低而常常表现为治疗的失败。在眼科领域,以葡萄膜炎为例,相同的表型可能由不同的免疫紊乱产生,同种治疗方式在不同患者中可存在较大的差异反应[39]。
为了提高临床试验的成功率,药物开发行业已经开始将临床试验在分组时从按表型分类转向按机制分类,即根据患者特定的疾病与病理生理学机制,针对性地分组进行治疗[40],同时在该过程中不断完善生物标志物的开发,并进一步用于分组。该方法在肿瘤学中应用目前较为广泛,显示出了显著的成本节约与成功率提高[41],也更符合当代精准医学的理念,可能成为包括眼科学领域在内众多领域临床试验的新方向。在新型的临床试验思路中,AI可在试验前利用自然语言处理技术、ML技术,对受试者信息进行精准的识别匹配,通过扩大受试者范围、医学资料数字化、理解医学资料内容、关联数据集与模式识别等途径进行高效的自动化入组与排除处理,如IBM Watson基于自然语言处理技术开发了一个临床试验匹配系统,该系统使用患者既往医疗记录和临床数据创建详细的档案,通过扫描临床试验数据库,为临床试验寻找合适的患者[3],有望提高基于机制分型的临床试验的效率。在临床试验过程中,AI可通过读取处理患者的临床数据,有效优化临床试验的设计,减少不必要的临床操作负担,如trials.ai公司利用算法挖掘大量实验相关文件,对临床试验本体进行针对性的调优,可有效提高精确度与效率。在临床试验中后期,AI还可利用云计算的强大算力优化数据处理的流程,通过各种临床试验的电子数据采集系统与数据管理系统,快速处理临床数据,以实现临床试验的及时优化。
3 AI 在眼科药物研发的应用挑战
3.1 高质量数据集可及性低
与眼病的影像学诊断不同,新药研发领域规则不明确、数据不明晰甚至含有错误信息。鉴于AI对于高质量标识数据集高度依赖,新药研发在数据集上的高度不确定性将为深度学习参与研发早期的靶点发现与化合物筛选带来巨大挑战。
在数据采集方面,A I 参与药物研发需要健康医疗、生物信息和药物化学等领域优质数据支持,但目前研发领域的AI从设计到应用多仅基于化学数据,如物理化学性质、靶点亲和力等,这得益于相关数据如抑制常数Ki、解离常数Kd、半抑制浓度IC50等质量较高、历史积累较丰富。然而,在药物的实际作用中还涉及到一系列在现有AI模型中忽略的部分,如前体化合物、代谢产物等,同时还需兼顾一系列难以定量计算的生物学数据如受体蛋白构象变化、平衡及偏置信号等。因此,目前研发领域亟需完善医药研发数据库,为拓展AI在新药研发领域的应用构建高质量数据支撑体系。在数据质量方面,海量文献数据质量参差不齐,这将导致AI产出结果的信噪比偏低,截至2017年,在FDA批准的1 578个药物中,靶点数目为667个[42],而许多由AI标注的潜在靶点数目均远多于此数值,如Ensembl标注的潜在成药靶点就超过了4 000个。在如此庞大的潜在靶点库中,鉴于数据的信噪比较低,可能导致多数药企并无充足的信心投入大量资源加以一一验证,产出结果数据的利用率也难免偏低。在数据应用方面,医药大数据存储分散、格式不一,且多涉及到商业机密,导致高质量数据共享与应用困难重重。针对该现状,需要在完善数据资产安全和知识产权法规的同时建立既能提供数据数量又能保障数据质量的数据共享平台,如皮斯托亚联盟(Pistoia Alliance)主动发起了一场运动,鼓励数据共享,并尝试在未来建立统一的数据格式。
3.2 眼科给药途径存在独特性
眼科药物相对于其他药物而言,在给药途径上存在相对的独特性。目前,眼科给药一般分为三大类,包括以眼前段为主要靶点的局部药物、以眼后段为主要靶点的眼内/玻璃体内药物、可用于治疗前后段疾病的全身药物[2]。其中,滴眼制剂因其安全、简便而为广大患者所接受,被认为是治疗眼科疾病的首选方法,这一简单的药物递送方式持续使用了几个世纪,至今仍占据市场主导地位[2],大多数眼表及前房疾病均可使用滴眼制剂治疗。然而,传统的滴眼制剂只有5%能穿透角膜,加之泪液的冲洗使其不能提供足够浓度的药物于晶状体及眼后段,导致在治疗相关眼病时生物利用度较低[43]。面对眼球独特的解剖学特点,研发新的药物递送系统一直是眼药研发的重点之一,包括开发亲脂药物如噻吗洛尔[44]、开发眼穿透屏障肽如Penetratin[45]、开发眼植入缓释制剂[46]及眼离子导入技术[47]等。在参与眼药研发的过程中,AI需综合考虑相关的解决方案以跨越眼药领域这一“从分子到药物”的鸿沟。
3.3 高端复合型人才缺口较大
AI参与眼科药物研发,涉及到智能科学与技术、眼科学、药物化学等多领域的知识,需要一批既熟练掌握AI技术、又精通新药研发并对眼科学有系统学习的复合型人才。鉴于早期的人才培养多遵循专业化而非复合化,复合型人才目前缺口较大,需要建立“AI+眼药研发”模式的复合型人才跨学科培养输出机制,以培养一批高学识、高能力的复合型科研人员、技术工作者和应用开拓者,形成满足行业发展需求的人才网络。2018年,国家教育部发布了《高等学校人工智能创新行动计划》,明确将大力支持高等学校全面形成“人工智能+X”复合专业培养新模式,建立我国AI人才高地[48]。在该模式下,以高校为主体的跨学科探索性研究将率先开展,并逐步探索建立以高校面向国家重大战略部署所承担的国家重大科技任务、国家级创新平台、省部级创新平台等为支撑,强化高层次人才培养的模式,逐步形成“AI+眼药研发”的人才培养方案,以期实现复合型人才需求的补足。
4 结语
在新药研发面临“周期长、成本高、成功率低”三重困境的当下,AI技术的出现为药物研发提供了一种新的强力支撑。除上述四种常见的应用途径外,AI还有望应用于药物肽合成和小分子设计、最佳给药剂量的确定、药物释放监测、药物相互作用预测、毒性预测等。将AI应用于眼科药物研发,一方面有望满足眼科药物市场对常见眼病(如青光眼)治疗药物的创新需求,另一方面有望为罕见眼病提供成本较低的解决方案,驱动“孤儿药”的探索发展,加快新药研发进度,使更多的新药早日进入临床。尽管AI和生命科学融合的道路上仍有许多工作要做,但毫无疑问的是,在不久的将来,AI将为眼科药物研发带来革命性的新突破。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。
