基于数据库探索GPX4基因在泛癌中的潜在价值*
2022-08-19余水红王晓梅
余水红 李 帆 金 耀 马 军 王晓梅 龚 莉
(1安庆医药高等专科学校,安庆 246052;2深圳大学医学院,深圳 518061;3安庆师范大学生命科学学院,安庆 246502)
细胞死亡对于机体维持正常发育、抑制肿瘤细胞过度增殖等生理病理过程具有重要的意义[1],铁死亡是2012年发现的新型细胞死亡形式,其分子机制主要是依赖细胞内脂质过氧化的产生和消除,当细胞内活性氧无法有效消除,积累的氧化性的脂类物质诱发细胞铁死亡[2],激活铁死亡可抑制诸多肿瘤细胞增殖和侵袭等特性。谷胱甘肽过氧化物酶4(glutathione peroxidases 4,GPX4)是调控体内谷胱甘肽的代谢,介导肿瘤铁死亡过程中关键的基因。研究表明越来越多的肿瘤表现出抗凋亡的特性[3-4],探索新的细胞死亡形式——铁凋亡在肿瘤治疗领域中具有潜在的应用价值。
本文借助多个在线肿瘤数据库对GPX4基因进行了泛癌分析,以探索GPX4基因在泛癌组织中的表达、突变及潜在调控机制与肿瘤发生发展、患者的预后、肿瘤免疫潜在的相关性,以期为GPX4基因能够作为泛癌诊断、治疗靶点及预后的潜在候选生物标志物提供依据。
1 资料与方法
1.1 资料
数据库:UALCAN数据库(http://ualcan.path.uab.edu),TIMER数据库(https://cistrome.shinyapps.io/timer/),GEPIA(http://gepia.cancer-pku.cn/),cBioPortal数据库(http://www.cbioportal.org/),LinkedOmics 数据库(http://www.linkedomics.org/login.php)。
1.2 方法
1.2.1UALCAN及TIMER数据库分析GPX4 mRNA表达水平 UALCAN及TIMER数据库界面输入GPX4,选择泛癌分析,通过其分析GPX4基因在泛癌组织与癌旁组织中mRNA的表达。
1.2.2cBioPortal数据库分析GPX4基因在泛癌中变异 在cBioPortal数据库类型中选择“TCGA database”,分别选择泛癌类型,基因选择“GPX4”,分析GPX4在泛癌中的变异类型、变异数目。
1.2.3GEPIA数据库分析GPX4基因与泛癌患者预后的关系 在GEPIA数据库生存分析界面输入GPX4,依次选择泛癌类型及生存分析类别,分析比较患者样本高GPX4表达组及低表达组的生存预后。
1.2.4LinkedOmics数据库分析GPX4参与通路及其靶向调节的miRNA 在Linked Omics数据库界面依次选择1)肿瘤类型;2)数据类型选择RNAseq;3)数据属性,选择GPX4;4)靶数据类型,选择RNAseq;5)统计学方法,选择非参数检验。分析GPX4参与通路及其靶向调节的miRNA。
1.2.5TIMER数据库分析GPX4基因与免疫细胞的关系 在TIMER数据库“Gene”界面“Gene Symbol”框中输入“GPX4”,在“Cancer Types”框中同时选择“COAD、STAD、THCA”,分析GPX4在结肠癌、胃癌及甲状腺癌中的表达与免疫浸润的相关性,包括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞以及肿瘤纯度。
1.2.6GEPIA数据库分析GPX4与免疫细胞标记基因的相关性 在GEPIA数据库“Correlation”界面“Gene A”框中输入“GPX4”,在“Gene B”框中分别选择免疫细胞标记基因,在“TCGA Tumor”框中分别选择“COAD、STAD、THCA”肿瘤,分析GPX4在结肠癌、胃癌及甲状腺癌中免疫细胞标记基因的相关性。
1.3 统计学方法
实验结果数据均来自以上数据库,采用系统默认的统计学方法,计算危险比(Hazard Radio,HR)及95%CI,Longrank检验差异,P<0.05示差异具有统计学意义。
2 结果与分析
2.1 GPX4基因在泛癌中的表达
与正常组织相比,在BLCA、CHOL、COAD、ESCA、HNSC、KICH、KIRC、KIRP、LIHC、LUAD、PRAD、READ、THCA、STAD及UCEC癌症中高表达(P< 0.05),在BRCA及LUSC癌症中低表达(P< 0.05),在CESC、GBM、PAAD、PCPG、SARC、SKCM、THYM癌症中表达无意义(P>0.05)(图1A-B)。利用TIMER数据进一步分析,GPX4在BLCA、COAD、ESCA、HNSC、KICH、KIRC、KIRP、LIHC、LUAD、PRAD、READ、THCA、STAD及UCEC泛癌中的高表达(P< 0.05),在BRCA癌症中低表达(P< 0.05),因此GPX4可能是通过铁死亡途径调节BLCA、COAD、ESCA、HNSC、KICH、KIRC、KIRP、LIHC、LUAD、PRAD、READ、THCA、STAD、UCEC及BRCA 15种癌症死亡过程的重要基因。
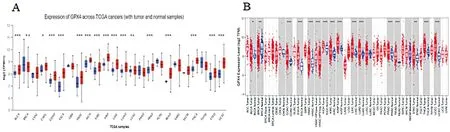
注:A.UALCAN,B.LinkedOmics.*P< 0.05;**P< 0.01;***P< 0.001
2.2 GPX4基因在泛癌中的变异
GPX4基因在泛癌中变异率在2%以上有BLCA及STAD两种肿瘤,LUAD、ESCA、BRCA及HNSC 4种肿瘤的变异率在1%~2%,LIHC、UCEC、COAD、THCA、KIRC及PRAD 6种肿瘤的变异率在0%~1%,GPX4基因在KICH、KIRP及READ 3种肿瘤中无突变;GPX4基因在泛癌中的变异类型有扩增变异、缺失变异和错义突变,其中缺失变异是GPX4基因的主要变异类型。见表1。
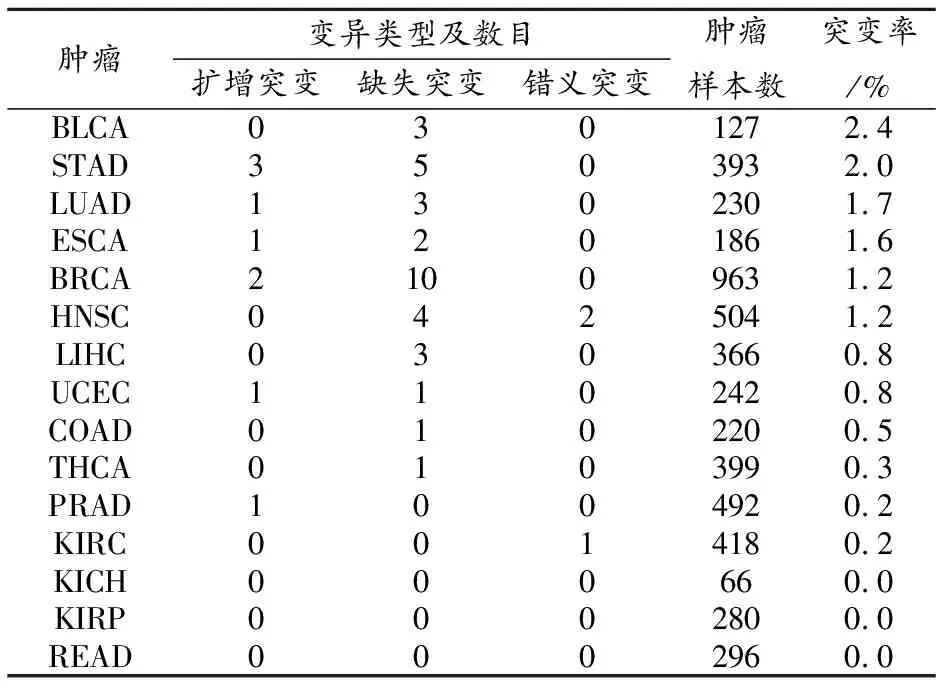
表1 GPX4基因在泛癌中的变异
2.3 GPX4基因与泛癌患者预后的相关性
高表达GPX4不利于STAD患者OS和DFS(OS∶HR=1.5,χ2=0.021;DFS∶HR=1.5,χ2=0.035);高表达GPX4不利于COAD患者OS(HR=1.6,χ2=0.0059),与患者DFS无显著相关性;高表达的GPX4利于THCA患者OS(HR=0.2,χ2=0.043),与患者DFS无显著相关性;GPX4表达与其他泛癌患者OS和DFS均无相关性(P>0.05)。因此,GPX4可能作为COAD、STAD和THCA患者预后的候选基因。见图2。
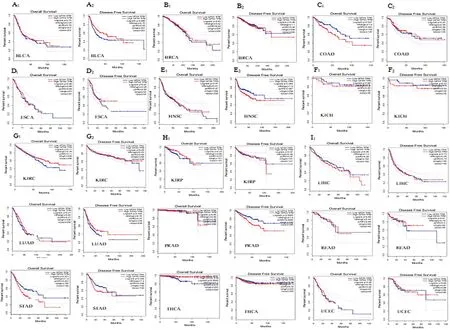
图2 GPX4的表达和多种癌患者总生存期和无病生存期的关系(GEPIA)
2.4 MIR靶向调控GPX4基因表达
在COAD、STAD和THCA中正向调节GPX4表达的主要MIR分别有4种、6种及5种,负向正向调节的MIR分别有42种、66种及54种,其中MIR-503及MIR-127共同正向调节GPX4表达,MIR-495、MIR-25、MIR-32、MIR-92、MIR-363、MIR-130A、MIR-141、MIR-200A、MIR-519A、MIR-519B、MIR-519C、MIR-18A、MIR-18B及MIR-18C共同负向调节GPX4表达。见图3。
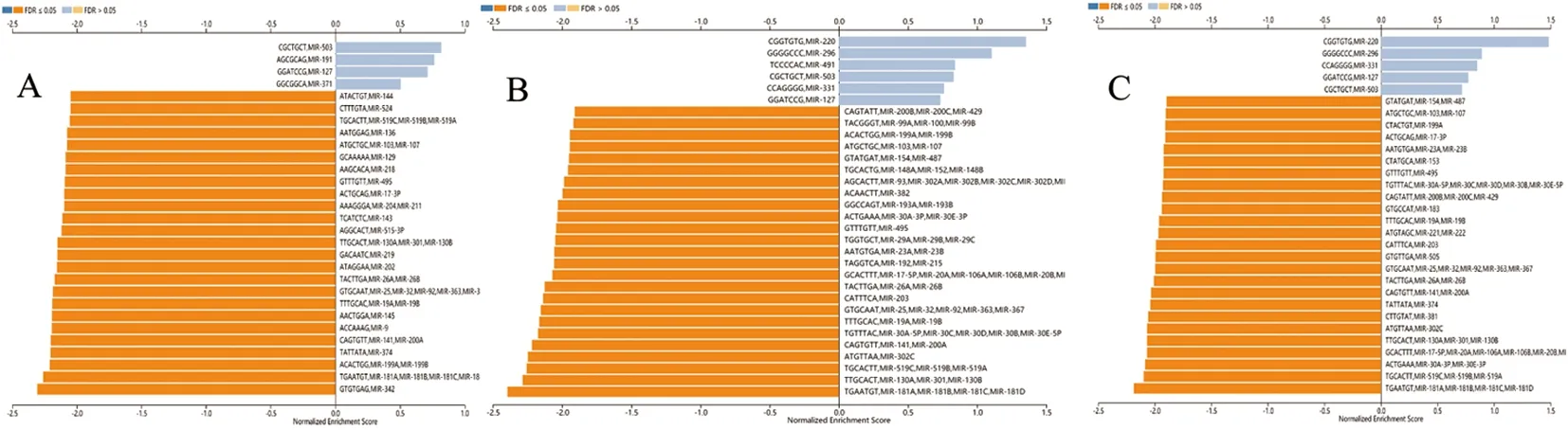
图3 靶向调控GPX4基因MIR分析
2.5 GPX4及相关基因KEGG通路富集
在COAD、STAD和THCA中GPX4及相关基因共同参与核糖体、氧化磷酸化、磷脂酰肌醇信号系统、赖氨酸退化、谷胱甘肽代谢、JAK-STAT信号通路及MicroRNAs调节等14个过程。见表2。
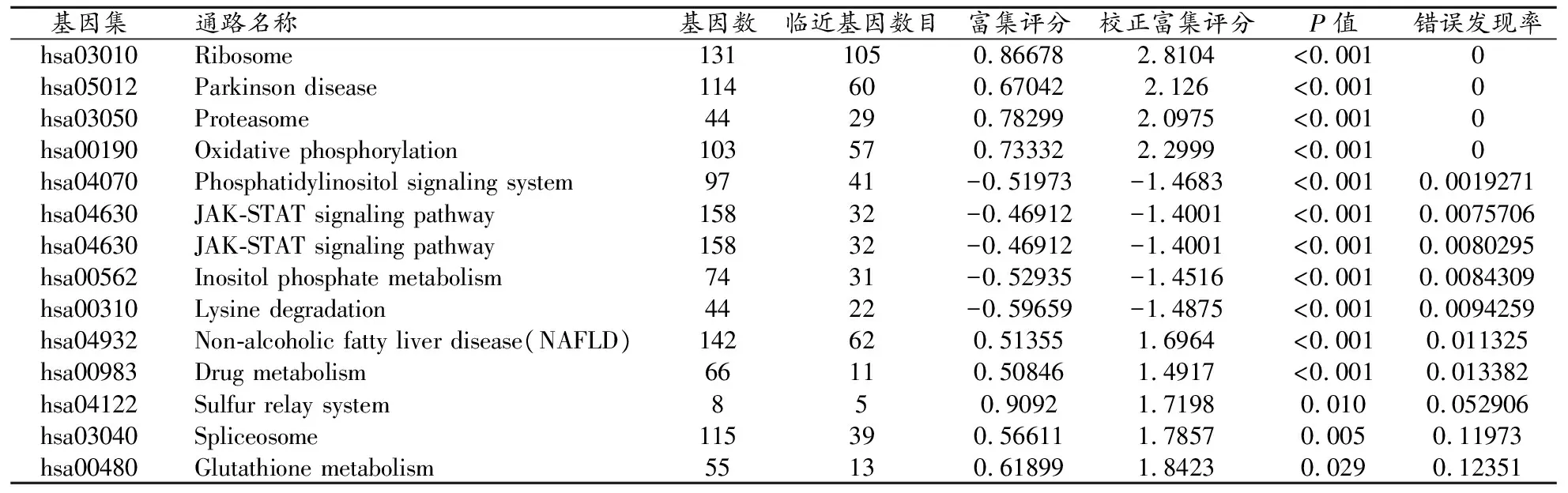
表2 GPX4及相关基因KEGG通路富集(LinkedOmics)
2.6 GPX4基因与COAD、STAD和THCA中免疫细胞的相关性
GPX4在COAD中与CD8+T细胞的表达负相关,与肿瘤纯度、B细胞、CD4+T细胞、巨噬细胞、中性粒细胞及树突状细胞的表达无统计学意义;GPX4在STAD中与B细胞的表达呈负相关,与肿瘤纯度、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞及树突状细胞的表达无统计学意义;GPX4在THCA与B细胞、CD4+T细胞、巨噬细胞及树突状细胞的表达呈负相关(P<0.05),与CD8+T细胞呈正相关,与肿瘤纯度及中性粒细胞的表达无统计学意义(P>0.05)。见图4。
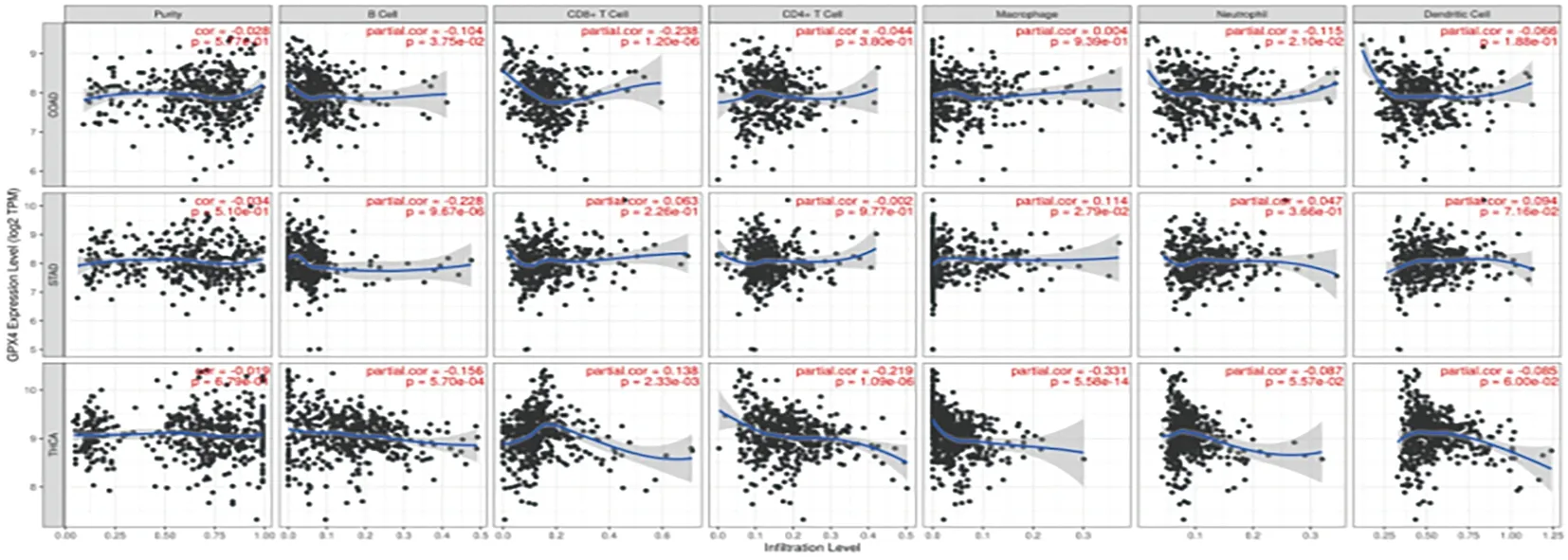
图4 GPX4基因与COAD、STAD和THCA免疫细胞间的相关性(TIMER)
2.7 GPX4基因与COAD、STAD和THCA中免疫细胞标记基因的相关性
GPX4在COAD中与CD8+T细胞的标记基因CD8A呈正相关(P<0.05),与标记基因CD8B无统计学意义(P>0.05);GPX4在STAD中与CD8+T细胞的标记基因CD19及CD79A均无统计学意义(P>0.05);GPX4在THCA与B细胞(CD19和CD79A)、CD8+T细胞(CD8A和CD8B)、CD4+T细胞(CD4)及巨噬细胞(NOS2、IRF5、MS4A4A)标记基因有统计学意义(P<0.05),与巨噬细胞(PTGS2、CD163和VSIG4)无统计学意义(P>0.05)。见表4~6。
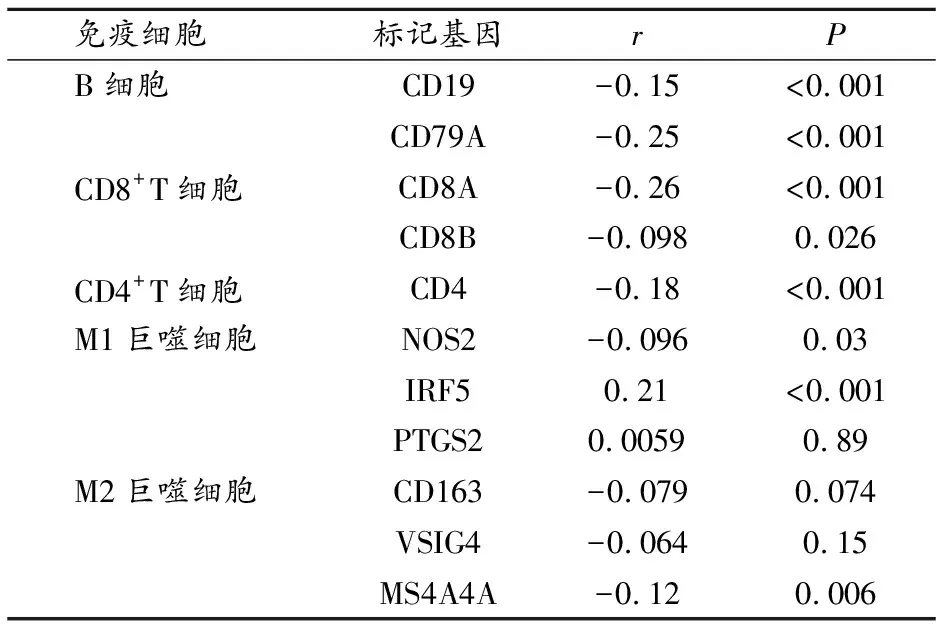
表4 GPX4与THCA免疫细胞标记基因相关性分析(GEPIA)

表5 GPX4与STAD免疫细胞标记基因相关性分析(GEPIA)
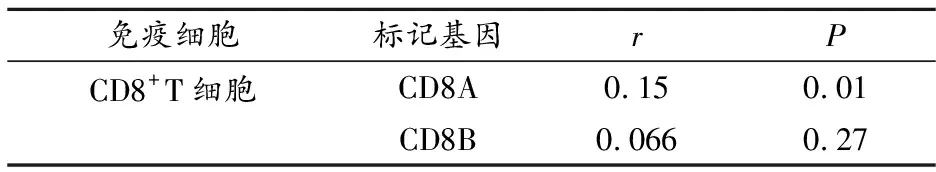
表6 GPX4与COAD免疫细胞标记基因相关性分析(GEPIA)
3 讨论
GPX4基因是调节铁死亡途径的关键基因,越来越多的研究表明众多基因调控GPX4表达在肿瘤的发生发展过程中起着重要的作用。ZEB1、mir-1287调控GPX4转录,促进乳腺癌增殖[5-6],circKIF4A通过上调GPX4促进甲状腺乳头状癌增殖[7],过表达KLF9增加GPX4和活性氧水平抑制SKOV3人卵巢癌细胞凋亡[8],CREB促进GPX4表达抑制肺腺癌增殖[9]。然而GPX4基因的潜在价值仍需进一步挖掘分析。
基因异常表达及基因变异是癌症发生发展的内在因素[10],GPX4在15种癌症中异常表达,在12种癌症中存在基因变异,其高表达不利于结肠癌和胃癌患者预后,原因可能是基因直接或间接调控GPX4高表达,使活性氧积累,抑制肿瘤凋亡,从而不利于患者预后;GPX4异常表达与BLCA、BRCA、ESCA、HNSC、KICH、KIRC、KIRP、LIHC、LUAD、PRAD、READ及UCEC患者预后无相关性,可能GPX4异常表达仅影响泛癌的发生,不影响泛癌的发展;GPX4高表达利于甲状腺癌的预后,调节其表达机制还有待探索。
基因潜在作用的发挥受其他基因或MIR直接或间接调控[11],GPX4及相关基因参与了氧化磷酸化、磷脂酰肌醇信号系统、赖氨酸退化、谷胱甘肽代谢及MicroRNAs调节,这些发现与铁死亡代谢的研究的基本一致[1],研究表明JAK-STAT信号影响COAD、STAD和THCA增殖侵袭等特性,但GPX4在JAK-STAT信号中的作用是如何影响这三种肿瘤特性尚未研究。COAD、STAD和THCA中共同靶向调节的16种MIR参与多种肿瘤发生发展,但尚未有基础实验研究其靶向调控GPX4表达影响COAD、STAD和THCA的增殖侵袭等特性。
肿瘤免疫细胞影响化疗疗效、放疗疗效、基因治疗疗效、混合治疗疗效及患者生存期长短。本研究表明GPX4与COAD、STAD和THCA B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞免疫细胞中的相关性有所不同,而与这些免疫细胞标记基因的有一定的相关性,可能在抗肿瘤免疫应答或免疫逃逸过程中起着不同的作用。
总之,本研究通过生物信息分析从多个层次探讨GPX4的在泛癌中潜在的作用,其在多数肿瘤中异常表达与突变,但仅与COAD、STAD和THCA患者的预后相关。此外GPX4基因在COAD、STAD和THCA在免疫调节、免疫治疗和免疫逃逸中也具有重要作用。但GPX4异常表达与癌症的发生机制和GPX4高表达利于THCA的预后的机制仍需深入研究。
