高三尖杉酯碱通过上调casp3 和casp8 表达发挥对骨肉瘤细胞系的抑制作用
2022-08-18钟厚成朱宇凡杨敏魏任雄
钟厚成 朱宇凡 杨敏 魏任雄
骨肉瘤是骨科最常见的原发实体恶性肿瘤之一,其发病有两个高峰期,一个为青少年时期,另一个为老年期[1-2]。有研究表明,男性骨肉瘤的发病率是女性的1.27倍[3-4]。在20 世纪60 年代,骨肉瘤治疗为单独手术治疗,术后1 年约90%的患者肿瘤复发,其中部分患者伴有骨肉瘤的肺部转移。20世纪70年代,随着辅助化疗的引入,原发非转移性骨肉瘤的5 年总生存率可达68%[3,5],而转移性骨肉瘤的5 年总生存率不超过20%[6],术后10 年生存率从30%上升至50%左右[1,7]。然而,自20 世纪90 年代以来,即便诊疗方法不断改进,术后10年生存率也无明显改善,而复发性骨肉瘤患者的5年生存率仍低于28%[1,8]。鉴于骨肉瘤的治疗现状,为骨肉瘤患者寻找新的治疗策略是必要和迫切的。
高三尖杉碱(homoharringtonine,HHT)是一种细胞毒性生物碱,可以抑制蛋白质合成,HHT可以从三尖杉科植物或其同属植物中提取分离,该药已获美国食品药品监督管理局(FDA)批准,临床可用于治疗慢性粒细胞白血病(chronic myelocytic leukemia,CML)[9],HHT 可以显著促进CML 细胞的凋亡[10]。同时,根据目前研究,HHT 可以通过调控NF-κb 通路、HSP90 等对急性淋巴细胞白血病发挥治疗作用[11-13]。在HHT相关的实体肿瘤研究中,其也表现出了良好的抗肿瘤效果。如在三阴乳腺癌的研究中表明,HHT可以显著抑制多种细胞系的体外生长能力,其动物实验也进一步证实HHT在体内也有良好的抗肿瘤效应[14]。
化疗包括中医药作为治疗骨肉瘤的重要手段,在缓解骨肉瘤进展、延长患者生存期方面发挥作用,但是传统的化疗药物由于不良反应大及容易产生耐药作用,严重限制了其临床应用[15]。因此,寻找新的骨肉瘤治疗药物、肿瘤的免疫治疗及联合用药是目前研究的热点[16]。在本研究中,笔者探究了高三尖杉酯碱的抗骨肉瘤细胞系143b、U2-OS的作用机制,研究HHT对骨肉瘤细胞的增殖、侵袭、迁移等的影响,为骨肉瘤的化疗提供更多的治疗思路。
1 材料与方法
1.1 主要试剂与细胞株
高三尖杉酯碱(北京索莱宝科技有限公司),分子式为C29H39NO9,分子量为545.62,纯度≥98%。人骨肉瘤细胞株143b和U2-OS(中国典型培养物保藏中心),CCK-8试剂盒(日本同仁生物科技有限公司),细胞凋亡试剂盒及细胞周期试剂盒(上海碧云天生物技术有限公司)。PCR 引物(北京擎科生物科技有限公司);逆转录试剂盒、PCR试剂盒(南京诺唯赞生物科技股份有限公司)。
1.2 细胞培养
143b 细胞培养于含有1%双抗(青霉素和链霉素)及10%胎牛血清(澳大利亚Gibco 公司)的RPMI-1640(美国Gibco公司)完全培养基中,U2-OS细胞培养于含有1%双抗(青霉素和链霉素)及10%胎牛血清的M5A(美国Gibco公司)完全培养基中并置于普通细胞培养箱中培养,正常培养及传代。
1.3 CCK-8实验检测细胞存活率
取对数期生长的细胞,根据培养时间接种不同数量的细胞密度,HHT 处理24 h 的接种5000 个/孔、处理48 h 的4000个/孔、处理72 h的3000个/孔的密度接种于96孔板,待细胞贴壁后,每孔加入不同浓度HHT处理,设置浓度梯度为0、10、20、50、100 ng/mL,每个浓度设置5个复孔。将96孔板放入培养箱内,分别在24、48、72 h后取出,吸出培养液加入含10%CCK-8 的培养基,放入细胞培养箱,2 h 后使用酶标仪检测450 nm 波长处的吸光度值,计算细胞存活率。细胞存活率计算公式:细胞存活率=(实验组吸光度值-空白对照组吸光度值)/(对照组吸光度值-空白对照组吸光度值)。
1.4 细胞集落实验检测细胞集落形成情况
取对数生长期的143b 细胞取500 个/孔接种于6 孔板、取对数生长期的U2-OS的2000个/孔接种于6孔板,培养1 d后,加入不同浓度HHT,处理24 h后,PBS洗涤液继续用完全培养基培养14 d;PBS清洗4%多聚甲醛固定15 min后结晶紫染液染色,去尽染液、PBS清洗,干燥后拍照计数。
1.5 细胞划痕实验检测细胞迁移情况
取对数生长期的细胞以3×105/孔接种于6孔板,待细胞长满后,然后用无菌移液器枪头在6孔板每孔划出4条平行线;吸弃孔内培养基,PBS洗涤,加入含有不同浓度HHT的1%血清培养基培养,分别在0 h和24 h通过倒置显微镜拍摄计算细胞迁移率。计算公式:细胞划痕愈合率=(0 h划痕宽度-培养后划痕宽度)/0 h 划痕宽度×100%;细胞迁移率=实验组划痕愈合率/对照组划痕愈合率。
1.6 Transwell实验检测细胞侵袭情况
在4℃条件下将Matrigel胶用无血清的细胞培养基稀释至300 μL/mL,取100 μL 均匀涂抹一层于细胞培养池的PET膜上表面,然后将培养池轻轻放入24孔板孔内,37℃放置3 h左右;取出于超净工作台过夜干燥。取对数生长期的细胞,取1×105/mL浓度的细胞200 μL加入上室;下室加入含不同浓度HHT的培养基500 μL,继续在孵箱内培养24 h;将其下表面浸泡在4%多聚甲醛溶液中,固定30 min,PBS洗涤后用结晶紫染色,充分洗涤后通过倒置显微镜拍摄,并计算膜下表面的细胞数。
1.7 流式细胞术检测细胞凋亡水平及周期分布
取对数生长期的细胞,取2×105个细胞接种于6 孔板,待细胞贴壁后加入含不同浓度HHT的完全培养基,24 h后使用碧云天试剂盒检测细胞凋亡水平及周期分布。
1.8 PCR验证casp3和casp8表达
提取总RNA,逆转录成cDNA,再进行qRT-PCR 逆转录扩增检测,应用SYBR Green I荧光染料技术进行实时定量PCR反应,获取各组标准曲线,计算并分析结果值。引物序列如下,casp3 F:CTTGGCGAAATTCAAAGGATGG,R:CCCGGGTAAGAATGTGCATAA;casp8 F:AGAGATGGAGAAGAGGGTCAT,R:CAGCAGGCTCTTGTTGATTTG。
1.9 统计学方法
采用SPSS 19.0统计学软件对实验数据进行统计学分析。计量资料用均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HHT对骨肉瘤细胞存活率的影响
分别在不同药物浓度(0、10、20、50、100 ng/mL)下用CCK-8 检测并计算细胞存活率,如图1 所示,24 h 50%抑制浓度在50 ~100 ng/mL之间,72 h 50%抑制浓度在20 ~50 ng/mL 之间。与对照组相比,随着浓度增大,HHT对骨肉瘤细胞的抑制效果增强,各组间比较差异具有统计学意义(P<0.05)。
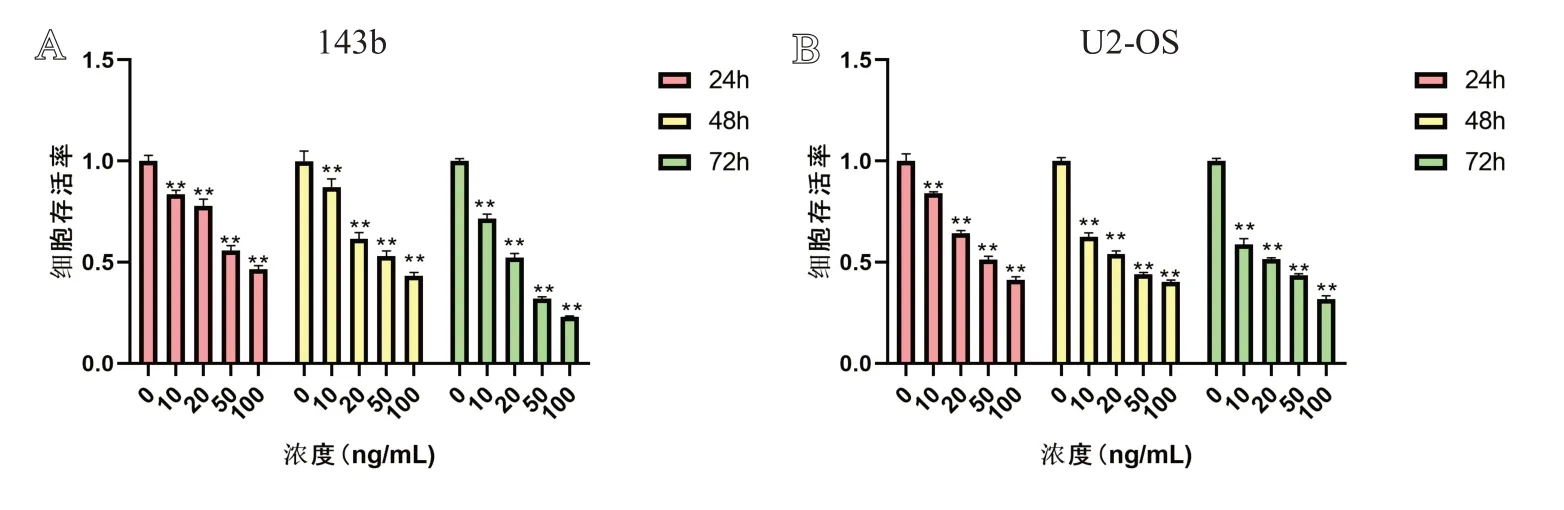
图1 CCK-8实验:A.143b细胞经过不同浓度(0、10、20、50、100 ng/mL)培养24、48、72 h后测量的细胞存活率;B.U2-OS细胞经过不同浓度(0、10、20、50、100 ng/mL)培养24、48、72 h后测量的细胞存活率
2.2 HHT对骨肉瘤细胞集落形成的影响
通过细胞克隆实验探讨不同浓度HHT作用下骨肉瘤细胞系143b和U2-OS的集落形成的变化,如图2所示,HHT可以减少143b 和U2-OS 的集落形成数目,且随着HHT 浓度增大,形成的集落面积逐渐减小。如图2A 所示,在143b中,当浓度为20 ng/mL时,克隆数目与对照组比值为69.92%±0.73%;当HHT 浓度为50 ng/mL 时,克隆数目与对照组比值为15.52%±1.36%;当HHT 浓度为100 ng/mL时,克隆数目与对照组比值为3.59%±0.26%。如图2B 所示,在U2-OS 中,当浓度为20 ng/mL 时,克隆数目与对照组比值为41.24%±1.71%;当HHT 浓度为50 ng/mL 时,克隆数目与对照组比值为12.11%±1.24%;当HHT 浓度为100 ng/mL 时,克隆数目与对照组比值为3.30%±0.53%。随着浓度增高,HHT对骨肉瘤细胞的集落形成抑制作用逐渐增强,表明HHT对骨肉瘤集落形成的抑制作用存在剂量相关性,各组间比较,差异具有统计学意义(P<0.01)。

图2 集落形成实验:A.143b集落形成实验及定量分析;B.U2-OS集落形成实验及定量分析,浓度分别为0、20、50、100 ng/mL
2.3 HHT对骨肉瘤细胞系的迁移能力的影响
通过划痕实验检测骨肉瘤细胞系143b和U2-OS的迁移距离。如图3 所示,在143b 和U2-OS 细胞的划痕实验中,对照组中可见143b 及U2-OS 细胞迁移率较实验组迁移率高。随着HHT浓度增加,骨肉瘤细胞迁移率逐渐减小。如图3A所示,在143b中,当浓度为20 ng/mL时,迁移率与对照组比值为48.54%±4.59%;当HHT浓度为50 ng/mL时,迁移率与对照组比值为27.72%±1.81%;当HHT浓度为100 ng/mL时,迁移率与对照组比值为13.37%±0.95%。如图3B所示,在U2-OS中,当浓度为20 ng/mL时,迁移率与对照组比值为81.16%±1.45%;当HHT浓度为50 ng/mL时,迁移率与对照组比值为24.35%±3.79%;当HHT 浓度为100 ng/mL 时,迁移率与对照组比值为6.52%±1.25%。随着浓度增高,HHT 对骨肉瘤细胞的迁移能力抑制作用逐渐增强,表明HHT 对骨肉瘤迁移能力的抑制作用存在剂量相关性,各组间比较,差异具有统计学意义(P<0.01)。

图3 划痕实验:A.143b划痕实验及对应迁移率;B.U2-OS划痕实验及对应迁移率
2.4 HHT对骨肉瘤细胞系侵袭能力的影响
通过Transwell 实验检测骨肉瘤细胞系143b 和U2-OS穿过Transwell 小室的细胞数目,如图4 所示,随着HHT浓度增加,细胞数目逐渐减少。如图4A 所示,在143b中,当浓度为20 ng/mL 时,细胞数目与对照组比值为31.79%±2.60%;当HHT 浓度为50 ng/mL 时,细胞数目与对照组比值为10.18%±0.99%;当HHT浓度为100 ng/mL时,细胞数目与对照组比值为1.33%±0.23%。如图4B所示,在U2-OS 中,当浓度为20 ng/mL 时,细胞数目与对照组比值为28.16%±4.71%;当HHT 浓度为50 ng/mL 时,细胞数目与对照组比值为6.58%±0.97%;当HHT浓度为100 ng/mL时,细胞数目与对照组比值为2.20%±0.38%。随着浓度增高,HHT 对骨肉瘤细胞的侵袭能力抑制作用逐渐增强,表明HHT 对骨肉瘤侵袭能力的抑制作用存在剂量相关性,各组间比较,差异具有统计学意义(P<0.01)。

图4 Transwell实验:A.143b的Transwell实验;B.U2-OS的Transwell实验
2.5 HHT对骨肉瘤细胞凋亡水平和周期分布的影响
通过流式细胞技术检测骨肉瘤细胞系143b和U2-OS的凋亡水平及周期分布,结果如图5所示,HHT对143b细胞和U2-OS细胞的凋亡水平存在剂量相关性。如图5A所示,HHT在0、20、50、100 ng/mL浓度下,143b对应的凋亡率为5.57%±1.92%、19.74%±1.18%、27.92%±1.83%、59.15%±5.33%;如图5B所示,HHT在0、20、50、100 ng/mL浓度下,U2-OS对应的细胞凋亡率为7.97%±0.88%、16.16%±1.35%、21.85%±2.87%、34.76%±2.24%。随着HHT 浓度增加,骨肉瘤细胞143b和U2-OS的凋亡率也增加,该差异存在统计学意义,P<0.01。如图5C和5D所示,HHT对143b和U2-OS的周期分布差异无统计学意义(P>0.05)。
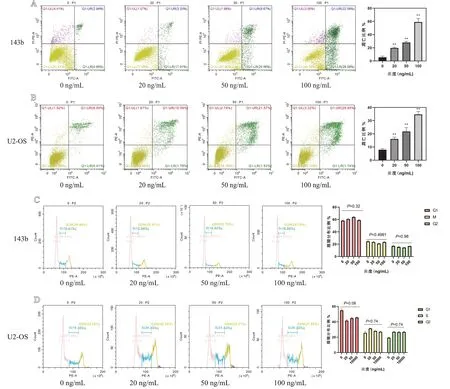
图5 流式细胞技术:A.143b凋亡实验;B.U2-OS凋亡实验;C.143b周期检测;D.U2-OS周期检测
2.6 HHT对骨肉瘤细胞中casp3和casp8表达的影响
为进一步探讨HHT 对骨肉瘤细胞系作用的可能机制,笔者检测了经过HHT 处理后的骨肉瘤细胞系中casp3 和casp8 的表达差异。如图6 所示,RT-qPCR 实验结果证实,HHT 处理后的骨肉瘤细胞系中casp3 和casp8 的表达均增加,差异具有统计学意义(P<0.01)。

图6 实时定量PCR实验:A.不同浓度(0、20、50、100 ng/mL)HHT处理143b 24 h后casp3和casp8的相对表达量;B.不同浓度(0、20、50、100 ng/mL)HHT处理U2-OS 24 h后casp3和casp8的相对表达量
3 讨论
骨肉瘤的治疗需要根据骨肉瘤的分期和病理结果提示的恶性程度选择治疗方案,理想目标是根治或者大范围切除肿瘤,尽可能保留肢体功能[2,17]。目前,较常应用于骨肉瘤治疗的化疗药物包括顺铂、多柔比星、甲氨蝶呤、异环磷酰胺等化疗药物及放疗等手段,但是对骨肉瘤易耐药或部分临床疗效差的问题仍未解决[7,18]。
自古以来,人们就认识到植物的治疗特性,许多病理状况已经用植物来源的药物进行了治疗,这些药物被用作混合物或浓缩的植物提取物,而现代医学需要分离和纯化一种或两种活性化合物[19]。现有研究已证实,多种植物提取物可以在骨肉瘤中发挥抗肿瘤作用,如左旋含羞草碱可以通过调控细胞DNA损伤修复相关蛋白发挥对骨肉瘤细胞系MG-63和U2-OS的抗骨肉瘤作用[20],也有研究表明黄豆苷元可以通过Src-ERK通路发挥抗骨肉瘤作用[21]。HHT 作为一种抗肿瘤药物已经应用于临床,在治疗各型急慢性淋巴细胞白血病、骨髓增生异常综合征、急性粒细胞白血病中具有一定的治疗效果[10-11,22]。通过现有研究表明,HHT对多种实体肿瘤也具有一定的抗肿瘤作用,如乳腺癌、结直肠癌、肺癌、黑色素瘤等[14,23-25]。而在黑色素瘤的研究中,HHT可以介导肿瘤细胞的DNA损伤、促进肿瘤细胞的凋亡等,同时,casp3的表达增高,与本研究结果相符[24]。
半胱天冬酶3(casp3)和半胱天冬酶8(casp8)是细胞凋亡中重要的蛋白酶,在细胞凋亡过程中casp3 和casp8被激活。而当肿瘤细胞暴露在细胞毒性物质、射线及肿瘤的免疫治疗中,casp3 和casp8 的激活可以促进细胞凋亡[26-28]。近年来,有研究报道在HER2 突变的乳腺癌中,HER2 通过下调casp3 和casp8 抑制肿瘤细胞的凋亡[29]。总的来说,针对casp3 和casp8 的治疗,不仅可以提高如HCT、HT29 和MBA MD231 等肿瘤细胞放化疗的敏感程度,也可以抑制其增殖和迁移能力等。本研究也证实HHT对骨肉瘤细胞系也存在抗肿瘤作用,可以促进casp3 和casp8的表达,抑制骨肉瘤细胞的增殖、迁移能力,诱导细胞的凋亡等。有研究表明,casp3可以通过多种作用机制影响肿瘤细胞的增殖凋亡,随着放疗剂量的增加,casp3的表达明显增加,细胞凋亡明显增加,casp3-/-的肿瘤细胞凋亡数目明显下降,证实了casp3 在肿瘤凋亡中的重要作用[27]。同时,药物之间的协同作用可以增强部分药物的抗肿瘤效果。有研究证明,紫草素可以通过上调凋亡相关通路中casp3 及casp8 的表达,进而增强阿霉素对骨肉瘤细胞系U2-OS 及MG63 的抗肿瘤效果[30]。类似的,在本研究中,HHT 处理后的骨肉瘤细胞的casp3 及casp8 表达也明显上调,同时凋亡比例随着浓度增大而增大,表明HHT可能通过上调casp3及casp8通路进而导致骨肉瘤细胞凋亡。
本研究证实了HHT对骨肉瘤细胞系的抗肿瘤作用,但是由于缺乏动物实验模型及后期临床的进一步验证,该研究还存在一定的局限性。由于骨肉瘤的异质性,在临床的诊断和治疗都具有一定的难度[31],在本实验中,由于使用的为骨肉瘤细胞系,实验对象的异质性与临床患者具有一定差异,目前较为理想的解决方法为使用患者来源的移植瘤动物模型[32-33]。同时,由于本研究并未对细胞系进行测序,未全面研究HHT影响骨肉瘤细胞系的作用机制,仅探讨了部分可能的作用机制。本研究表明HHT可以显著抑制骨肉瘤细胞系的增殖、迁移、侵袭及克隆形成能力,与既往HHT在乳腺癌等实体瘤中具有相似的表型[14,23-25]。
综上所述,研究证明高三尖杉酯碱可通过上调casp3及casp8 的表达,促进骨肉瘤细胞凋亡,抑制骨肉瘤细胞的增殖、迁移及侵袭等,提示高三尖杉酯碱可能是潜在的抗骨肉瘤药物,可以为骨肉瘤治疗提供新的思路。
