基于环氧合酶-2通路探讨葛花解酲汤治疗慢性酒精中毒的作用机制
2022-08-17王夕丹孙良颖王林江张月华
王夕丹 周 悦 路 旭 孙良颖 王林江 尹 瑶 张月华
(贵州省六盘水市人民医院,六盘水,553000)
酒精中毒会导致严重的急性和长期毒性,包括中枢抑制、酒精性肝病、心脏病和痴呆等[1]。相关研究表明,酒精代谢会产生大量的产物乙醛,它是引起酒精中毒的主要原因[2]。长期饮酒会损伤组织中的各种正常细胞,比较常见的癫痫、酒精中毒性脑病和酒精中毒性精神障碍等,慢性酒精中毒的作用机制比较复杂,但相关机制尚不完全清楚。环氧合酶-2(Cyclooxygenase-2,COX-2)是花生四烯酸代谢过程中的限速酶[3],它具有双功能酶的活性,兼有COX活性和过氧化氢酶活性[4]。COX-2在多种肿瘤类型中,如肺癌、前列腺癌、胰腺癌和结肠癌等肿瘤中表达升高,属于一种致癌因子[5]。COX-2过表达与肿瘤细胞的侵袭、迁移、增殖和凋亡等生物学关系密切[6]。葛花解酲汤全方由13味药组成,主要有葛花、干姜、白蔻仁、砂仁、陈皮、青皮、泽泻、茯苓、木香、猪苓、神曲、白术和人参组成,全方具有清热解毒、疏肝利胆的功效,使酒湿得去,诸症自解[7]。关于葛花解酲汤基于COX-2通路治疗慢性酒精中毒的作用机制尚未见报道,所以本研究主要探讨葛花解酲汤基于COX-2通路治疗慢性酒精中毒的作用机制,为临床慢性酒精中毒的治疗提供可靠依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级雄性C57BL/6J小鼠60只,体质量18~22 g,6~8周龄,由湖南斯莱克景达实验动物有限公司提供,生产许可证号:SCXK(湘)2019-003,合格证号:837236。动物伦理审批号:20190326。小鼠放于室温为23~26 ℃,湿度为45%~60%,自然光照下培养,并给予充足的食物和饮水,在新环境下适用7 d进行后续实验研究。
1.1.2 药物 葛花解酲汤药方由葛花15 g、干姜10 g、白蔻仁10 g、砂仁10 g、陈皮10 g、青皮10 g、泽泻10 g、茯苓10 g、木香10 g、猪苓10 g、神曲10 g、白术10 g、人参10 g组成,并含生药1.63 g/mL,均购自于黑龙江中医药大学门诊部。加入10倍的清水浸泡2 h,再进行煮沸1 h,滤过后,剩余的药渣再用清水煮沸1 h,滤过后,滤液合并,用旋转蒸发仪浓缩为含生药1 g/mL的药液,保存备用。
1.1.3 试剂和仪器 多聚甲醛、Trizol试剂(生工生物工程有限公司,货号:BC3654.BC3722),石蜡(上海华永石蜡有限公司,货号:SC364662),β-内啡肽ELISA试剂盒(南京森贝伽生物科技有限公司,货号:C20170629),L-半胱氨酸(Sigma公司,美国,货号:EPR970304),醋酸锌(北京化学试剂公司,货号:E20190514),无水乙醇(福州迈新生物技术开发有限公司,货号:A0030509),GSH试剂盒、GST试剂盒和T-AOC试剂盒(南京建成生物技术有限公司,货号:C402024,C502017,C502009);酶标仪(Bio-Tek公司,美国,型号:Bio-Tek ELx800),低温离心机(ThermoFisher公司,美国,型号:SuperT21),切片机(LEICA公司,德国,型号:RM2035),离心机(北京医用离心机厂,型号:LDZ4)。
1.2 方法
1.2.1 分组与模型制备 将60只C57BL/6J小鼠随机分为5组,分别为正常组、模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组,每组12只。除正常组外,其余4组分别饮用6%乙醇水溶液,连续28 d。
1.2.2 给药方法 按照《中华人民共和国药典》标准,实验小鼠用的中药均为人体用量的10倍,建模成功的第14天后,对低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组的小鼠使用葛花解酲汤灌胃,1次/d,低剂量葛花解酲汤组每天10 mg/kg,中剂量葛花解酲汤组每天20 mg/kg,高剂量葛花解酲汤组每天40 mg/kg,正常组以10 mg/kg的生理盐水灌胃,连续14 d。处死的前1 d禁食,正常饮水,再以6%水合氯醛腹腔注射麻醉后,取出脑组织和肝组织。
1.2.3 组织学检查 脑组织和肝组织采用甲醛固定,脱水、石蜡包埋、切成4 μm的切片,苏木精-伊红(Hematoxylin Eosin,HE)染色,随机选取6个视野,观察脑组织和肝脏组织的形态学变化。
1.2.4 Western Blotting检测COX-2蛋白的表达 每组脑组织和肝脏组织样本50 mg,提取总蛋白,电泳处理,并与胰蛋白酶提取液按照1∶100进行混合,进行裂解,加入COX-2抗体,在4 ℃的情况下孵育过夜,在加入1∶100的辣根过氧化物酶标记二抗,常温下孵育2 h,在暗室中显影,以β-肌动蛋白作为内参,采用Quantity One软件评估COX-2蛋白的表达水平。
1.2.5 δ阿片受体(Delta Opioid Receptor,DOR)mRNA和β-内啡肽测定 取冻存组织放入研钵中,离心管中加入1 mL Trizol试剂,提取总RNA,反转录试剂盒合成cDNA,DOR mRNA上游5′-TGGGTTGGTTGACGC-3′,下游5′-GCAGTAGGCTATCCGT-3′,β-actin作为内参,异物序列为上游5′-TCCAGCATACTGACAGC-3′,下游5′-GTATGGCCTACAGGAGTA-3′,PCR条件:95 ℃ 3 min,75 ℃ 30 s,55 ℃ 20 s,共计45个循环。测定β-内啡肽使用ELISA试剂盒,取96孔板,加入脑组织匀浆上清液样品100 μL,反应30 min,加入酶标工作液100 μL,反应10 min,加入显色溶液,反应10 min,再加入终止反应溶液50 μL,酶标仪在450 nm测量各孔的OD值,按照标准品吸光度值绘制曲线,并就计算β-内啡肽水平。
1.2.6 胱硫醚β-合酶(Cystathionine Beta-synthase,CBS)活性和H2S水平测定 取液氮冻存的小鼠脑组织制备匀浆放在25 mL锥形瓶中,加入L-半胱氨酸和5-磷酸吡哆醛,石蜡封口,90 min后,醋酸锌和硫离子充分反应生成硫酸锌沉淀,加入10%三氯醋酸lmL使蛋白沉淀,弃上清液,全自动酶标仪检测CBS活性。分光光度法间接测定小鼠纹状体、左右海马、前脑皮质中H2S水平,将磷酸盐缓冲液倒入研磨器内,并放入脑组织,在冰上研磨,离心处理,使醋酸锌和硫离子充分反应生成硫酸锌沉淀物,室温孵育20 min,吸出上清液,用酶标仪检测H2S的水平。
1.2.7 乙醇脱氢酶(Alcohol Dehydrogenase,ADH)和乙醛脱氢酶(Aldehyde Dehydrogenase,ALDH)活性测定 催化乙醇的脱氢反应生成乙醛,在取1.5 mL的pH8.8的焦磷酸钠缓冲液与NAD+溶液和乙醇溶液混匀,室温孵育10 min,在放入小鼠肝组织,倒入比色皿,340 nm波长下,采用分光光度计测OD值,ADH和ADLH的活力以NADH每分钟生成量(μmo1/min)表示。
1.2.8 抗氧化指标测定 采用化学比色法测定小鼠肝脏中谷胱甘肽(Glutathione,GSH)、谷胱甘肽转硫酶(Glutathione S-transferase,GST)和总抗氧化能力(Total Antioxidant Capacity,T-AOC)的水平,严格按照试剂盒的操作使用说明进行严格操作。
2 结果
2.1 葛花解酲汤对慢性酒精中毒小鼠组织形态学的影响 小鼠海马回C1区组织形态学结果显示,正常组的椎体细胞层次清晰,结构完整,细胞核清晰,排列规则;模型组椎体细胞层次不规则,细胞固缩变形,并出现水肿、坏死和溶解现象。经过葛花解酲汤干预后,低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组的椎体细胞均有所改善,高剂量葛花解酲汤组改善最为明显,细胞核清晰可见,排列有序,个别细胞水肿体积增大,轻度固缩,但整体接近正常。见图1A。肝组织的病理切片显示,正常组的肝小叶结构完整,中央静脉周围呈放射状排列的肝细胞索,彼此连接成网状;模型组表现出明显的微血管脂肪变性和坏死;经过低剂量、中剂量和高剂量的葛花解酲汤干预后,均出现了不同的改善,但高剂量葛花解酲汤组改善最为明显,阻止了空泡的形成,微血管脂肪变性和坏死有明显的改善。见图1B。
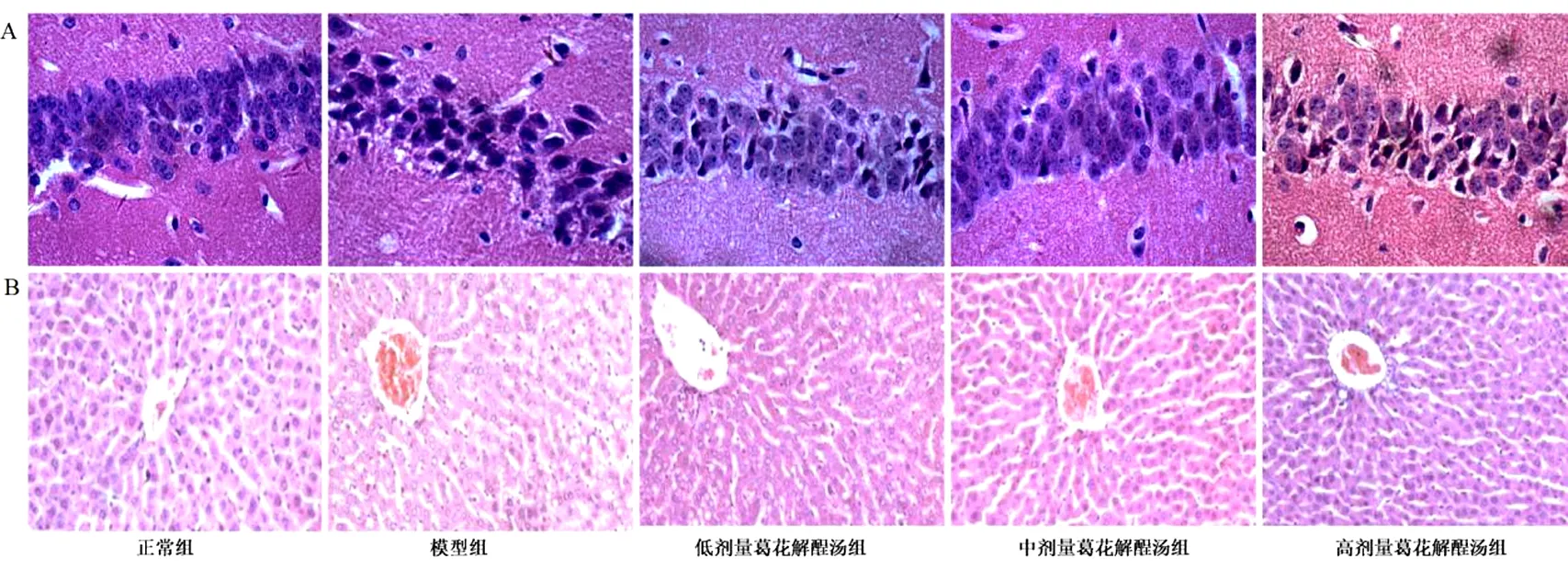
图1 各组小鼠组织形态学变化(HE染色,×400)
2.2 葛花解酲汤对小鼠组织中COX-2蛋白的影响 模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中COX-2蛋白水平显著明显高于正常组(P<0.05),低剂量葛花解酲汤组中COX-2蛋白水平显著低于模型组(P<0.05),中剂量葛花解酲汤组中COX-2蛋白水平明显低于低剂量葛花解酲汤组,高剂量葛花解酲汤组COX-2蛋白水平显著低于中剂量葛花解酲汤组(P<0.05)。见表1。
表1 各组小鼠组织中COX-2蛋白水平比较
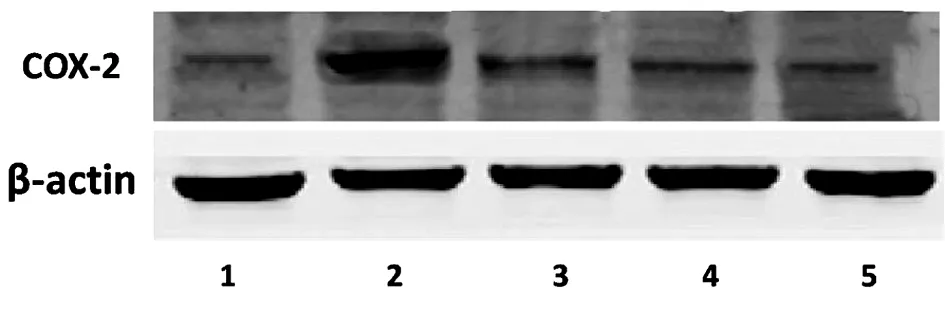
图2 各组小鼠组织中COX-2蛋白表达
2.3 葛花解酲汤对慢性酒精中毒小鼠脑组织DOR mRNA和β-内啡肽的影响 模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中DOR mRNA和β-内啡肽的水平显著明显高于正常组(P<0.05),低剂量葛花解酲汤组中DOR mRNA和β-内啡肽的水平显著低于模型组(P<0.05),中剂量葛花解酲汤组中DOR mRNA和β-内啡肽的水平明显低于低剂量葛花解酲汤组,高剂量葛花解酲汤组DOR mRNA和β-内啡肽的水平显著低于中剂量葛花解酲汤组(P<0.05)。见表2。
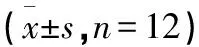
表2 各组小鼠脑组织DOR mRNA和β-内啡肽水平比较
2.4 葛花解酲汤对慢性酒精中毒小鼠脑组织CBS活性和H2S水平的影响 与正常组比较,模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中CBS活性和H2S水平明显升高(P<0.05),低剂量葛花解酲汤组中CBS活性和H2S水平显著低于模型组(P<0.05),中剂量葛花解酲汤组中CBS活性和H2S水平明显低于低剂量葛花解酲汤组,高剂量葛花解酲汤组CBS活性和H2S水平显著低于中剂量葛花解酲汤组(P<0.05)。见表3。
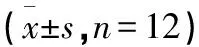
表3 各组小鼠CBS活性和H2S水平比较
2.5 葛花解酲汤对慢性酒精中毒小鼠肝组织ADH和ALDH活性的影响 模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组中ADH和ALDH活性较模型组相比明显降低(P<0.05),低剂量葛花解酲汤组中的ADH和ALDH活性较模型组相比显著升高(P<0.05),中剂量葛花解酲汤组中的ADH和ALDH活性与低剂量葛花解酲汤组相比显著下降(P<0.05),高剂量葛花解酲汤组的ADH活性与中剂量葛花解酲汤组相比明显降低(P<0.05),高剂量葛花解酲汤组的ALDH活性与中剂量葛花解酲汤组比较差异无统计学意义(P>0.05)。见表4。
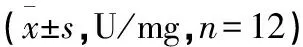
表4 各组小鼠ADH和ALDH活性 比较
2.6 葛花解酲汤对慢性酒精中毒小鼠肝脏中抗氧化指标的影响 与正常组比较,模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中GSH、GST和T-AOC水平显著降低(P<0.05),低剂量葛花解酲汤组中GSH、GST和T-AOC水平明显高于模型组(P<0.05),中剂量葛花解酲汤组中GSH、GST和T-AOC水平明显高于低剂量葛花解酲汤组,高剂量葛花解酲汤组GSH、GST和T-AOC水平显著高于中剂量葛花解酲汤组(P<0.05)。见表5。
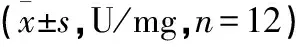
表5 各组小鼠抗氧化比较
3 讨论
慢性酒精中毒影响着人类的健康,近年来,随着人们生活水平的增加,慢性酒精中毒疾病的患病率逐渐增加。长期摄入酒精会导致小脑神经元和大脑新皮质、海马、基底前脑退行改变,这些部位属于记忆和学习活动中枢。相关研究表明,酒精可以导致记忆能力丧失和智能水平降低和相关的精神行为下降[8]。慢性酒精中毒主要表现为妄想、幻觉、震颤以及痴呆等,为了提高慢性酒精中毒的治疗水平,需要建立对应的动物模型的模拟发病机制,以寻找有效的治疗药物。研究表明,慢性酒精中毒对脑部产生不同程度的损害,比如脂质过氧化反应、氧化应激等可能是引起脑损伤的主要原因,从而致使出现相应的临床表现[9]。葛花解酲汤具有温中健脾、分消酒湿,治嗜酒中虚、头痛心烦、小便不利、大便泄泻、眩晕呕吐的作用[10]。相关研究也表明,葛花解酲汤具有保肝健脾的作用[11]。葛花解酲汤治疗乙醇中毒的相关报道较多,但基于COX-2通路探讨葛花解酲汤治疗慢性酒精中毒的作用机制相关报道较少,所以本研究探讨葛花解酲汤对COX-2通路的影响,并对慢性酒精中毒后与脑部和肝脏部的相关指标进行分析。
COX-2是一种炎症介质,COX-2通路与肿瘤的形成和发展密切相关。相关研究表明,有关炎症或者癌症相关的疾病主要集中在COX-2通路上,COX-2通路在许多癌症中作为新靶向研究,包括结肠癌、前列腺癌、结肠癌和口腔癌等[12]。也有研究表明,COX-2在炎症刺激的诱导下,水平明显升高[13]。研究表明,COX-2的过表达在退行性疾病的发生、发展中起非常重要的作用[14]。本研究结果表明,模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中COX-2蛋白水平显著明显高于正常组,低剂量葛花解酲汤组中COX-2蛋白水平显著低于模型组,中剂量葛花解酲汤组中COX-2蛋白水平明显低于低剂量葛花解酲汤组,高剂量葛花解酲汤组COX-2蛋白水平显著低于中剂量葛花解酲汤组。说明COX-2蛋白水平在慢性酒精中毒的小鼠中表达升高,经过不同剂量的葛花解酲汤治疗后,COX-2蛋白水平明显降低。相关研究推测,慢性酒精中毒患者血清中COX-2水平可能升高,COX-2水平的升高可破坏血脑屏障[15]。
β-内啡肽是一种内源性阿片肽,在应激状态下会大量释放。相关研究表明,酒精会促进大鼠下丘脑β-内啡肽的释放[16]。DOR属于阿片肽受体,过量饮酒会致使β-内啡肽增加和DOR基因的表达量上升。本研究结果表明,模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中DOR mRNA和β-内啡肽的水平显著明显高于正常组。所以说明不同剂量的葛花解酲汤可以明显降低DOR mRNA和β-内啡肽的水平。H2S是一种气体信号分子,当H2S水平达到生理水平时,可以造成不良反应,乙醇代谢产物乙醛的增加可以介导钙离子运行,促使氧自由基的产生,损伤神经系统的胶质细胞。CBS能够催化H2S生成的调节酶[17]。本研究表明,低剂量葛花解酲汤组中CBS活性和H2S水平显著低于模型组,中剂量葛花解酲汤组中CBS活性和H2S水平明显低于低剂量葛花解酲汤组,高剂量葛花解酲汤组CBS活性和H2S水平显著低于中剂量葛花解酲汤组。所以说明不同剂量的葛花解酲汤可以改善CBS活性和H2S水平。模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组中ADH和ALDH活性较模型组相比明显降低。与正常组相比,模型组、低剂量葛花解酲汤组、中剂量葛花解酲汤组和高剂量葛花解酲汤组中GSH、GST和T-AOC水平显著降低。ADH是肝代谢酒精的主要途径,酒精首先被ADH氧化成乙醛,乙醛在经过ALDH被氧化成乙酸,乙酸是对人体无害的一种物质,最后被分解成二氧化碳和水[18],所以说长期饮酒会对肝脏中的ADH和ALDH的活性产生一定的影响,通过不同剂量葛花解酲汤治疗,ADH、ALDH活性和氧化应激指标均出现不同程度的改善。
综上所述,葛花解酲汤可以有效抑制COX-2通路,降低慢性酒精中毒小鼠脑组织DOR mRNA、β-内啡肽、CBS活性和H2S水平,显著提高慢性酒精中毒小鼠肝脏中的ADH和ALDH的活性,改善氧化应激指标,从根本上有效地改善了慢性酒精中毒小鼠的脑和肝脏组织损伤,具有一定的治疗作用。
