基于网络药理学的玉屏风散和褪黑素对免疫系统影响的作用机制研究
2022-08-17王华星李荣欣许筱颖
王华星 赵 凯 高 雪 李荣欣 许筱颖
(1 北京中医药大学中医学院,北京,102488; 2 首都医科大学中医药学院,北京,100069)
玉屏风散和褪黑素的临床使用在调节免疫系统中具有重要的意义。本研究使用网络药理学与动物实验联合的方法,以网络药理学全面检索褪黑素及玉屏风散可能作用于机体的免疫相关靶点及通路,以动物实验研究气温骤升骤降条件下,玉屏风散与褪黑素对老年小鼠白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)的预防性干预作用,以更好地指导临床精准用药及二者的联合使用。
1 材料与方法
1.1 材料
1.1.1 动物 84只雄性8周龄无特定病原体(Specific Pathogen Free,SPF)级昆明小鼠,购于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2016-0011。实验在北京中医药大学中医基础理论实验室进行。购入动物后,将昆明小鼠饲养在聚乙烯动物饲养箱中适应性饲养1周。小鼠均可自由摄食摄水。饲料为鼠全价维持饲料。动物房温度(20±2)℃,相对湿度50%,自然光照,动物伦理批号:BUCM-4-2018091101-3049。
1.1.2 药物 生黄芪、炒白术和防风均购置于北京中医药大学国医堂门诊部。褪黑素(上海生工生物工程股份有限公司,批号:A600605-0005)。
1.1.3 试剂与仪器 D-半乳糖(上海麦克林生化科技有限公司,批号:D810319);小鼠IL-1β、IL-6、TNF-α酶联免疫试剂盒(北京瑞格博科技发展有限公司,批号:20190629.60013M;20190629.60023M;20190629.60080H);人工智能气候模拟箱(宁波江南仪器厂,型号:RXZ-500D);酶标仪(Thermo Fisher Scientific公司,芬兰,型号:Thermo Multiskan MK3);全自动生化分析仪(Beckmancoulter公司,美国,型号:UniCel DxC 600 Synchron);洗板机(长春赛诺迈德医学技术有限责任公司,型号:Sunostik Sar-520B);低温高速离心机(Beckman公司,美国,型号:GS-15R);摇床(上海苏坤实业有限公司,型号:SKY-200B);漩涡仪(无锡天力机械制造有限公司,型号:TL96-A)。
1.2 方法
1.2.1 玉屏风散、褪黑素潜在靶点及共同潜在靶点的收集与筛选 依据《网络药理学评价方法指南》[1],在中医药生物信息学数据库SymMap(https://www.symmap.org/)中检索“黄芪”“白术”“防风”,P值设置为0.05,获得Targets列表。在韦恩图计算绘制工具中合并并保留唯一值,即为玉屏风散的潜在靶点。在比较毒理基因组学数据库[2](Comparative Toxicogenomics Database,CTD,http://ctdbase.org/)选择关键词“化学成分”(Chemicals),检索“褪黑素”(Melatonin),得到褪黑素的潜在作用靶点。将玉屏风散和褪黑素的靶点在韦恩图计算绘制工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)中取交集,获得玉屏风散-褪黑素的共同潜在靶点。
1.2.2 玉屏风散、褪黑素潜在靶点的基因本体(Gene Ontology,GO)免疫系统过程富集分析 将玉屏风散和褪黑素的潜在靶点分别导入Cytoscape 3.7.2软件及其中的cytoHubba插件、ClueGO插件[3-5],使用GO分析中的免疫系统过程(Immune System Process,ISP)富集分析。
1.2.3 玉屏风散、褪黑素潜在关键免疫靶点筛选 提取各ISP通路所涉及的相关靶点,作为玉屏风散、褪黑素的免疫通路相关靶点,并取其中ISP通路占比大于平均值者,分别作为玉屏风散和褪黑素的关键免疫靶点。选择物种“Homo Sapiens”,设置P<0.05,Kappa值为默认的0.4,分别得到玉屏风散、褪黑素所涉及的免疫通路,和这些免疫通路中的相关靶点,进行可视化处理和拓扑学分析,并筛选出关键免疫靶点。
1.2.4 关键免疫靶点蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建 将2组关键免疫靶点分别输入PPI网络功能富集分析数据库STRING(Protein-Protein Interaction Networks Functional Enrichment Analysis,https://string-db.org/)[6],在“生物体”(Organism)中选择“人类”(Homo Sapiens),得到2组关键免疫靶点分别构建的PPI网络,进行可视化处理。并使用Cytoscape基于节点度(Degree)、介数中心性(Betweenness Centrality,BC)、接近中心性(Closeness Centrality,CC)对该网络进行拓扑学分析。
1.2.5 京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析 将2组关键免疫靶点分别输入ClueGO并进行KEGG信号通路富集分析。选择物种“Homo Sapiens”,设置P<0.05,为了使结果分组显示更为清晰,设置Kappa值为0.6。
1.2.6 玉屏风散与褪黑素免疫功能分子机制的异同比较 将玉屏风散与褪黑素的免疫关键靶点进行比较,得到二者之间的异同。将玉屏风散与褪黑素的GO ISP通路、KEGG通路进行比较,得到二者免疫相关通路的异同。
1.2.7 溶液制备 中药复方参照出处《医方类聚》及现代常用组方,玉屏风散:生黄芪、炒白术、防风[7]。将上述药材经过煎煮浓缩为含有生药1 g/mL的药液,分别灌装后放4 ℃冰箱保存。
1.2.8 分组与模型制备 将适应性饲养后的小鼠用随机数字表法随机分组。按气温处理因素分为常温对照、气温骤降、气温骤升3项。
对每种气温处理,均以药物干预作为研究因素,即玉屏风散(Y)、褪黑素(T),每个因素各取2个水平,将2个因素交叉组合,使每个气温项下均得到4个观察组。2种药物均不用的组别以生理盐水灌胃作为对照组。
共得到3×4=12组,每组7只。每组具体编号为:C、CY、CT、CYT;L、LY、LT、LYT;H、HY、HT、HYT。
按组别将相应受试药物给小鼠灌胃6周。将玉屏风散煎剂分别给玉屏风散组(编号CY、LY、HY组)的小鼠按每次0.1 mL/(10 g),1次/d灌胃,每次灌胃0.4 mL;褪黑素用生理盐水稀释后给褪黑素组(编号CT、LT、HT组)按每次0.15 mg/(10 g),1次/d小鼠灌胃,灌胃0.2 mL/次;将上述剂量的玉屏风散煎剂与褪黑素混合给玉屏风散+褪黑素组(编号CYT、LYT、HYT组)的小鼠灌胃,每次灌胃0.6 mL的混合药液;对照组给予等量的生理盐水灌胃。
受试药物灌胃结束后,将小鼠按组别依次放入预先调试好的人工气候模拟箱中进行气温干预。气温骤降从30 ℃在30 min内下降到8 ℃,气温骤升从8 ℃在30 min内上升至30 ℃,相对湿度保持自然条件湿度,光照时间参照自然光照,持续10 h。
1.2.9 IL-1β、IL-6、TNF-α检测 试验干预完成后,所有小鼠禁食禁水12 h后进行摘眼球取血1 mL左右,将血液用低温高速离心机以4 ℃,3 000 r/min,离心半径10 cm的条件下离心15 min,分离上清液,保存于-80 ℃冰箱。小鼠血清IL-1β、IL-6、TNF-α使用酶联免疫吸附测定法检测,经过洗液配制、孵育、洗液洗孔、显色等步骤,用酶标仪读取数值。
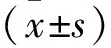
2 结果
2.1 玉屏风散、褪黑素潜在靶点及共同潜在靶点 从SymMap数据库中共检索到黄芪、白术、防风可能的作用靶点240个、46个、137个,将此三味中药的靶点去重后得到玉屏风散的潜在作用靶点共计339个。从CTD数据库中检索到的褪黑素的潜在靶点325个。将玉屏风散和褪黑素的靶点用韦恩图处理并取交集之后,得到二者共同的潜在作用靶点85个。见图1。
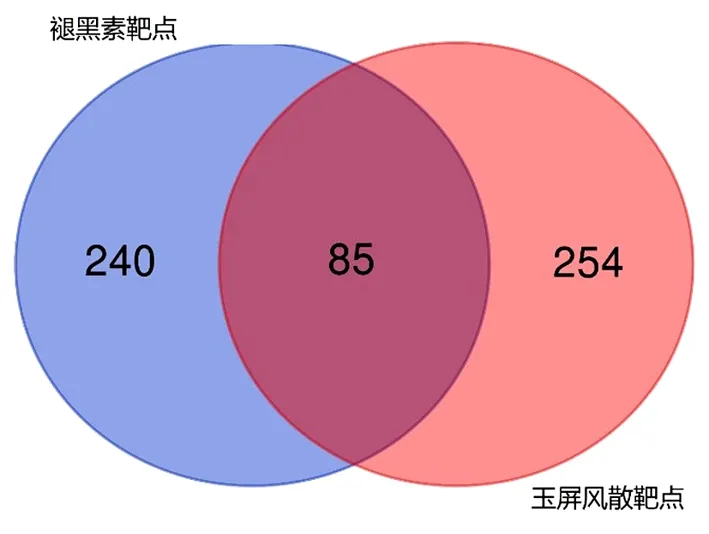
图1 玉屏风散和褪黑素的共同潜在靶点预测
2.2 玉屏风散、褪黑素潜在靶点的GO免疫系统过程富集分析 将玉屏风散的339个潜在靶点和褪黑素的325个潜在靶点进行富集分析,结果显示,玉屏风散涉及免疫过程11条(P<0.05),共分为了6类(Kappa=0.4)。见图2~3。其中白细胞分化(Leukocyte Differentiation)、T细胞活化(T Cell Activation)、淋巴细胞增殖(Lymphocyte Proliferation)、淋巴细胞增殖的调控(Regulation of Lymphocyte Proliferation)、T细胞增殖(T Cell Proliferation)等通路的基因占比位居前列;而白细胞迁移的正向调控(Positive Regulation of Leukocyte Migration)、未成熟T细胞的增殖(Immature T Cell Proliferation)、未成熟T细胞增殖的调控(Regulation of Immature T Cell Proliferation)、抗原刺激下慢性炎症反应的调控(Regulation of Chronic Inflammatory Response to Antigenic Stimulus)是其相对于褪黑素而言独有的免疫系统过程。褪黑素涉及免疫过程32条(P<0.05),共分为了11类(Kappa=0.4)。见图4~5。其中造血功能(Hemopoiesis)、白细胞分化(Leukocyte Differentiation)、T细胞活化(T Cell Activation)、骨髓细胞分化(Myeloid Cell Differentiation)、骨髓白细胞分化(Myeloid Leukocyte Differentiation)等通路的基因占比位居前列;而造血功能(Hemopoiesis)、骨髓细胞分化(Myeloid Cell Differentiation)、骨髓白细胞分化(Myeloid Leukocyte Differentiation)、T细胞活化的调控(Regulation of T Cell Activation)等通路是其相对于玉屏风散而言特有的免疫系统过程。
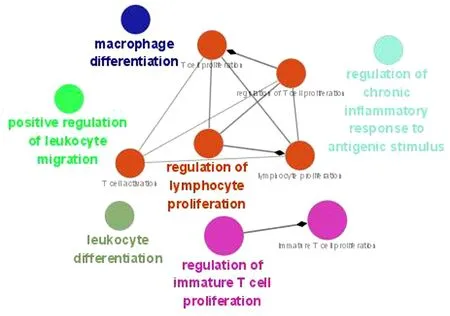
图2 玉屏风散GO免疫系统过程富集分析结果
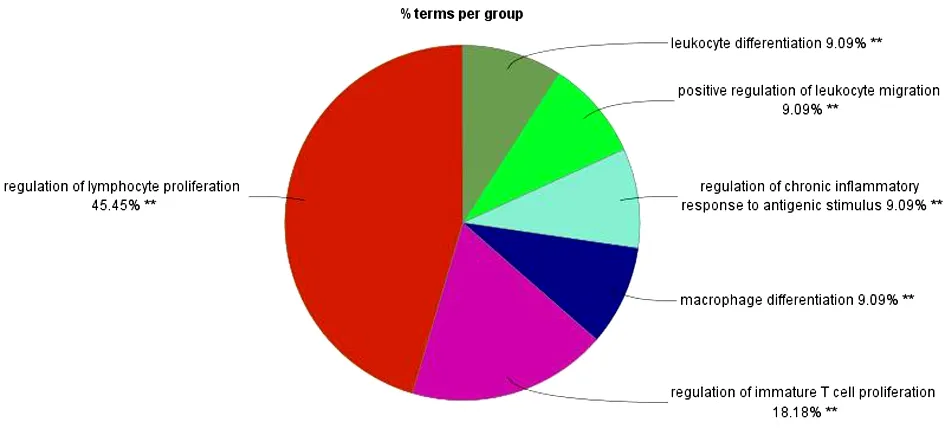
图3 玉屏风散GO免疫系统过程富集分析的分类
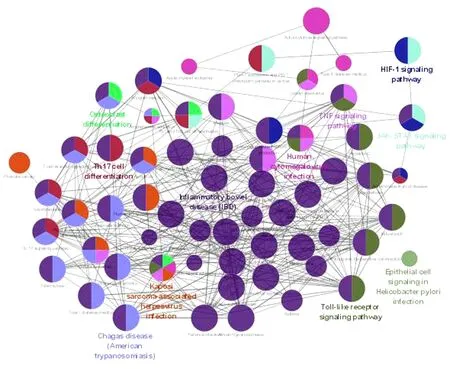
图4 褪黑素GO免疫系统过程富集分析结果
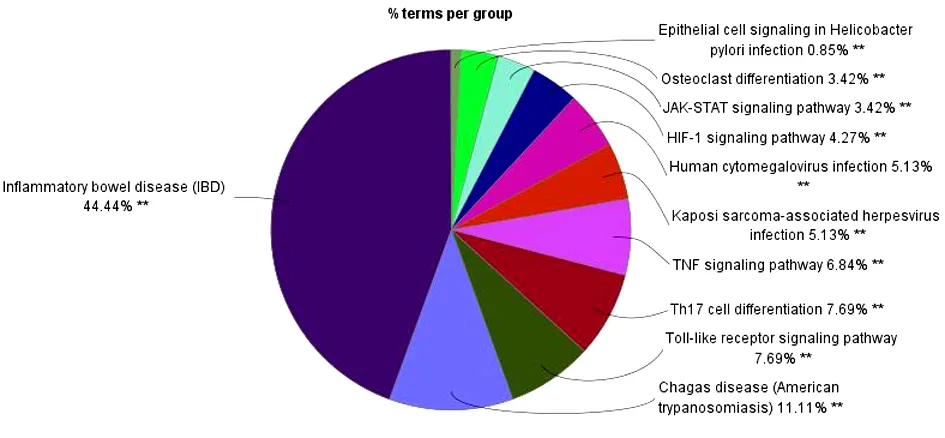
图5 褪黑素GO免疫系统过程富集的分类
2.3 玉屏风散、褪黑素的关键免疫靶点 提取上述ISP通路所涉及全部靶点,得到玉屏风散、褪黑素的免疫通路相关靶点分别有62个、84个,靶点涉及的ISP通路数目(通路数)平均值分别为3.097/11条、7.143/32条。将ISP通路占比高于平均值的靶点分别作为玉屏风散、褪黑素的关键免疫靶点,得到关键免疫靶点20个、32个。其中玉屏风散的免疫靶点中通路占比最高的依次为BMP4、TGFB1、IL1B、CDKN2A、ERBB2等,褪黑素中通路占比最高的依次为IL4、TGFB1、IFNG、HMGB1、RORA等,二者共有的关键免疫靶点包括TGFB1、IL1B、IL4、IL6、IL10、CASP3和BCL2。
2.4 玉屏风散、褪黑素关键免疫靶点的PPI网络 由STRING分析得知,玉屏风散的20个关键免疫靶点共产生了82条边,平均节点度8.2,平均局部聚类系数0.742,P<0.01。见图6。褪黑素的32个关键免疫靶点共产生了251条边,平均节点度15.7,平均局部聚类系数0.778,P<0.01。二者均具有显著的差异。见图7。
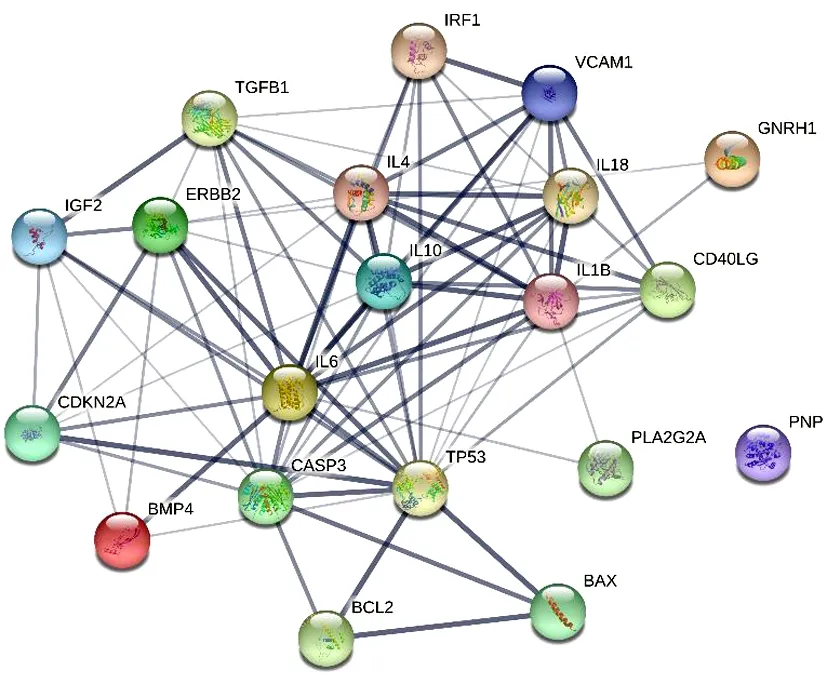
图6 玉屏风散20个关键免疫靶点的PPI网络
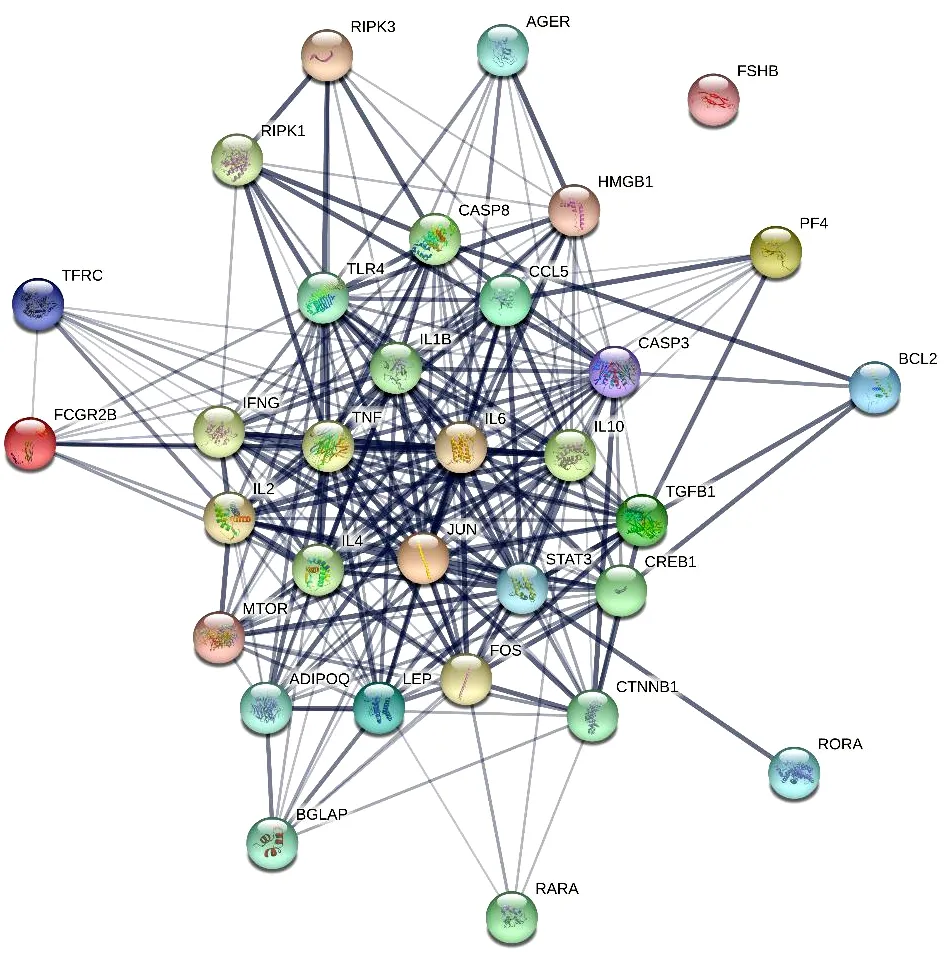
图7 褪黑素32个关键免疫靶点的PPI网络
由Cytoscape分析得知,玉屏风散得到19个(其中一个靶点未与其他靶点产生联系)关键免疫靶点的Degree、BC、CC的平均值分别为8.63、0.032、0.67,最高者分别为TP53、IL6、TP53;褪黑素的31个(其中一个靶点未与其他靶点产生联系)关键免疫靶点的Degree、BC、CC的平均值分别为16.19、0.017、0.70,最高者分别为TNF、STAT3、TNF。见表1~2。

表1 玉屏风散19关键免疫靶点PPI网络的拓扑分析
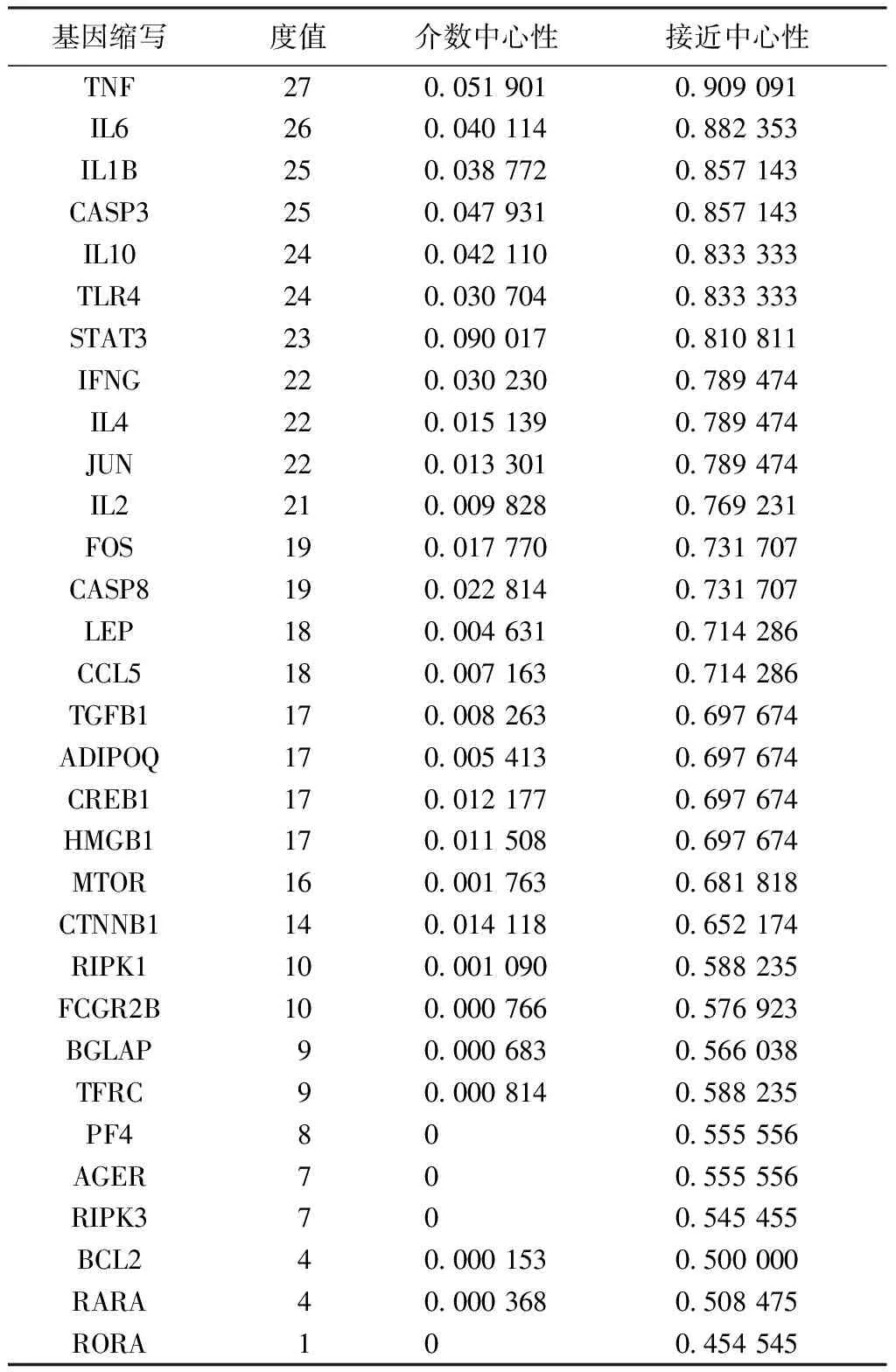
表2 褪黑素31关键免疫靶点PPI网络的拓扑分析
2.5 玉屏风散、褪黑素关键免疫靶点的KEGG通路富集分析 玉屏风散、褪黑素关键免疫靶点的KEGG通路富集分析结果显示,玉屏风散涉及KEGG通路33条(P<0.05),共分为了7类(Kappa=0.6)。见图8~9。其中结核病(Tuberculosis)、糖尿病并发症中的AGE-RAGE通路(AGE-RAGE Signaling Pathway in Diabetic Complications)、疟疾(Malaria)、炎症性肠病(Inflammatory Bowel Disease,IBD)等通路的基因占比位居前列;而胰腺癌(Pancreatic Cancer)、非小细胞肺癌(Non-Small Cell Lung Cancer)、小细胞肺癌(Small Cell Lung Cancer)、慢性粒细胞性白血病(Chronic Myeloid Leukemia)等是其相对于褪黑素所独有的通路。褪黑素关键免疫靶点的KEGG通路61条(P<0.05),共分为了11类(Kappa=0.4)。见图10~11。其中沙门氏菌感染(Salmonella Infection)、结核病(Tuberculosis)、南美锥虫病(美洲锥虫病)(Chagas Disease,American Trypanosomiasis)、炎症性肠病(Inflammatory Bowel Disease,IBD)等通路的基因占比位居前列;而沙门氏菌感染(Salmonella Infection)、南美锥虫病(美洲锥虫病)(Chagas Disease,American Trypanosomiasis)、Th17细胞分化(Th17 Cell Differentiation)、乙型肝炎(Hepatitis B)等则是其相对于玉屏风散而言特有的通路。
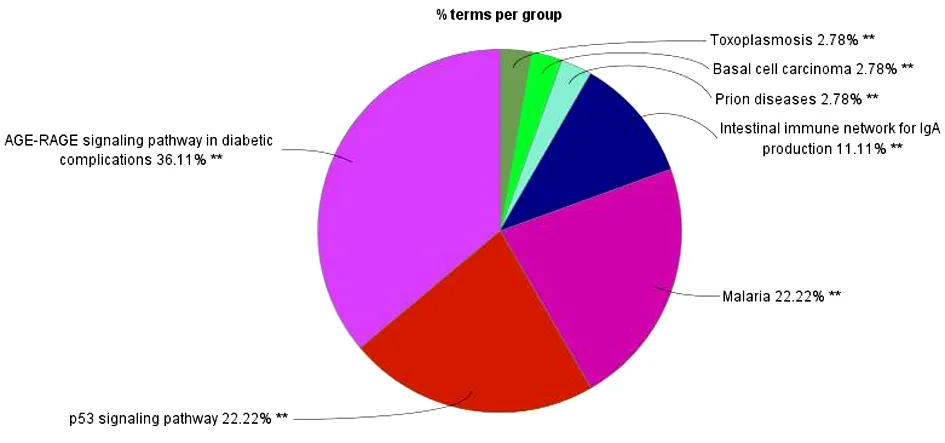
图8 玉屏风散KEGG通路富集的通路及分类
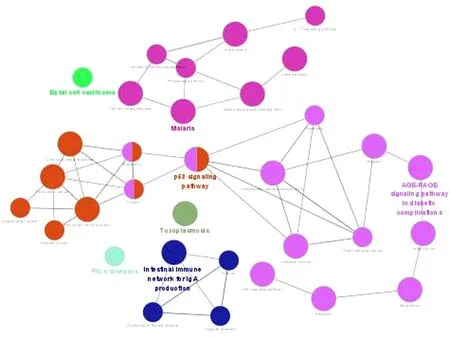
图9 玉屏风散KEGG通路富集的分类
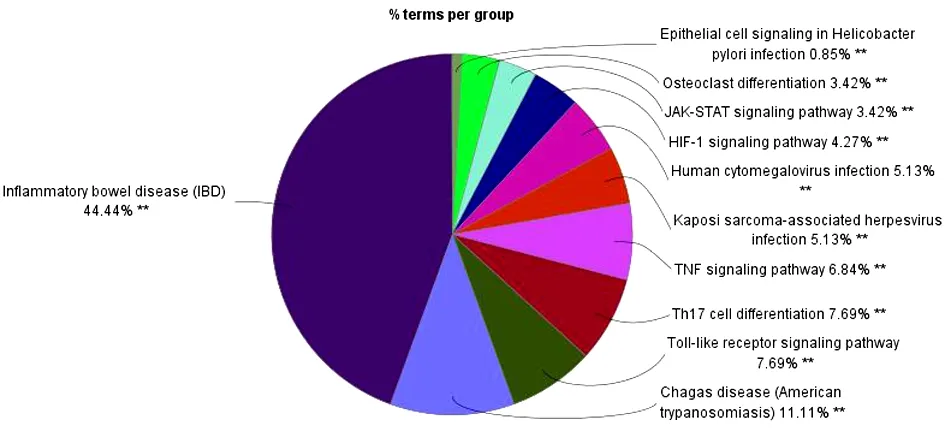
图10 褪黑素KEGG通路富集的通路

图11 褪黑素KEGG通路富集的分类
2.6 不同气温、药物干预后对小鼠血清IL-6、IL-1β、TNF-α的影响 在气温骤升和骤降条件下,玉屏风散组、玉屏风散+褪黑素组血清IL-6上升,褪黑素组血清IL-6含量下降,但其差异无统计学意义(P>0.05);在常温、气温骤升、气温骤降条件下,玉屏风散组、玉屏风散+褪黑素组可以使血清IL-1β升高,褪黑素组则显示IL-1β含量下降,而且其差异均有统计学意义(均P<0.01);在常温条件下,与对照组比较,玉屏风散组、褪黑素组、玉屏风散+褪黑素组血清TNF-α均下降,其中褪黑素组下降最为明显,其差异有统计学意义(P<0.01);气温骤降条件下,玉屏风散组、玉屏风散+褪黑素组小鼠血清TNF-α上升,但其差异无统计学意义(P>0.05)。气温骤升条件下,玉屏风散组血清TNF-α上升,玉屏风散+褪黑素组小鼠血清TNF-α下降,与对照组比较,其差异无统计学意义(P>0.05)。在气温骤升时,褪黑素组小鼠血清TNF-α下降明显,与对照组比较,差异有统计学意义(P<0.05)。见表3。
3 讨论
免疫系统是人体维持内环境平衡与应对外界刺激的重要组分之一,当免疫系统在内因或外因的作用下失去平衡时,相关疾病将涉及感染、自身免疫性疾病、肿瘤、其他免疫异常、继发的其他系统紊乱等问题[8-13]。玉屏风散和褪黑素调节免疫系统的功能已被大量的临床和实验室研究所证实,但二者均涉及复杂的调控网络,这也为二者在临床不同情境下的取舍,乃至联合应用带来了相当多的困难[14-18]。
相对于玉屏风散而言,褪黑素的相关研究主要集中在国外,这些研究的起步更早,数量也更多,这意味着我们所知的相关调控网络也更为复杂[19]。故本研究中,在同一网络药理学检索参数的条件下,检索到的褪黑素相关通路和靶点远多于玉屏风散的重要原因。此外,褪黑素相关靶点、通路的多元性,一方面意味着它具有更广泛的潜在临床使用价值,另一方面,也意味着在使用它治疗特定的疾病如哮喘、类风湿性关节炎、多发性硬化时,可能产生更多的不良反应,任何炎症都可能是它的禁忌证[20-23]。
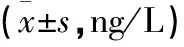
表3 不同气温、药物干预后小鼠血清IL-6、IL-1β、TNF-α含量
相对于褪黑素而言,玉屏风散作用机制的理解则有其特殊的麻烦。因为对于玉屏风散这样的中药复方而言,相当多的研究都是按照“临床发现疗效→动物实验或临床试验的指标观察→相应分子机制的研究”的顺序进行的,其复方内部的逻辑关系并不清晰。而网络药理学这一能够快速、系统地检索药物作用的靶点、相关通路,并进行系统分析的方法,为理清上述机制开辟了一条可行的科研思路。
综上所述,玉屏风散和褪黑素均可通过复杂的通路及靶点调控免疫系统的运行,二者针对的通路较为一致,而靶点却不同。玉屏风散在常温和气温骤降时对IL-1β表现出促炎作用,而褪黑素则在常温和气温骤升时对TNF-α表现出抗炎作用。本研究提示了气温变化对免疫干预的影响的可能性;结合文献检索、实验结果和中医理论,建议在气温骤变时,对免疫功能低下的人群,可以应用玉屏风散联合褪黑素预防疾病的发生。此外,考虑到玉屏风散和褪黑素在网络药理学中检索到的免疫通路较为一致,但实验结果却表明它们对IL-1β和TNF-α的调节不同,建议各网络药理学相关的数据库,可以考虑在从一手文献中提取资料时,不仅提取有效成分、靶点、通路之间的相关关系,而且同时保留这种关系的作用方向(正调控、负调控、双向调控等),以便为后续的数据分析提供更精确的支持。
