基于“调气解毒”理论探讨肺瘤平膏调控脂质代谢逆转肿瘤相关树突状细胞功能的机制研究
2022-08-17张曦文栾美琪席玉棚郑红刚花宝金
张曦文 栾美琪 席玉棚 郑红刚 花宝金
(1 中国中医科学院广安门医院,北京,100053; 2 黑龙江中医药大学药学院,哈尔滨,150040)
肺癌是临床最常见的肿瘤,在我国肺癌患病率和死亡率居所有恶性肿瘤的首位[1]。脂质代谢异常与肿瘤的关系是近年兴起的研究热点与前沿科学问题。脂代谢异常能够诱发恶性肿瘤,并且可以通过抑制抗肿瘤免疫,调节肿瘤微环境(Tumor Microenvironment,TME)形成肿瘤免疫抑制微环境,进而促进肿瘤细胞增殖、侵袭转移,促进肿瘤的进展[2]。因此,重塑肿瘤微环境中免疫细胞的功能是防治肿瘤进展和转移的关键。
树突状细胞(Dendritic Cells,DCs)是机体功能最强的专职抗原递呈细胞(Antigen Presenting Cells,APC),可以通过细胞间接触和分泌细胞因子等方式提供免疫调节信号,高效地摄取、加工处理和递呈抗原,未成熟DCs具有较强的迁移能力,成熟DCs表现为表面共刺激分子的过表达,调节细胞因子分泌,能有效激活初始T细胞,增加Th细胞(辅助性T细胞)和CTL(细胞毒性T淋巴细胞)亚群、降低调节性T细胞(Tregs)亚群表达,是机体内常见的免疫细胞。肿瘤相关树突状细胞Tumor-associated DCs,TDCs)是指在恶性肿瘤微环境中,表现出表型和功能异质性的树突细胞,TDCs尽管能摄取抗原,但其抗原呈递及T细胞活化能力受限,具有较低的免疫监视和防御功能[3-5]。越来越多的证据表明,肿瘤微环境中的DCs不仅阻碍抗肿瘤免疫,而且是多种肿瘤发生发展的积极促进剂。TDCs内氧化脂质的异常积累,导致DCs的功能障碍,脂质异常堆积的TDCs在处理加工呈递抗原方面具有很大的缺陷,不能有效地激活T细胞抗肿瘤免疫作用,促进肿瘤的发生发展[6]。
“脂浊”既为病理产物也是致病因素,多归属于中医学“痰浊”的病理范畴。全国名中医朴炳奎教授依据多年的临床经验并且结合现代医学药物筛选结果研制了具有确切肺癌疗效的肺瘤平膏。肺瘤平膏全方由四类药物组成,包括扶正药物、解毒药物、化痰药物和活血药物,具有益气养阴、化痰散结、解毒活血的功效。肺瘤平膏中扶正药物可通过“扶正”达到“调气”之功,恢复和维持机体生理之气的正常输布,使其阴阳平和,机体正气充足;化痰活血、解毒散结之品共奏“解毒”之功,使痰凝、血瘀、癌毒之邪消减,驱邪外出。
本实验将体外模拟肿瘤微环境,构建TDCs模型,探究肺瘤平膏改善脂质堆积,逆转TDCs功能的效应机制,探析中医“调气解毒”与改善肺癌免疫微环境的关联性,丰富并充实中医肿瘤理论体系。
1 材料与方法
1.1 材料
1.1.1 细胞与动物 Lewis肺癌细胞株(购自国家实验细胞资源共享平台北京总部);4周龄的C57BL/6雄性小鼠,体质量(14±1)g,购自于北京维通利华实验动物技术有限公司,饲养于中国中医科学院广安门医院清洁级动物实验中心[许可证号:SYXK(京)2005-0001]。
1.1.2 药物 肺瘤平膏(中国中医科学院广安门医院院内制剂室,批号:20171211)。
1.1.3 试剂与仪器 RPMI 1640(Hyclone公司,美国,货号:SV30809.01);Fetal Bovine Serum(胎牛血清)(Gibco公司,美国,货号:10099141C);0.25%Trypsin+0.02%EDTA胰酶消化液(杭州吉诺生物医药技术有限公司,货号:GNM-25200);二甲基亚砜(Sigma公司,美国,货号:DMSO D2650);青链霉素双抗(Hyclone公司,美国,货号:SV30010);磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)(Hyclone公司,美国,货号:SH30256.01B);重组小鼠粒细胞-巨噬细胞集落刺激因子蛋白(Recombinant Mouse GM-CSF Protein)(R&D公司,美国,货号:415-ML-020);重组小鼠白介素-4蛋白(Recombinant Mouse IL-4 Protein)(R&D公司,美国,货号:404-ML-025);10X浓缩裂解缓冲液Lysing Buffer 10X Concentrate 100 mL(BD公司,美国,货号:555899)中性脂滴荧光探针BODIPY 493/503(Thermo Fisher公司,美国,货号:D3922);流式细胞技术使用抗体:APC Hamster Anti-Mouse CD11c 0.1 mg(BD公司,美国,批号:550261);APC Hamster Anti-Mouse CD11c 0.1 mg(BD公司,美国,货号:550261);PerCP-CyTM5.5 Rat Anti-Mouse I-A/I-E 50 μg(BD公司,美国,批号:562363);PE Rat Anti-Mouse CD86 0.2 mg(BD公司,美国,批号:553692,);FITC(Fluorescein isothiocyanate)Hamster Anti-Mouse CD80 0.1 mg(BD公司,美国,批号:561954);APC Hamster IgG1,λ1 Isotype Control 0.1 mg(BD公司,美国,批号:553956,);PerCP-CyTM5.5 Rat IgG2b,κ Isotype Control 0.1 mg(BD公司,美国,批号:550764);PE Rat IgG2a,κ Isotype Control 0.1 mg(BD公司,美国,批号:553930);FITC Hamster IgG2 κ Isotype Control 0.25 mg(BD公司,美国,批号:550056);PerCP Armenian Hamster Anti-Mouse CD3e(BD公司,美国,批号:553067,);FITC Rat Anti-Mouse CD4(BD公司,美国,批号:553046);PE Rat Anti-Mouse CD8a(BD公司,美国,批号:553032);APC Rat Anti-Mouse CD25(BD公司,美国,批号:557192);PE Rat anti-Mouse Foxp3(BD公司,美国,批号:563101);PE Rat IgG2a,κ Isotype Control(BD公司,美国,批号:553930);转录因子缓冲液Transcription Factor Buffer Set(BD公司,美国,货号:562574);多因子检测试剂盒(eBioscience公司,美国,批号:PPX-05;LOT.222242-000,);TGF-β1检测试剂盒(eBioscience公司,美国,批号:BMS608-4;LOT.218843-005);动物脾脏组织淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司,批号:LTS1092PK);FACS Calibur流式细胞仪FACS Calibur Flow Cytometer System(BD公司,美国,型号:FACS Calibur);多功能酶标仪(BioTek公司,美国,型号:Synergy HT);Luminex 200多因子检测仪(Luminex公司,美国,型号:Luminex200)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 肺瘤平膏含药血清配置 成人按照体质量60 kg计算,肺瘤平膏正常使用剂量为20 g/次,2次/d。根据成人与大鼠的换算系数为6.3,则大鼠等效剂量20 g/60 kg×6.3=2.1 g/kg,中剂量为等效剂量的2倍,大鼠中剂量为4.2 g/kg。大鼠体质量按照0.20 kg计算,则每次用药剂量为4.2 g/kg×0.20 kg=0.84 g,按照单次灌胃体积为2 mL计算,则肺瘤平膏浓度需调整为0.42 g/mL,空白组(NRS)采取生理盐水0.2 mL灌胃。将20只Wistar大鼠,随机分为肺瘤平膏(FLP)组和空白组,每组10只。适应性饲养24 h后,2次/d进行灌胃,连续给药3 d,第3天晚上禁食不禁水,第4天晨起给药1次,1 h后,麻醉,腹主动脉取血,静置离心后完成肺瘤平膏组及空白组含药血清配置。
1.2.1.2 TDCs的分离、诱导培养及鉴定 取4周龄雄性C57BL/6小鼠脱颈处死,无菌条件下取出股骨和胫骨,进行骨髓腔冲洗,将骨髓细胞冲入15 mL离心管中,1 300 r/min,离心半径30 cm,离心5 min后充分裂解红细胞,加入细胞因子的完全培养基重悬培养(完全培养基配比:RPMI1640培养液、10%FBS、1%青链霉素双抗、Recombinant Mouse GM-CSF终浓度40 ng/mL,Recombinant Mouse IL-4终浓度20 ng/mL),每2天半量换液至第6天,收集并流式细胞仪检测细胞分子表面标记CD11c表达,鉴定获得小鼠骨髓源DCs,20%Lewis肺癌细胞培养上清,进行诱导培养,即获得TDCs。
1.2.1.3 构建TDCs与T细胞共培养模型 制备BALB/c小鼠脾脏单细胞悬液,并运用淋巴细胞液分离液进行T细胞分离,与TDCs共培养72 h后获得TDCs-T细胞共培养模型。
1.2.2 干预方法 本实验共分2组:空白血清对照组(Control对照组):建立TDCs培养体系后,按10%的浓度加入空白血清;肺瘤平膏含药血清组(FLP组):建立TDCs培养体系后,按10%的浓度加入肺瘤平膏含药血清;以上分组以106细胞培养于细胞培养十二孔板中,5%CO237 ℃细胞培养箱中培养24 h,观察肺瘤平膏含药血清对肿瘤相关树突状表型影响、白细胞介素-12p70、γ干扰素的分泌的影响。通过FLP组及对照组干预后的TDCs与T细胞共培养,观察肺瘤平膏含药血清对淋巴细胞增殖及T细胞亚群表达的影响。
1.2.3 检测指标与方法
1.2.3.1 肺瘤平膏含药血清对体外诱导TDCs中脂质的影响 小鼠骨髓源DCs的分离、培养,建立体外TDCs培养模型,肺瘤平膏含药血清及空白血清干预培养,通过BODIPY 493/503染色后流式细胞仪检测,使用Flow Jo 10.4软件进行流式数据分析。
1.2.3.2 肺瘤平膏含药血清对体外诱导肿瘤相关树突状表型的影响 小鼠骨髓源DCs的分离、培养,建立体外TDCs培养模型,肺瘤平膏含药血清及空白血清干预培养,通过流式细胞仪检测肺瘤平膏含药血清对TDCs细胞表面分子CD11c、主要组织相容性复合体(Major Histocompatibility Complex,MHC)-Ⅱ、CD80、CD86的表达,使用软件Flow Jo 10.4对TDCs表型进行分析。
1.2.3.3 肺瘤平膏含药血清调节TDCs细胞因子白细胞介素-12p70、γ干扰素的分泌(基于Luminex技术定量检测TDCs细胞因子白细胞介素-12p70、γ干扰素的分泌) 收集上述实验培养上清,通过多因子分析仪(Luminex 200)检测白细胞介素-12p70、γ干扰素的分泌并进行分析。
1.2.3.4 肺瘤平膏含药血清调节TDCs对混合淋巴细胞增殖的影响(CCK8检测混合淋巴细胞增殖情况) 分离、培养小鼠骨髓源DCs,建立体外TDCs培养模型,肺瘤平膏含药血清及空白血清干预培养;取脱颈处死BALB/c小鼠,分离获得小鼠脾淋巴细胞;将TDCs与淋巴细胞按照1∶10共培养72 h,CCK8试剂盒检测混合细胞增殖。
1.2.3.5 肺瘤平膏含药血清调节TDCs影响Th细胞、CTL细胞和Tregs细胞表型的影响 分离、培养小鼠骨髓源DCs,建立体外肿瘤相关DCs培养模型,肺瘤平膏含药血清及空白血清干预培养;取脱颈处死BALB/c小鼠,分离获得小鼠脾淋巴细胞;将TDCs与淋巴细胞按照1∶10共培养72 h,流式细胞仪检测CD3e、CD4、CD8a、CD25、叉头框蛋白3(Forkhead box protein 3,Foxp3)细胞分子标志物表达。
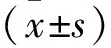
2 结果
2.1 流式细胞仪检测小鼠骨髓源DCs表面分子的表达 为观察小鼠骨髓源DCs表面分子CD11c表达情况,应用流式细胞术对获得到细胞悬液进行CD11c APC表面标记染色,单染CD11c同型抗体流式圈门后,CD11c阳性比例为76.5%。因此,小鼠骨髓源单核细胞经体外细胞因子粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage Colony Stimulating Factor,GM-CSF)和白细胞介素-4诱导培养后,得到CD11c+DCs的纯度为76.5%,可用于接下来的实验研究。见图1。
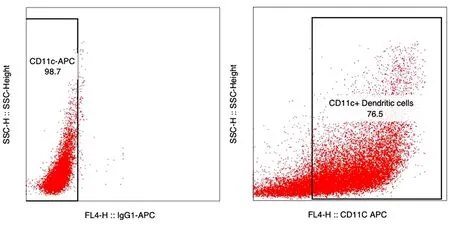
图1 流式细胞法检测小鼠骨髓来源单核细胞诱导DCs的纯度
2.2 肺瘤平膏含药血清对TDCs脂质的影响 结果表明,肺瘤平膏含药血清作用于TDCs,脂质含量小于空白血清对照组,FLP组>对照组,差异有统计学意义(P<0.01)。见表1、图2。
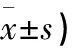
表1 FLP含药血清对TDCs脂质含量表达的作用(平均荧光强度,
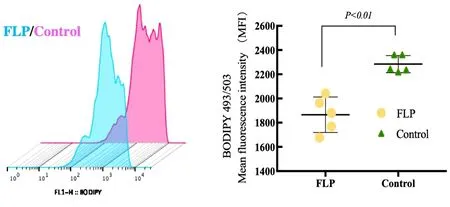
图2 FLP含药血清对TDCs脂质含量表达的作用
2.3 肺瘤平膏含药血清对TDCs表型的影响 结果表明:肺瘤平膏含药血清干预后,MCH-Ⅱ、CD80、CD86表达水平均有一定程度的提高,其中CD80、CD86表达水平明显高于对照组,差异有统计学意义(P<0.05),MCH-Ⅱ细胞分子的差异无统计学意义(P>0.05)。见表2、图3~6。
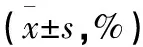
表2 肺瘤平膏含药血清对体外诱导TDCs表型的影响
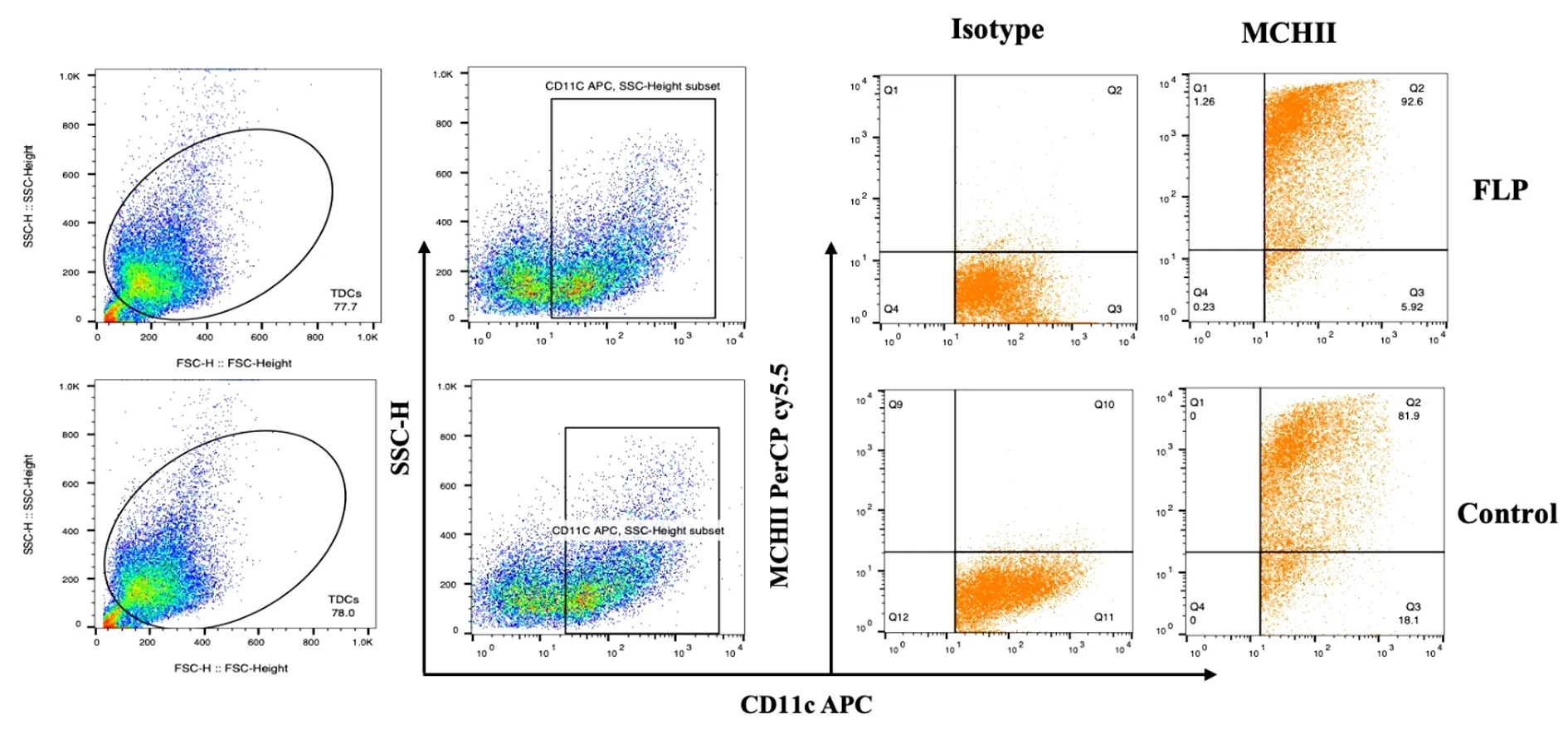
图3 肺瘤平膏含药血清对体外诱导TDCs MCH-Ⅱ表型的影响
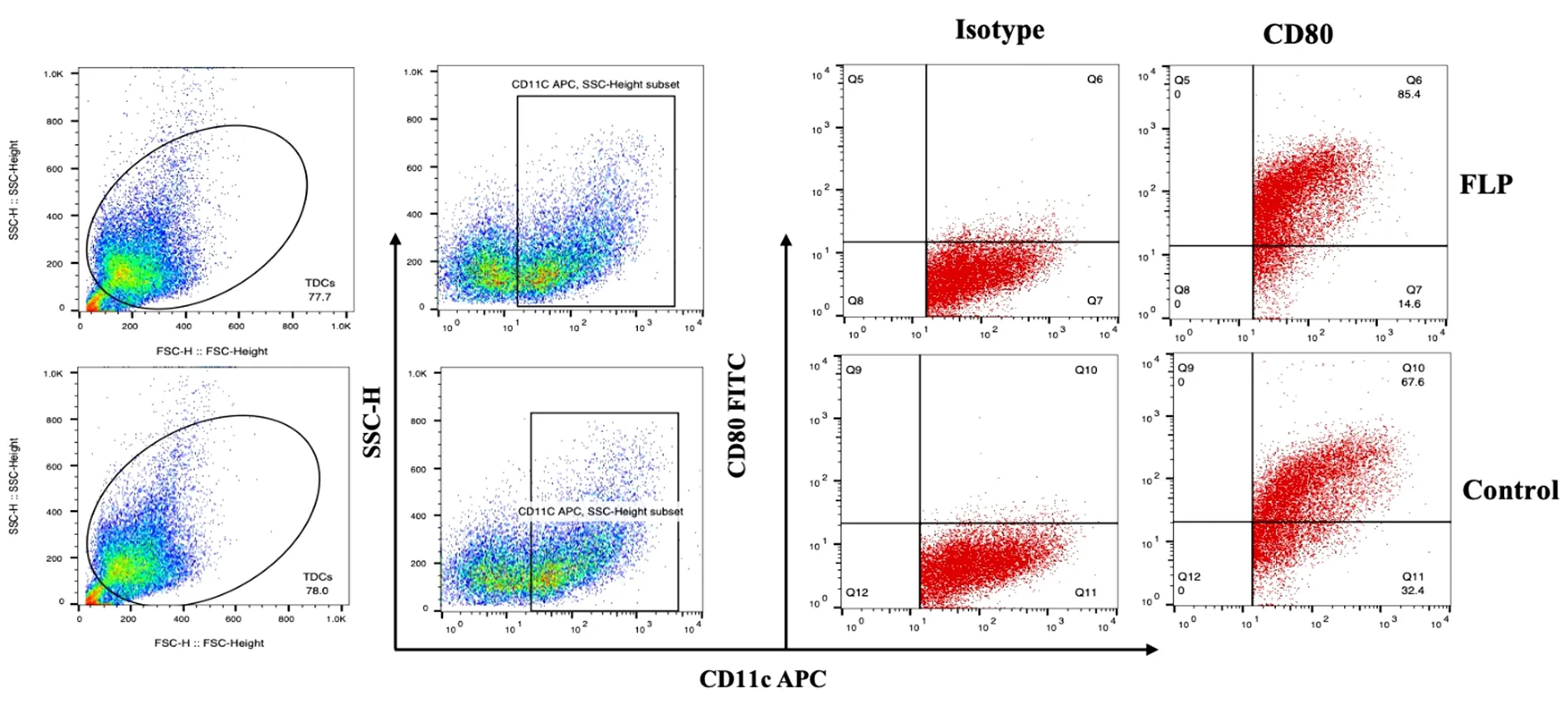
图4 肺瘤平膏含药血清对体外诱导TDCs CD80表型的影响
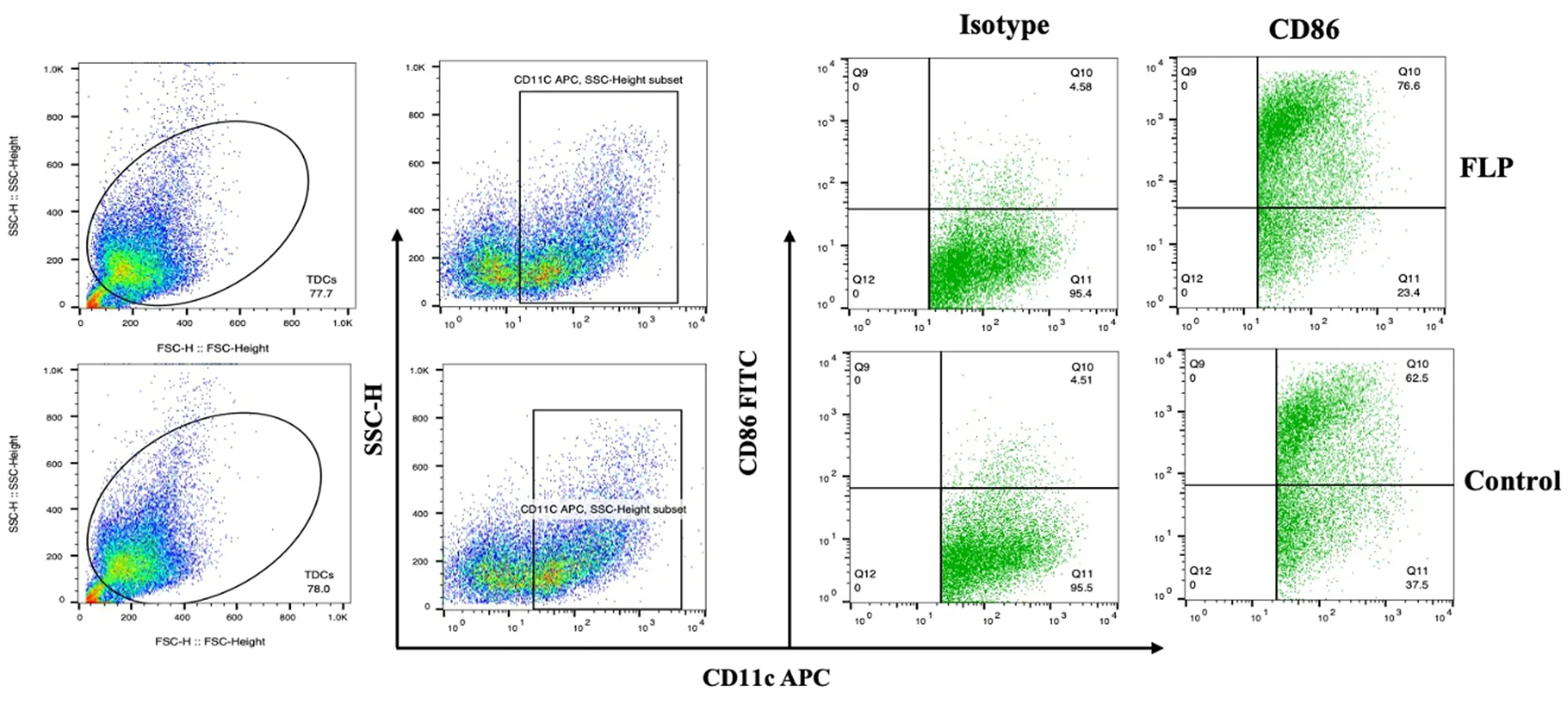
图5 肺瘤平膏含药血清对体外诱导TDCs CD86表型的影响

图6 肺瘤平膏含药血清对TDCs表型的影响
2.4 肺瘤平膏含药血清调节TDCs细胞因子白细胞介素-12p70、γ干扰素的分泌 结果表明:肺瘤平膏含药血清干预后,白细胞介素-12p70、γ干扰素具有一定程度的提高(FLP组>对照组),差异有统计学意义(P<0.05)。见表3、图7。
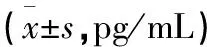
表3 FLP含药血清对TDCs分泌白细胞介素-12p70、γ干扰素表达的影响
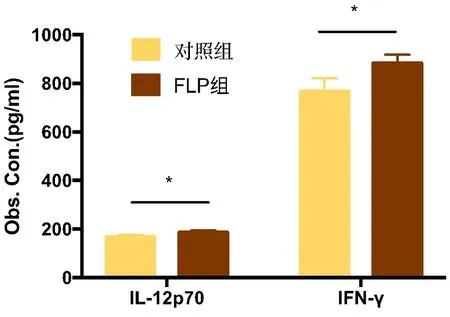
图7 FLP含药血清对TDCs分泌白细胞介素-12p70、γ干扰素表达的影响
2.5 肺瘤平膏含药血清对TDCs调节混合淋巴细胞增殖和T细胞亚群的影响
2.5.1 肺瘤平膏含药血清对混合淋巴细胞反应中细胞增殖的影响 结果显示,肺瘤平膏含药血清能够一定程度地影响细胞的CCK8 OD值结果,说明肺瘤平膏对能够一定程度地提高混合细胞的增殖能力。结果表明,肺瘤平膏含药血清刺激混合淋巴细胞的增殖能力较空白血清组较强。见图8。
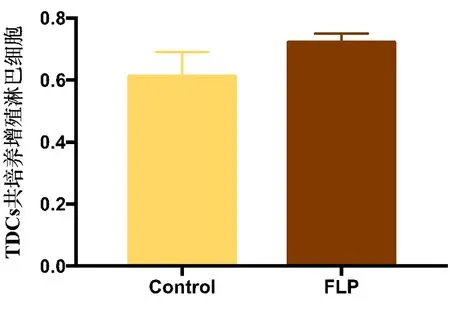
图8 肺瘤平膏对混合淋巴细胞培养细胞增殖的影响
2.5.2 肺瘤平膏含药血清调节TDCs影响Th细胞和CTL细胞亚群 结果表明,淋巴细胞培养后的混合细胞中后,与空白血清组比较,肺瘤平膏含药血清干预可以明显提高T细胞中CD4+、CD8+表达比例,差异有统计学意义(P<0.05)。FLP含药血清可以提高T细胞中Th细胞和CTL细胞亚群的分化。见表4、图9~10。
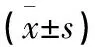
表4 FLP含药血清调节TDCs对CD4+、CD8+T细胞表达的影响
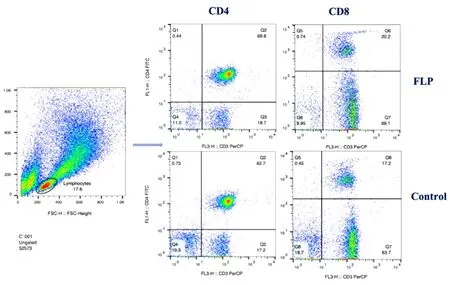
图9 FLP含药血清调节TDCs对CD4+、CD8+T细胞表达的影响
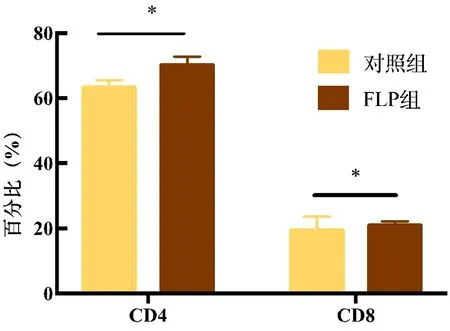
图10 FLP含药血清调节TDCs对CD4+、CD8+T细胞表达的影响
2.5.3 肺瘤平膏含药血清作用于TDCs影响Tregs细胞表型的表达 结果表明:肺瘤平膏含药血清干预后,Tregs细胞表达百分比具有一定程度的下降(FLP组<对照组),差异有统计学意义(P<0.05)。见表5、图11~12。
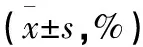
表5 FLP含药血清调节TDCs对Tregs表达的影响
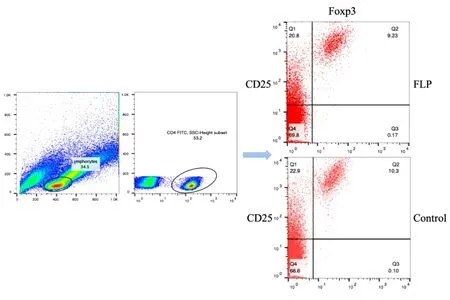
图11 FLP含药血清调节TDCs对Tregs表达的影响
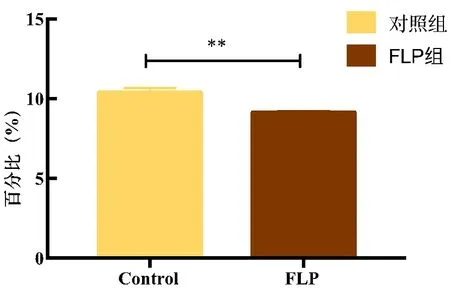
图12 FLP含药血清调节TDCs对Tregs表达的影响
3 讨论
肺癌属于中医学癌病范畴,但并没有具体的病名,根据其临床的具体表现,可以将肺癌归属于“肺积”“息贲”“咳嗽”等范畴。《难经·论五脏积病》记载:“肺之积,名日息贲,在右胁下,覆大如杯,久不已,令人洒淅寒热,喘咳,发肺壅。”《景岳全书·虚损》篇中对于肺癌的相似论述,曰:“劳嗽,声哑,声不能出或喘息气促者,此肺脏败也,必死。”肺癌的发病基础为“正虚气滞,邪毒内恋”,气机升降失调、正气虚损导致痰凝、血瘀内生,酿生癌毒是肺癌发生及进展的关键病机,可认为“调气解毒”是肺癌的防治准则。
“全国名中医”朴炳奎教授,根据多年临床经验,结合现代药理学研究结果,研制出肺癌治疗的有效方剂肺瘤平膏,全方选用益气养阴药物:黄芪、西洋参、沙参、麦冬等;清热解毒药物:拳参、败酱草、白花蛇舌草、仙鹤草等;化痰活血药物:桔梗、川贝母、杏仁、桃仁等,共奏调气解毒、标本兼治之功。
肿瘤微环境通过多种作用机制,形成机体免疫系统抑制网络,导致多种机体免疫细胞功能障碍,抗肿瘤免疫能力下降,形成复杂的肿瘤免疫逃逸。DCs作为机体最重要的APC,在抗肿瘤免疫中具有重要的调节作用。肿瘤免疫抑制微环境也通过多种机制抑制DCs的分化和活化成熟,抑制机体抗肿瘤免疫应答的启动,使肿瘤局部募集的DCs表现为异常分化的未成熟表型,细胞呈递肿瘤抗原的能力减弱,降低免疫监视和防御功能,促进肿瘤细胞的生长和转移[7]。
近年来研究发现,TDCs内脂质的异常堆积也是影响TDCs的功能的关键因素。随着肿瘤相关刺激的暴露,细胞内脂肪在DCs中积聚[8]。研究报道称,氧化脂质的积累,特别是三酰甘油的积累,会引起DCs的功能障碍,缩短细胞的寿命[9-11]。研究显示,未成熟及功能受到了系统性地干扰的TDCs,具体表现为细胞表面共刺激分子表达量的下降、白细胞介素-12等细胞因子分泌减少、细胞吞噬抗原能力减弱、T细胞提呈功能下降等[12-16]。
本研究通过对体外模拟培养的TDCs中的脂质进行流式检测,结果发现,肺瘤平膏含药血清作用后的TDCs,脂质含量小于空白血清对照组(FLP组>对照组),差异有统计学意义(P<0.01),证明肺瘤平膏能够改善DCs内的脂质积累,对DCs的功能产生正向调控。DCs的表面共刺激分子,MHC-Ⅱ类分子在免疫应答过程中表达,被看成是DCs抗原递呈能力的标志。CD80(B7-1)、CD86(B7-2)表达在成熟的DCs细胞表面,与表达在T淋巴细胞上的配体CD28、CTLA-4结合后提供协同信号,导致T淋巴细胞活化。因此,本实验通过流式验证DCs表面分子MHC-Ⅱ、CD80、CD86的表达,评估肺瘤平膏含药血清作用后的TDCs的抗原呈递能力。本实验研究结果发现,肺瘤平膏含药血清干预后,MCH-Ⅱ、CD80、CD86表达水平均有一定程度的提高,其中CD80、CD86表达水平明显高于空白血清组(P<0.05),证明肺瘤平膏能够有效地促进TDCs细胞的成熟,改善细胞的抗原呈递能力,促进T细胞激活。
DCs能够激活淋巴细胞的增殖和活化[17]。本研究采用负载抗原的TDCs与淋巴细胞共培养的方式,研究肺瘤平膏调控TDCs对混合淋巴细胞增殖和T细胞亚群活化的影响。结果显示:共培养细胞后,肺瘤平膏含药血清作用后的混合细胞增殖能力较空白血清增强。通过研究肺瘤平膏对T细胞亚群的影响,结果发现,与空白血清组比较,肺瘤平膏含药血清干预可以明显提高T细胞中CD4+、CD8+表达比例(P<0.05),降低Tregs的表达。由此可知,FLP含药血清可以促进Th细胞和CTL亚群、抑制Tregs亚群的活化。
研究发现,高水平的细胞因子白细胞介素-12、γ干扰素可以有效地激活T细胞增殖活化[18],肿瘤免疫抑制微环境对TDCs的细胞因子分泌具有负调节作用。本研究发现,肺瘤平膏含药血清干预后,白细胞介素-12p70、γ干扰素具有一定程度的提高(FLP组>对照组),差异有统计学意义(P<0.05),可以印证对混合淋巴细胞增殖活化作用的改善或是与促进白细胞介素-12p70、γ干扰素分泌相关。
综上所述,在肿瘤免疫微环境中,肺瘤平膏含药血清能够有效地降低TDCs中的脂质堆积,促进TDCs的成熟和抗原呈递能力,促进白细胞介素-12p70、γ干扰素的分泌,改善激活混合淋巴细胞增殖和T细胞亚群活化功能,增强肿瘤免疫功能。揭示了中医药“调气解毒”代表方剂肺瘤平膏具有改善肺癌免疫抑制微环境的作用,进而发挥中医药肿瘤免疫调节作用,抑制肿瘤的发生发展,丰富并充实中医药肿瘤防治理论。
