盐胁迫下白花前胡香豆素合成途径关键酶基因生物信息学分析
2022-08-17李姚碧琪陆海波殷齐慧张艳梅韩邦兴欧金梅
李姚碧琪,陆海波,贾 彬,殷齐慧,张艳梅,韩邦兴,欧金梅
(1.安徽中医药大学,安徽 合肥 230012;2.皖西学院,安徽 六安 237012; 3.安徽农业大学,安徽 合肥 230038)
白花前胡(PeucedanumpraeruptorumDunn)为伞形科多年生草本植物,其干燥根被作为中药前胡来使用,具有降气化痰、散风清热的功效[1]。白花前胡富含大量化学成分,如香豆素类、黄酮类、皂苷、挥发油,起主要药理作用的成分为香豆素类化合物[2]。对白花前胡进行药理学研究[3]发现,香豆素类化合物在心脑血管疾病、抗炎、逆转多药耐药、抗癌和神经保护等方面具有较高的医疗价值。
香豆素类化合物主要来源于苯丙烷代谢途径,药用成分是植物体内的次生代谢产物积累在植物器官或组织中,而产物积累的差异量与生物合成途径关键基因的表达有关[4]。通过转录组差异基因的表达分析,一些研究已经确定了香豆素类化合物合成和转运的一些关键酶,在白花前胡中也克隆并验证了几个与香豆素生物合成有关的基因,如苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)[5]、4-香豆酸:CoA连接酶(4-Coumaric acid:CoA ligase,4CL)[6]、对香豆酰CoA2′-羟化酶(p-coumaroyl CoA 2′-hydroxylase,C2′H)[7]。研究者对关键酶基因进行体外功能鉴定时发现,基因有各自不同的功能,它们具有底物特异性,用以催化香豆素的生物合成,而基因功能性的差异取决于特殊的结构域,目前对于香豆素生物合成途径关键酶基因的结构域还未有系统的分析。酶易受到环境因子的影响,在紫外线、冷、热、氧化应激和茉莉酸甲酯等不同环境条件下,关键酶基因对胁迫的响应程度均有所不同,然而对盐胁迫下各关键酶表达水平的变化尚未知晓。
本研究利用前期转录组测序、Pfam数据库和有关生物信息学软件,对香豆素生物合成途径关键酶基因进行生物信息学分析,综合分析其编码蛋白家族结构域及三级结构,并利用荧光定量PCR分析基因在盐胁迫下的表达变化,通过盐胁迫试验初步阐明关键酶基因在胁迫应答中的响应程度,为进一步解析白花前胡香豆素合成途径关键酶基因的功能提供了理论依据。
1 材料与方法
1.1 白花前胡香豆素生物合成途径关键酶基因序列来源 课题组前期已完成白花前胡转录组测序[8-9],从已报道过的文献确定在前胡香豆素合成途径上有明确催化活性的关键酶基因,分别为PAL[5]、4CL[6]、肉桂酸-4-羟化酶(cinnamic acid-4-hydroxylase,C4H)[10]、C2′H[7]、咖啡酸氧-甲基类转移酶(caffeic acid oxy-methyltransferase,COMT-S)[11]及葡萄糖醛酸酰4-O-甲基转移酶(glucuronyl 4-O-methyltransferase,GXM)[4]。PAL作为苯丙氨酸途径的第一限速酶,催化L-苯丙氨酸生成反式肉桂酸,C4H能催化反式肉桂酸转化为对香豆酸,4CL是苯丙氨酸分支途径中的重要酶,负责催化合成肉桂酰CoA、对香豆酰CoA、咖啡酰CoA和阿魏酸CoA,C2′H催化生成的伞形酮为香豆素的母体,经一系列羟基化、环化、异戊烯化等催化反应后生成复杂香豆素成分。COMT-S及GXM为香豆素生物合成下游途径关键酶,涉及的催化途径还不清晰,但体外酶活实验已证实可以催化香豆素的生成。
1.2 白花前胡香豆素生物合成途径关键酶基因编码蛋白的生物信息学分析 利用蛋白家族信息查询数据库Pfam对关键酶基因蛋白的保守结构域进行分析,并利用蛋白质结构域在线分析网站(http://smart.embl-heidelberg.de/)和在线蛋白质结构预测网站(https://swissmodel.expasy.org/interactive/)对白花前胡香豆素生物合成途径关键酶进行结构域的分析和蛋白质三级结构的预测[12]。
1.3 白花前胡种苗培养和实时荧光定量PCR分析 供试材料为栽培前胡,种子从道地产区安徽宁国收取得来,种植前将种子置于温水泡24 h,选择饱满的种子,将种子播于1/2 MS培养基平板上置于黑暗处发芽,选取发芽大小均一的种芽播种于盛有蛭石的塑料花盆中,置于盛有1/2 Hoagland营养液的周转箱中培养,白炽灯光照12 h、黑暗12 h,昼夜温度分别为(25±2)℃和(18±2)℃。待白花前胡长出第4片真叶时,在李伟等[13]的研究基础上发现,0.15 mol/L NaCl处理后耐盐基因CLC表达水平上升显著,故采用0.15 mol/L 的NaCl溶液进行盐诱导处理,分别在0、2、4、8、12、24 h等诱导时间点取下白花前胡的根组织,样品液氮速冻后于-80 ℃保存,按照Takara公司柱式法植物RNA小量提取试剂盒提取根组织RNA,使用琼脂糖凝胶电泳和多功能酶标仪进行质量检测,检测合格后置于-80 ℃冰箱备用。利用Takara公司Titanium One-Step RT-PCR试剂盒将提取好的RNA进行反转录获得cDNA,将反应获得的cDNA置于-20 ℃保存。使用引物设计软件设计荧光定量PCR实验引物,参照赵玉成等的研究[14]选择SAND基因为内参基因,基因信息及引物序列见表1。

表1 qRT-PCR引物信息
实时荧光定量PCR反应采用Takara公司PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒,在Thermo Fisher的QuantStudio 5荧光定量PCR仪器上运行,每组反应设置3个重复,荧光定量PCR扩增条件为:94 ℃预变性30 s;94 ℃变性5 s,61 ℃退火35 s,40个循环;溶解曲线为:97 ℃ 10 s;65 ℃ 60 s;97 ℃ 1 s。荧光定量反应体系见表2。

表2 qRT-PCR反应体系
使用Thermo Scientific PikoReal软件(Thermo公司)分析PCR过程样品的CT(threshold cycle)值,通过2-ΔΔCT法计算目的基因相对表达水平,公式如下:ΔΔCT=(样品目的基因CT-样品内参基因CT)-(对照目的基因CT-对照内参基因CT)。将未进行盐胁迫处理的白花前胡基因表达水平设为对照组,其值为1,分别计算出目标基因的盐胁迫下不同时间段的相对表达水平,取3次实验平均值即得。将盐胁迫处理后的样品与对照组比较,采用SPSS 25.0软件进行单因素方差分析,使用Tukey HSD检验。P<0.05为差异有统计学意义。
2 结果与分析
2.1 关键酶基因编码蛋白理化特性预测分析 关键酶基因蛋白的保守结构域差异比较大,也暗示着它们有不同的功能[15]。PAL蛋白在64~550位上具有属于Lyaseclass_I_like超家族的结构域。PAL是苯丙烷途径关键的生物合成催化酶,参与多种次生代谢产物的生物合成,如黄酮类化合物、呋喃香豆素类、植物抗毒素和细胞壁成分,这些化合物对正常生长和应对环境胁迫压力非常重要[16]。GXM具有Polysacc_synt_4结构域,且在12~29位上有一个跨膜螺旋区。4CL包含1个从第31位氨基酸到第443位氨基酸的AMP-binding保守功能结构域,通过ATP依赖的AMP结构域与底物共价结合来起作用,它们共享一个序列相似区域,该区域是一个富含Ser/Thr/gly的区域,进一步以保守的Pro-Lys-Gly三重态为特征[17]。C2′H蛋白中包含两个结构域:DIOX_N结构域和2OG-FeII_Oxy结构域。在植物中,2OG-FeII_Oxy双加氧酶域酶具有催化生成植物激素的功能,如乙烯、赤霉素、花青素和黄酮类色素[18]。C4H尤为特别,具有P450保守结构域,细胞色素P450酶是一个血红素单加氧酶的超家族,在植物中,这些蛋白质对激素、防御化合物和脂肪酸等多种化合物的生物合成非常重要[19]。COMT-S蛋白在35~86位和129~357位氨基酸上具有Dimerisation和Methyltransf_2两个保守结构域,该结构域包括一系列O-甲基转移酶,对许多植物O-甲基转移酶cDNA克隆的预测以及氨基酸序列的比较分析表明,它们具有32%~71%的序列同源性。基因具有特殊的保守结构域,就会发挥不同的特殊作用[20]。关键酶基因蛋白三维结构的预测结果见图1所示,建模质量较好。
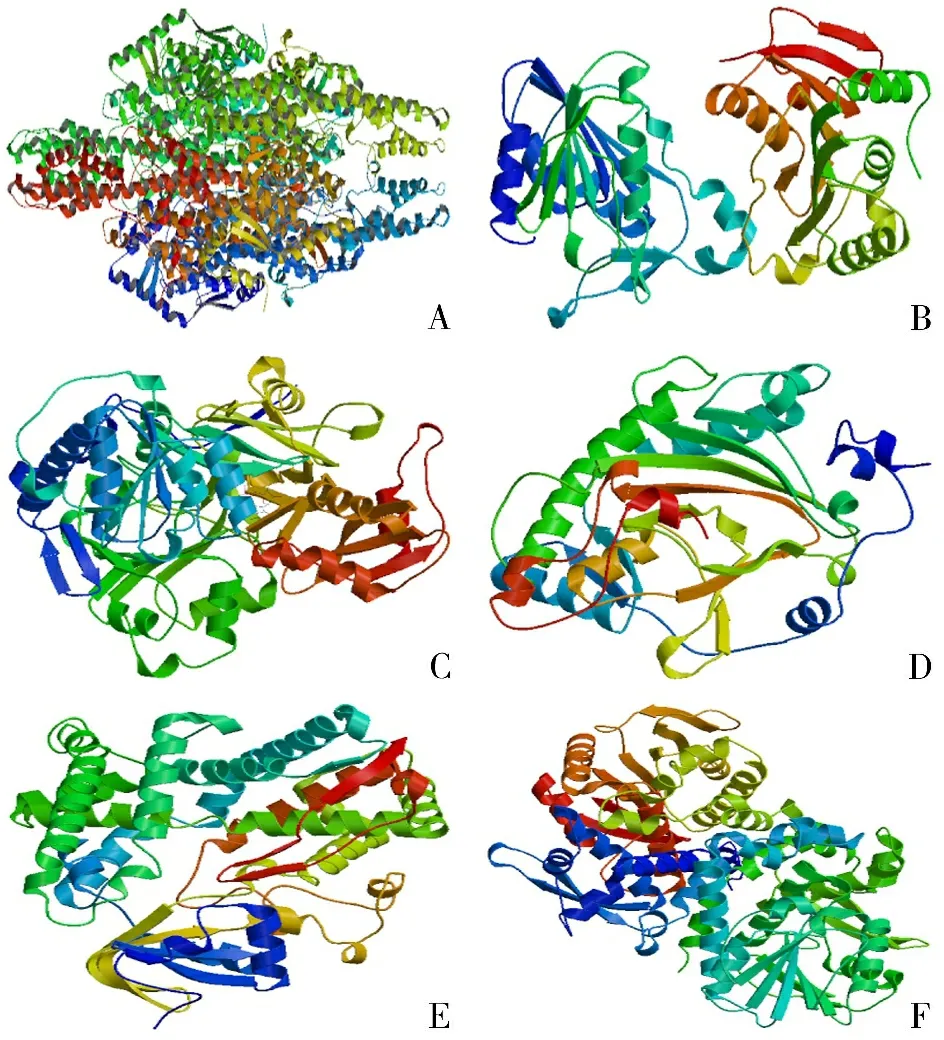
注:A.PAL;B.GXM;C.4CL;D.C2′H;E.C4H;F.COMT-S图1 关键酶基因蛋白的三级结构预测
2.2 关键酶基因实时荧光定量PCR分析 白花前胡香豆素合成途径关键酶基因在盐胁迫的调控下,响应程度均有所不同。PAL和4CL为苯丙烷上游途径关键酶,C4H和C2′H为苯丙烷中游途径关键酶,COMT-S和GXM为苯丙烷下游途径关键酶。各个基因在盐胁迫下均表现出不同的表达模式,具体表达水平的影响见图2、图3。在0.15 mol/L NaCl胁迫过程中,处理2 h后与对照组相比,PAL和4CL基因表达水平明显上升,而其余均明显下降;处理4 h后,PAL、4CL、C4H和C2′H表达水平均有所上升,尤其是PAL和4CL达到峰值,比对照组上升了1.2倍,差异有统计学意义(P<0.05)。8 h后,4CL和C2′H基因表达水平有所上升,12 h后,PAL、4CL和C4H基因表达水平上升;当处理24 h后,4CL和C4H基因表达量比对照组略微上调。而下游途径COMT-S和GXM基因表达量在不同盐胁迫处理时间下较对照组均明显下降。
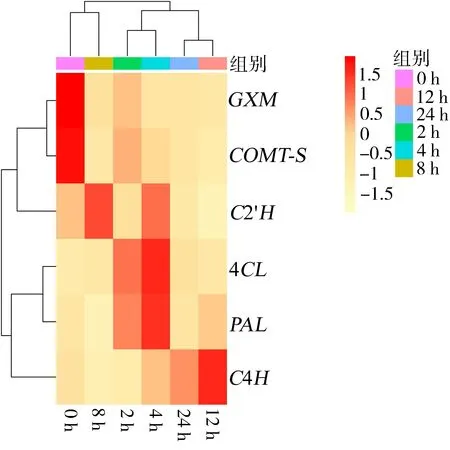
图2 香豆素合成途径关键酶基因的相对表达水平热图
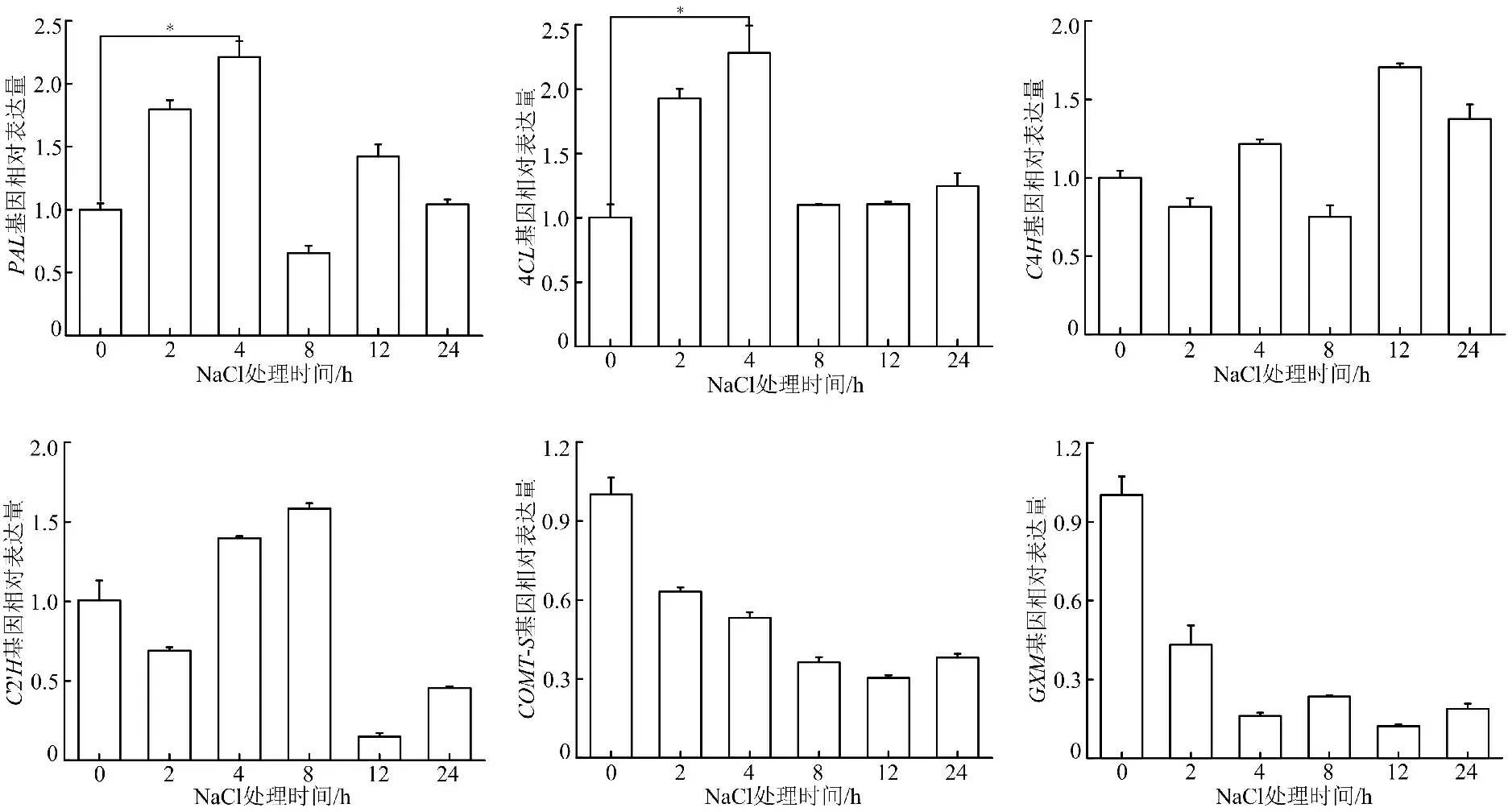
注:与0 h比较,*P<0.05图3 在盐胁迫过程中白花前胡香豆素合成途径关键酶基因的相对表达水平比较
根作为直接与土壤接触的器官,不但要吸收水分和养分,也会生成多种次生代谢产物,在盐胁迫条件下,根系活力与生长状况将直接影响植物的生长发育,植物在盐胁迫下受到诱导表达增强的基因,可能与其参与盐胁迫调控有关[21]。本实验系统分析了白花前胡香豆素生物合成途径关键酶基因的保守结构域,关键酶基因编码蛋白含有各自特殊的保守结构域,也有着特殊的功能,通过对基因在盐胁迫下的表达水平变化分析发现基因表达趋势各有所不同。与对照组比较,5个时间段的4CL在盐胁迫下的表达均有不同程度的上升;在盐胁迫处理2、4、12 h时,PAL基因表达出现上升趋势。PAL通常对植物的逆境胁迫应答起到重要作用。C4H在受到盐胁迫4、12、24 h时,表达活性得到增加,C4H是苯丙烷途径的第2个关键酶,属于细胞色素单加氧酶P450超家族成员,其表达活性受到环境因素的重要影响。逆境胁迫下,植物可通过调节相关酶基因的转录水平,从而增强植物的抗逆性,上述基因的表达水平在受到盐胁迫后上升,推测其可能提高植物对盐胁迫的耐受性。然而,香豆素生物合成关键酶在盐胁迫时涉及的具体通路和作用还有待进一步研究。
本研究发现,白花前胡香豆素生物合成关键酶基因在盐胁迫环境下,基因表达水平出现不同的响应程度,提示盐逆境因子对调控白花前胡香豆素的生物合成具有极其重要的作用,为研究编码关键酶基因的蛋白家族奠定了基础,对进一步揭示和利用白花前胡香豆素合成途径关键酶基因的功能提供理论依据。
