黄芪-丹参对动脉粥样硬化大鼠肠道菌群的影响
2022-08-17仇晓夏
仇晓夏,常 成
(1.江苏省南通卫生高等职业技术学校,江苏 南通 226000; 2.南京中医药大学第二附属医院,江苏 南京 210017)
动脉粥样硬化(atherosclerosis,AS)[1]是高血压、肥胖、血脂异常、遗传、糖尿病等多种因素作用于不同环节引起的疾病,其主要病理特点为脂质沉积,可伴有平滑肌细胞和纤维基质增生[1-2]。AS可引起严重的心脏病和脑卒中,约占所有心脑血管疾病死亡人数的50%[3]。越来越多的证据[4-5]证明,肠道菌群与AS等心血管疾病的发生发展密切相关,有望成为疾病治疗的新靶点。
AS随年龄的增长而发病率逐渐增加,可导致脑卒中、冠心病等疾病,辨证属于气虚血瘀证的,治以益气活血法,临床常以黄芪-丹参作为基础方进行加味。其中,黄芪补气,丹参活血,二者合用,共奏益气活血、推陈出新之功[6]。现代药理学研究[7-8]表明,黄芪-丹参可通过多种途径和靶点增强免疫功能、扩张血管、增强心肌收缩力和抑制血栓形成,广泛用于心脑血管疾病的治疗。目前,黄芪-丹参干预AS的作用机制尚不明确。因此,本研究基于肠道菌群角度,初步探究黄芪-丹参治疗AS的机制。
1 材料
1.1 动物 SPF级SD雄性大鼠24只,体质量(220±20)g,购自杭州医学院[生产许可证号:SCXK(浙)2019-0002]。本次动物实验经南通大学实验中心实验动物伦理委员会批准。
1.2 药物及试剂 黄芪(批号20210118)、丹参(批号20210203)饮片均购自南京中医药大学第二附属医院,经该院药剂科徐宏彬主任鉴定为正品,凭证标本存放在该院。辛伐他汀片(国药准字 H20083839,每片20 mg):山东鲁抗医药集团赛特有限责任公司;维生素D3注射液(国药准字 H20058981,每支30万单位):浙江仙琚制药股份有限公司;4%多聚甲醛(批号 BL539A):Biosharp公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(货号 SEKR-0009)、白细胞介素-6(interleukin-6, IL-6)(货号 SEKR-0005)、白细胞介素-1β(interleukin-1β,IL-1β)(货号 SEKR-0002):北京索莱宝科技公司;苏木素-伊红(hematoxylin-eosin,HE)(批号 BP-DL001):南京森贝伽生物公司;普通饲料、高脂饲料(含2%胆固醇、10%猪油、88%普通饲料):江苏协同医药生物公司;AxyPrep DNA凝胶回收试剂盒、E.Z.N.A.®DNA抽提试剂盒、ELISA试剂盒、NEXTFLEX®DNA试剂盒:上海美吉生物公司。
1.3 仪器与设备 生物显微镜(型号BX53):日本Olympus公司;酶联免疫检测仪(型号 Multiskan MK3):美国Thermo公司;全自动生化分析仪(型号 Hitachi7170A):日本日立公司;病理切片机(型号 RM2235):德国Leica公司;光度计(型号 ND2000)、核酸电泳仪(型号 DYY-6C)、高灵敏荧光计(型号 QuantusTM)、PCR仪(型号 9700)、测序平台(型号 Miseq PE300):美吉生物公司。
2 方法
2.1 黄芪-丹参水煎液制备 取黄芪30 g、丹参15 g,称取药材后加入10倍容积水浸润2 h后煎煮,煎煮1 h后过滤,随后滤渣加入8倍容积水继续煎煮1 h,合并2次滤液并浓缩[9],最后得到生药量为1.0 g/mL黄芪-丹参水煎液,保存于4 ℃环境中备用。
2.2 大鼠模型的复制及分组 将SD大鼠适应性饲养7 d后,随机分为4组(空白组、模型组、辛伐他汀组和黄芪-丹参组),每组6只。空白组大鼠给予普通饲料喂养。参考文献[9]方法复制AS动物模型,即每日以高脂饲料喂养,第3天腹腔注射7×105U/kg维生素D31次,持续喂养8周。模型复制同时灌胃给药,其中辛伐他汀组给予1 mg/kg(为60 kg成人剂量)辛伐他汀,黄芪-丹参组给予0.75 g/kg(60 kg成人剂量)黄芪-丹参水煎液,空白组和模型组给予等容积生理盐水,每天灌胃1次。
2.3 动物处死与取材 采用二氧化碳吸入法处死大鼠,处死方法符合实验动物伦理要求。具体方法:末次给药后禁食12 h,随后置于安乐死箱内,充满100%二氧化碳(每分钟置换率为10%~30%箱内体积),随后采集大鼠血清,用液氮速冻结肠内容物,4%多聚甲醛固定保留胸主动脉。
2.4 大鼠血脂及细胞因子水平检测 3 500 r/min离心,分离血清,采用全自动生化分析仪检测血清总胆固醇(total cholesterol, TC)、三酰甘油(triacylglycerol, TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)水平,依据ELISA试剂盒步骤检测血清TNF-α、IL-6、IL-1β水平。
2.5 大鼠胸主动脉病理学检查 取固定后的胸主动脉,使用梯度浓度乙醇及二甲苯脱水,石蜡包埋,储存备用。将上述胸主动脉蜡块切片并脱蜡,根据说明书进行HE染色,随后使用显微镜观察并拍照。
2.6 结肠内容物DNA抽提和PCR扩增 依据DNA抽提试剂盒说明书,抽提各组大鼠结肠内容物肠道菌群总DNA,通过凝胶电泳法检测其质量,通过紫外分光光度法对其DNA进行定量分析。基于338F-806R测序区域进行16S rRNA PCR扩增,扩增程序及反应体系与文献[10]的方法一致。
2.7 结肠内容物Illumina Miseq测序 依据DNA凝胶回收试剂盒说明书,纯化回收的PCR产物。通过凝胶电泳检测其质量,通过荧光法对其进行定量分析。按照DNA快速测序试剂盒说明书建库并在IlluminaMiseq PE300平台测序,得到原始序列。将上述序列导入Trimmomatic进行质量控制,并通过Flash进行拼接,质量控制及拼接参数与文献[10]的方法一致,优化序列。
2.8 数据处理与分析 运用生信云(https://cloud.majorbio.com/)将处理后的序列归为多个无嵌合体操作分类单元(operational taxonomic unit, OTU)(97%相似度);利用Uparse云软件(v7.0.1090)进行OTU分析、Alpha多样性分析、稀释曲线分析和Rank-Abundance曲线分析;利用生信云tax_summary_a文件夹中数据进行群落组成分析;利用Qiime云软件(v1.9.1)和R云软件(v3.3.1)进行主成分分析(principal component analysis, PCA)、主坐标分析(principal co-ordinates analysis,PCoA)和非度量多维尺度分析(non-metric multidimensional scaling,NMDS);利用R云软件(v3.3.1)和Python云软件(v3.9)进行组间比较;利用生信云进行LEfSe多级物种差异比较。以上云均由美吉生物公司提供。
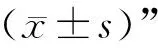
3 结果
3.1 4组大鼠血脂水平比较 与空白组比较,模型组大鼠血清TC、TG、LDL-C水平明显升高(P<0.05),HDL-C水平明显降低(P<0.05);与模型组比较,辛伐他汀组和黄芪-丹参组大鼠血清TC、TG、LDL-C水平明显降低(P<0.05),HDL-C水平明显升高(P<0.05)。结果提示AS大鼠出现高脂血症,而黄芪-丹参可改善AS大鼠血脂水平。见图1。
注:A.空白组;B.模型组;C.辛伐他汀组;D.黄芪-丹参组;与空白组比较,*P<0.05;与模型组比较,#P<0.05图1 4组大鼠血脂水平比较
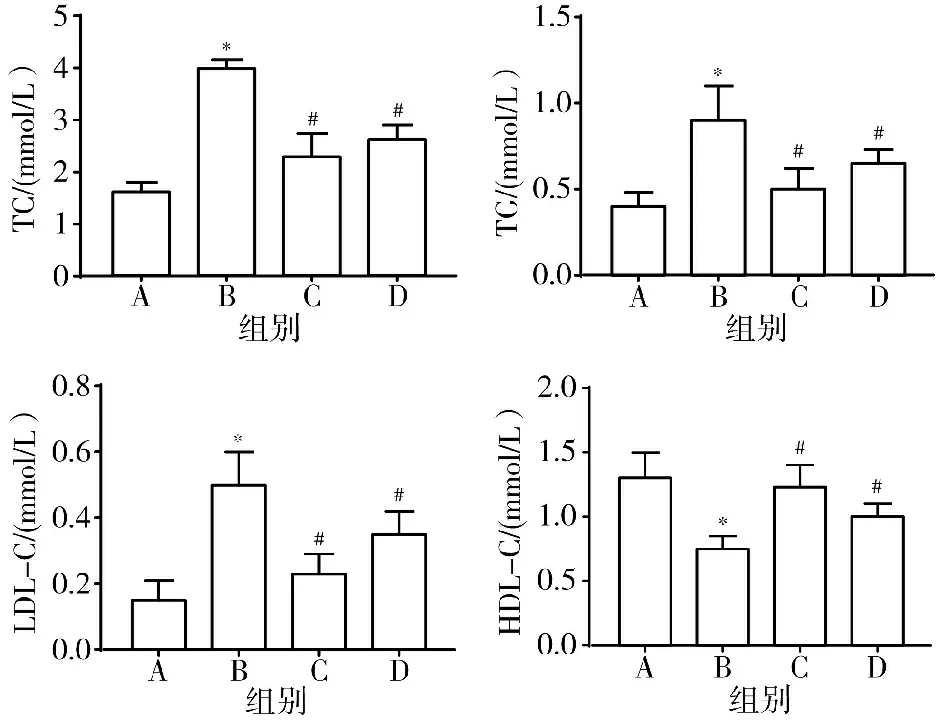
3.2 4组大鼠血清TNF-α、IL-6、IL-1β水平比较 与空白组比较,模型组大鼠血清TNF-α、IL-6、IL-1β水平明显升高(P<0.05);与模型组比较,辛伐他汀组和黄芪-丹参组TNF-α、IL-6、IL-1β水平明显降低(P<0.05)。结果提示黄芪-丹参可抑制AS大鼠炎症水平。见图2。
注:A.空白组;B.模型组;C.辛伐他汀组;D.黄芪-丹参组;与空白组比较,*P<0.05;与模型组比较,#P<0.05图2 4组大鼠血清TNF-α、IL-6、IL-1β水平比较
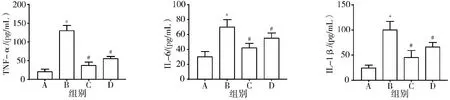
3.3 4组大鼠胸主动脉组织形态变化比较 空白组大鼠胸主动脉内皮光滑,无明显损伤,呈健康状态;模型组大鼠胸主动脉血管内皮损伤严重,可见明显蓝色钙状斑块;辛伐他汀组和黄芪-丹参组大鼠胸主动脉血管内皮无明显损伤及增厚,大致恢复正常。结果提示黄芪-丹参可抑制AS大鼠动脉硬化。见图3。
注:A.空白组;B.模型组;C.辛伐他汀组;D.黄芪-丹参组图3 4组大鼠胸主动脉组织形态变化(HE染色,10×20倍)
3.4 3组大鼠肠道菌群物种注释与评估 3组大鼠肠道菌群优化后序列数目为1 433 784,碱基数目为595 743 075,平均长度为415 bp,序列长度分布在400~440 bp范围内,符合16S rRNA(V3-V4)要求,后续分析可靠。如图4a所示,本研究Shannon曲线图中,各组曲线均趋于平坦,提示各组数据量满足测序要求;其值较高,提示各组微生物多样性得到较全面反映。如图4b所示,本研究Rank-Abundance曲线中,各组平缓且较大范围下降,提示各大鼠肠道菌群物种分布均匀且丰富度高。
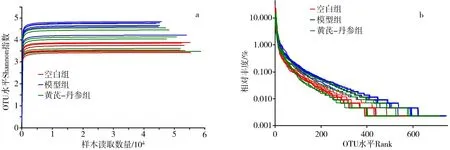
图4 大鼠肠道菌群Shannon曲线(a)和Rank-Abundance曲线(b)
3.5 3组大鼠肠道菌群Alpha多样性分析 与空白组比较,模型组Berger-Parker指数和Simpson指数明显降低(P<0.05),提示AS大鼠肠道菌群多样性明显下降;与模型组比较,黄芪-丹参组Berger-Parker指数和Simpson指数明显升高(P<0.05)。结果提示黄芪-丹参可改善AS大鼠肠道菌群多样性。见图5。
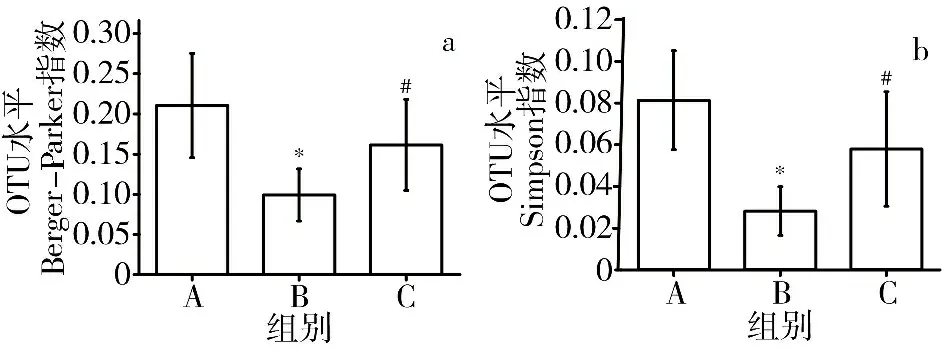
注:A.空白组;B.模型组;C.黄芪-丹参组;与空白组比较,*P<0.05;与模型组比较,#P<0.05图5 3组大鼠肠道菌群Berger-Parker指数(a)和Simpson指数(b)比较
3.6 3组大鼠肠道菌群Beta多样性分析 3组所有样本各自聚集在一起,其中模型组与空白组距离较远,而空白组、黄芪-丹参组距离较为接近。结果提示黄芪-丹参可使AS大鼠肠道菌群趋于正常。见图6。
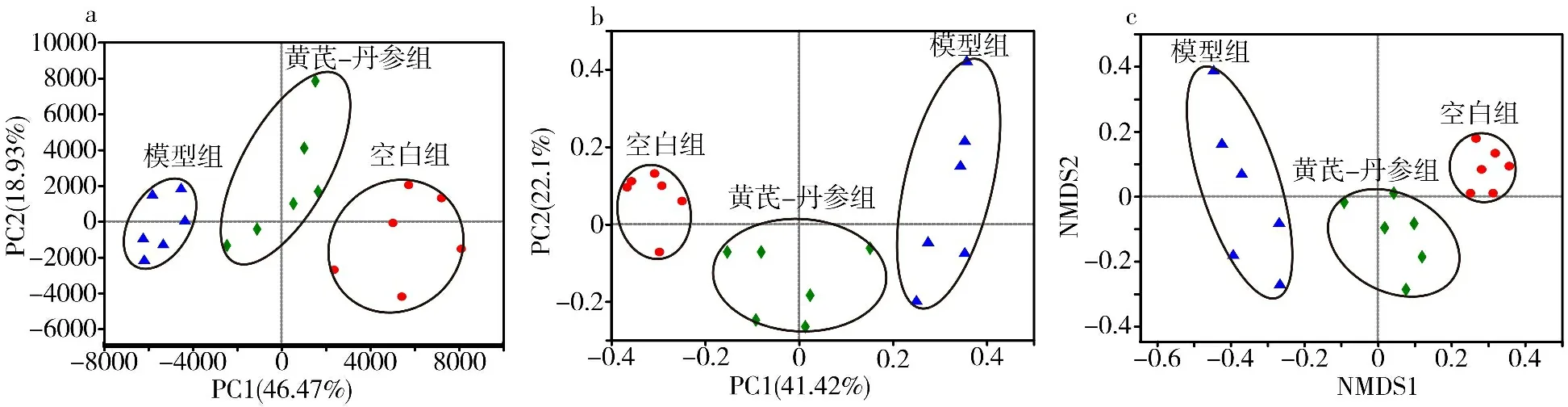
图6 3组大鼠肠道菌群Beta多样性的PCA(a)、PCoA和NMDS(c)结果
3.7 大鼠肠道菌群物种组成及差异分析
3.7.1 门水平物种组成及差异分析 如图7a所示,3组大鼠肠道菌群的优势物种主要有7种(筛选条件:群落丰度>0.01%),为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、疣微菌门(Verrucomicrobia)和髌骨细菌门(Patescibacteria)。如图7b、7c、7d所示,与空白组比较,模型组放线菌门群落丰度明显降低(P<0.05),变形菌门和疣微菌门群落丰度明显升高(P<0.05);与模型组比较,黄芪-丹参组放线菌门群落丰度明显升高(P<0.05),变形菌门和疣微菌门群落丰度明显降低(P<0.05)。结果提示AS大鼠放线菌门丰度降低,变形菌门和疣微菌门丰度升高,而黄芪-丹参可提高AS大鼠上述门水平优势物种群落丰度。

注:A.空白组;B.模型组;C.黄芪-丹参组;与空白组比较,*P<0.05;与模型组比较,#P<0.05图7 3组大鼠肠道菌群门水平组成及差异分析
3.7.2 属水平物种组成及差异分析 如图8a所示,3组大鼠肠道菌群在属水平的优势物种主要有13种(筛选条件:群落丰度>0.03%),为乳杆菌属(Lactobacillus)、罗姆布茨菌属(Romboutsia)、unclassified_f_Lachnospiraceae、布劳特氏菌属(Blautia)、norank_f_Muribaculaceae、Allobaculum、绿脓杆菌属(Turicibacter)、双歧杆菌属(Bifidobacterium)、Clostridium_sensu_stricto_1、Ruminococcaceae_UGG-014、unclassified_f_Ruminococcaceae、Lachnospiraceae_NK4A136_group和杜氏杆菌属(Dubosiella)。如图8b、8c、8d、8e、8f、8g所示,与空白组比较,模型组乳杆菌属、双歧杆菌属和杜氏杆菌属群落丰度明显降低(P<0.05),布劳特氏菌属、unclassified_f_Ruminococcaceae和Lachnospiraceae_NK4A136_group群落丰度明显升高(P<0.05);与模型组比较,黄芪-丹参组乳杆菌属、双歧杆菌属和杜氏杆菌属群落丰度明显升高(P<0.05),布劳特氏菌属、unclassified_f_Ruminococcaceae和Lachnospiraceae_NK4A136_group群落丰度明显降低(P<0.05)。提示AS大鼠乳杆菌属、双歧杆菌属和杜氏杆菌属丰度降低,布劳特氏菌属、unclassified_f_Ruminococcaceae和Lachnospiraceae_NK4A136_group丰度升高,而黄芪-丹参可提高AS大鼠上述属水平优势物种群落丰度。
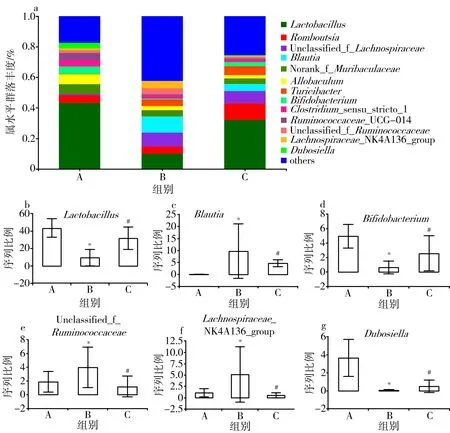
注:A.空白组;B.模型组;C.黄芪-丹参组;与空白组比较,*P<0.05;与模型组比较,#P<0.05图8 3组大鼠肠道菌群属水平组成及差异分析
4 讨论
肠道菌群与宿主长期共同进化,参与宿主多种代谢途径的调节,形成与肠道、肝脏和大脑功能相关的免疫炎症轴,进而对宿主产生全身作用[11]。越来越多的证据表明,肠道菌群通过调控炎症和代谢产物参与AS等心血管疾病的发生发展[12]。肠道菌群失调衍生的脂多糖可通过调节Toll样受体(Toll-like receptors, TLRs)及其下游MyD88、核因子-κB(nuclear factor-kappa B,NF-κB),促进IL-6、IL-1、IL-27和TNF-α等细胞因子的生成,进而增加患AS的风险[13-14]。肠道菌群代谢或共代谢产物,三甲胺-N-氧化物(trimethylamine-N-oxide, TMAO)在血浆中水平与AS形成及AS斑块大小呈正相关[15];次级胆汁酸进入门静脉循环后作为信号分子介导胆固醇积累、泡沫细胞和AS斑块的形成,影响AS的发生发展[16-17]。
黄芪、丹参为临床治疗心脑血管疾病的常用药对。研究显示,黄芪总皂苷可能通过调控脂质代谢相关蛋白的表达,改善AS[18];黄芪多糖可能通过激活丝裂原活化蛋白激酶信号通路,活化内皮型一氧化氮合酶以及抑制尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4表达,抑制糖尿病AS的形成[19]。丹参中酚酸类成分可通过减轻氧化应激水平,保护血管内皮功能,改善微循环等,发挥抗AS作用[20];丹参素可能通过调控TLR-NF-κB通路,抑制心肌细胞凋亡和炎症反应,进而呈剂量依赖性地改善AS[21]。本研究显示,AS大鼠模型血脂水平升高,血清TNF-α、IL-6、IL-1β水平明显上升,胸主动脉血管内皮损伤严重,伴有明显的蓝色钙状斑块。而黄芪-丹参干预后,大鼠血脂和炎症因子水平均得到改善,胸主动脉病变得到纠正,提示黄芪-丹参对AS大鼠具有明确的治疗作用。
高丰度的变形菌门往往是肠道菌群失调的微生物标志,亦是肠道炎症的诱因之一[22]。乳杆菌属为肠道内有益菌群,其可激活调节性T细胞,抑制辅助性T细胞,影响巨噬细胞亚群比例,进而调节免疫,抑制AS相关炎症[23]。双歧杆菌可通过参与三甲胺(trimethylamine, TMA)-TMAO调节和改善脂质代谢,最终缓解TMAO引起的AS[24]。本研究显示,AS大鼠肠道菌群多样性明显下降,提示AS疾病进展伴随肠道菌群的失调。当黄芪-丹参干预后,大鼠肠道菌群多样性得到恢复,门和属水平相应优势物种丰度得到纠正,说明黄芪-丹参具有调节AS大鼠肠道菌群的作用。
综上,黄芪-丹参对AS大鼠具有明确的治疗作用,该作用可能与其对AS大鼠肠道菌群失调的改善有关,研究结果可为黄芪-丹参临床治疗AS提供有益思路。
