Tfam基因敲除对树突状细胞基因表达的高通量RNA测序分析
2022-08-17方雪纯郭惠芳管红兵冷启彬任赛赛郑雁翎冯丹
方雪纯,郭惠芳,管红兵,冷启彬,任赛赛,郑雁翎,冯丹
(1.广州医科大学附属口腔医院,广东省口腔组织修复与重建工程技术研究中心,广州市口腔再生医学基础与应用研究重点实验室,广东 广州 510182;2.广州医科大学,广东 广州 510182;3.广州医科大学附属肿瘤医院,广东 广州 510182;4.佛山复星禅城医院, 广东 佛山 528000)
Tfam是一个编码线粒体转录因子A(mitochondrial transcription factor A,TFAM)的核基因,是一种DNA结合蛋白, 是维持线粒体DNA(mitochondrial DNA, mtDNA)正常功能的重要因子[1]。它既稳定mtDNA又启动了mtDNA复制,其在mtDNA代谢中起着至关重要的作用[1-2]。线粒体是负责调节骨骼肌代谢状态的关键细胞器,这些细胞器通过调整其体积、结构和功能来对慢性运动、衰老和疾病作出反应[3]。作为序列特异性转录因子,TFAM与轻链启动子和重链启动子1的上游结合以激活转录的启动。TFAM与mtDNA的比例对于维持不同小鼠组织中的正常mtDNA表达至关重要。适度增加的TFAM蛋白水平会增加mtDNA拷贝数,但保持正常的TFAM与mtDNA比率,导致mtDNA表达不变,动物代谢正常。TFAM与2个mtDNA启动子的特异性结合导致通过招募线粒体RNA聚合酶和线粒体转录因子B2来转录激活[4]。典型的哺乳动物类核细胞含有mtDNA的单个拷贝,并且具有不规则的,略微细长的结构[5]。线粒体在细胞生理学中起着关键作用,负责产生细胞能量和必需代谢物,以及调节细胞凋亡[6]。这些功能依赖于线粒体和细胞核中的基因表达,并通过线粒体和其他细胞器之间的通信进行调节。研究表明,mtDNA拷贝数减少与几种衰老相关的病理有关;一种被认为导致神经退行性疾病的常见途径是线粒体功能障碍[7-8]。TFAM作为启动线粒体转录有效识别过程中启动子选择的关键因素的作用已被证实[9]。
CD11c,也称为整合素αX,是树突状细胞使用最广泛的定义标志物[10]。树突状细胞是最强大的抗原提呈细胞,其功能对于启动和调节细胞免疫反应至关重要。树突状细胞在分化后表现出浓缩的线粒体数量的增加,并且其能量代谢发生动态变化[11]。树突状细胞分化过程的特征在于线粒体呼吸复合物的表达水平和活性增加,以及mtDNA拷贝数增加。
调节性T细胞(regulatory T cells,Tregs)中Tfam的敲除会损害稳定状态下非淋巴组织和肿瘤中的Tregs细胞的稳定。Tfam敲除的Tregs在体外葡萄糖缺乏时具有减少增殖和Foxp3表达的作用。Tregs中Tfam的敲除会影响Tregs的稳定性,导致结肠炎中的组织炎症[12]。
关于Tregs细胞敲除的Tfam基因已有相关研究[12-13],而还没未有小鼠脾脏组织CD11c细胞敲除的Tfam基因在转录组学测序的相关报道。本研究通过应用Cre-loxP系统构建条件性基因敲除小鼠,构建Tfamfl/flCD11ccre小鼠,提取小鼠脾脏组织CD11c+树突状细胞进行mRNA转录组测序,对DEGs进行功能和通路的富集分析,找到可能影响线粒体能量代谢的潜在分子机制。
1 材料与方法
1.1 动物来源与实验分组及基因型鉴定
本课题所用小鼠由广州医科大学附属肿瘤医院冷启彬老师赠送。所有小鼠于广州医科大学实验动物中心饲养,3只/笼,小鼠饮水及进食自由。Tfamfl/flCD11ccre小鼠为实验组(n=3),同笼出生的cre重组酶未表达的Tfamfl/fl小鼠为对照组(n=3)。
剪小鼠尾巴做基因鉴定:
Cre引物序列为:F5:5′-ACTTGGCAGCTGTCTCCAAG-3′;
R5:5′-GCGAACATCTTCAGGTTCTG-3′(PCR产物大小为313bp);
Tfam-F1: 5′-CTTGTAGGTCCTCCCCACTG-3′;
Tfam-F2: 5′-ACAGCACCAACCCAAAGTGT-3′(PCR 产物大小为257bp)。
1.2 CD11c+细胞的分选
将小鼠处死后,打开小鼠腹腔,取出脾脏,放入含2%胎牛血清的PBS缓冲液中,用注射器研磨小鼠脾脏,经70 um细胞筛过滤后离心,倒掉上清,用红细胞裂解液裂解红细胞,离心去上清,再用含2%胎牛血清的PBS缓冲液清洗细胞2遍。利用磁珠分选试剂盒(STEMCELL)分选小鼠脾脏CD11c+细胞,用PE-CD11c流式抗体(Biolegend)在流式细胞分析仪(BD FACS CantoⅡ)验证CD11c纯度。
1.3 Trizol法提取RNA
采用Trizol法提取2组小鼠CD11c+树突状细胞的总RNA,用NanoDrop ND-1000检测RNA浓度和纯度。用变性琼脂糖凝胶电泳检测RNA的完整性。
1.4 文库的构建、测序及DEGs分析
mRNA测序由康成生物(数谱生物)完成,将2组小鼠脾脏组织分选出的CD11c+树突状细胞抽提总RNA分别进行构建测序文库。总RNA样品用oligo dT富集mRNA(rRNA去除)后再选用KAPA Stranded RNA-Seq Library Prep Kit(Illumina)构建文库,文库构建流程中双链cDNA合成使用dUTP方法结合后续高保真PCR聚合酶作用,使最终生成的RNA测序文库具有链特异性。构建好的文库通过Agilent 2100 Bioanalyzer 鉴定文库质量,并用qPCR方法进行文库定量。使用Illumina NovaSeq 6000测序仪进行测序。基因的表达定量分析分为为Gene Level和 Transcript Level两个级别,由软件StringTie比对已知的转录组,进行转录本丰度计算,通过Ballgown软件计算基因和转录本的FPKM值,采用组内FPKM均值≥0.05过滤低丰度基因和转录本采用组间log2FC≥0.585且P值≤0.05的基因筛选为DEGs和转录本。
1.5 功能和通路的富集分析
采用GO(gene ontology)数据库分析DEGs的生物学功能和作用。基因功能富集分析包括描述基因参与的生物过程(biologicalprocess, BP)、所处的细胞位置(cellular component, CC)和分子功能(molecular function, MF)。采用KEGG数据库对DEGs进行相关通路富集分析。利用R包stringr联合本地脚本对DEGs做GO、KEGG富集分析。采用富集基因数目≥2,且Fisher’s精确检验计算出的P值≤0.05的注释条目,认为具有显著富集的条目。
1.6 实时荧光定量PCR验证
引物设计及合成由上海捷瑞生物工程有限公司完成,引物序列如下:
GADPH-F:5′-TGACCACAGTCCATGCCATC-3’
GADPH-R:5’-GACGGACACATTGGGGGTAG-3’
Cdk5rap1-F:5’-ACCTCCCTATCTCTCGGGG-3’
Cdk5rap1-R:5’-AGGCTATCTCTGTGTCGTTCA-3’
Ndufaf4-F:5’-CACCGGAGTCAGTATCCAGAA-3’
Ndufaf4-R:5’-GGTTCAACTTTTACCGGCAAGG-3’
Plcb1-F:5’-TCCATCTTCGAGGAATGACTCC-3’
Plcb1-R:5’-CCGTCAGGTACGGTTTGCTT-3’
Plcb4-F:5’-AGTGCTAGAATGTTCCCTCATCA-3’
Plcb4-R:5’-GAAGCCGATATTCACCAGATCC-3’
Cxcr2-F:5’-ATGCCCTCTATTCTGCCAGAT-3’
Cxcr2-R:5’-GTGCTCCGGTTGTATAAGATGAC-3’
试验从差异表达基因中挑选了一部分进行了实时荧光定量 PCR(qPCR)验证。使用反应体系为20 μL:10 μL的SYBR Premix Ex Taq II(2×),2 μL的cDNA模板,各0.4 μL的上下游引物和 7.2 μL的ddH2O。反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共39个循环, 65 ℃ 5 s。以GADPH 作为内参基因,用 2-ΔΔCt方法计算相对表达量。
2 结 果
2.1 磁珠分选小鼠脾脏组织CD11c细胞的纯度
经磁珠分选试剂盒分选小鼠脾脏的CD11c细胞,并通过流式细胞仪验证分选纯度均在90%以上,见图1。
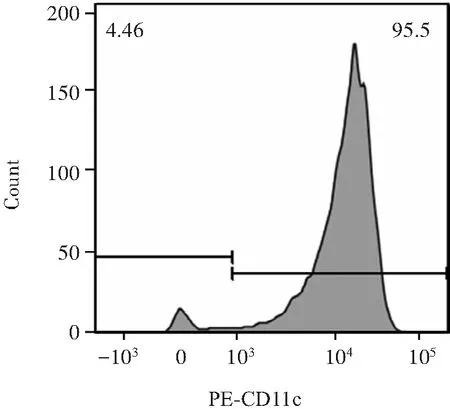
图1 流式细胞术分析从小鼠脾脏组织分离CD11c+树突状细胞纯度
2.2 小鼠基因鉴定
用Cre-loxP系统构建条件性基因敲除小鼠主要分2部分:(1)构建具有loxP序列的目的基因突变小鼠;(2)构建带有Cre酶基因的转基因Cre小鼠。两种小鼠杂交后经筛选可得到细胞内同时存在Cre重组酶基因和loxP序列的小鼠,通过Cre重组酶特异性识别CD11c+树突状细胞内Tfam基因的loxP序列,敲除loxP序列上的Tfam基因,从而达到特异性敲除CD11c+树突状细胞上的Tfam基因的目的。
只有257 bp条带表示两条等位基因上都有loxP位点,即Tfamfl/fl,CD11ccre表达的条带在313bp处,即286、287、289号,为Tfamfl/flCD11ccre小鼠,CD11ccre未表达的285、288、290号为Tfamfl/fl小鼠,见图2。
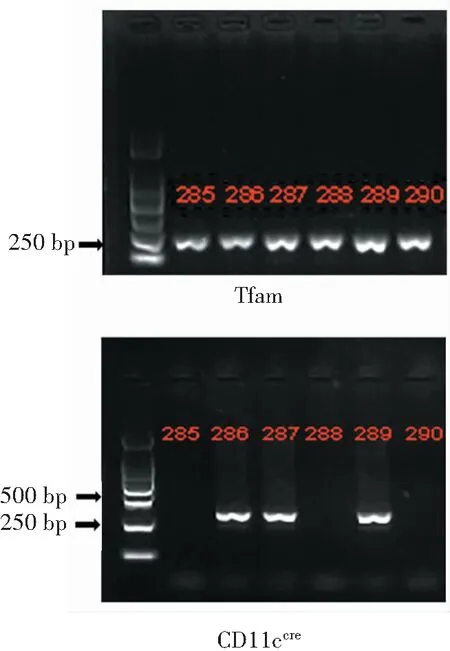
图2 小鼠基因鉴定
2.3 差异表达基因
以Tfamfl/fl小鼠脾脏的CD11c+树突状细胞为对照组,从2组小鼠共筛选出140个差异表达的基因(图3),其中上调的基因有84个(红色),下调的基因有56个(绿色)。采用组内FPKM均值≥0.05过滤低丰度基因和转录本采用组间log2FC≥0.585且P值≤0.05的基因筛选为具有显著统计学差异的基因,共筛选出48个DEGs(图4,表1),其中28个表达上调(红色),20个下调(绿色)。对这48个DEGs进行染色体定位(图5),发现DEGs在2号染色体最多,其次是9号。图6的聚类热图显示筛选出的DEGs的上下调水平,红色代表上调,绿色代表下调。

图5 小鼠脾脏组织CD11c+树突状细胞的差异基因在各染色体上的分布
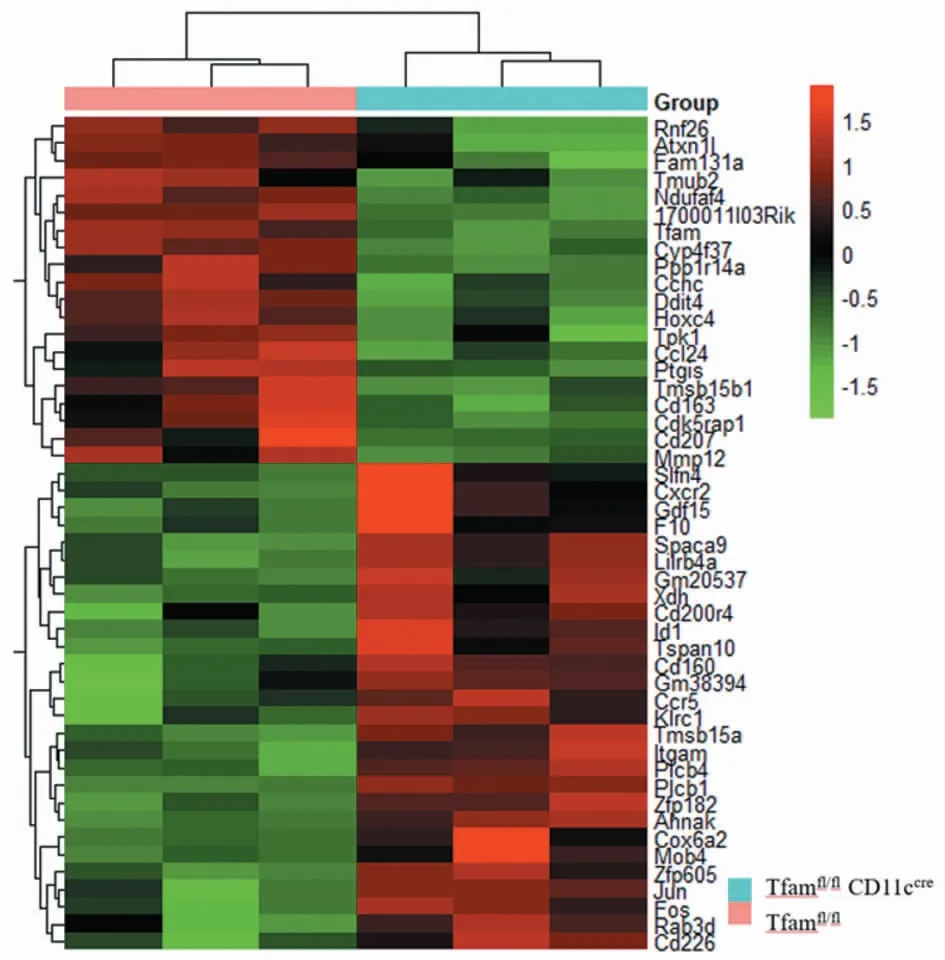
图6 小鼠脾脏组织CD11c+树突状细胞的DEGs表达聚类热图

表1 差异表达基因
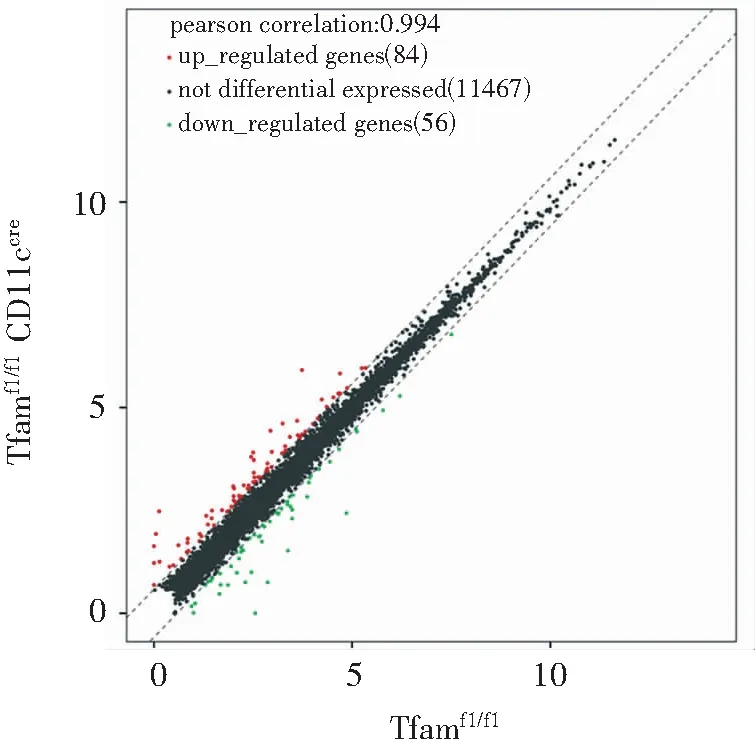
图3 小鼠脾脏组织CD11c+树突状细胞的差异基因表达散点图
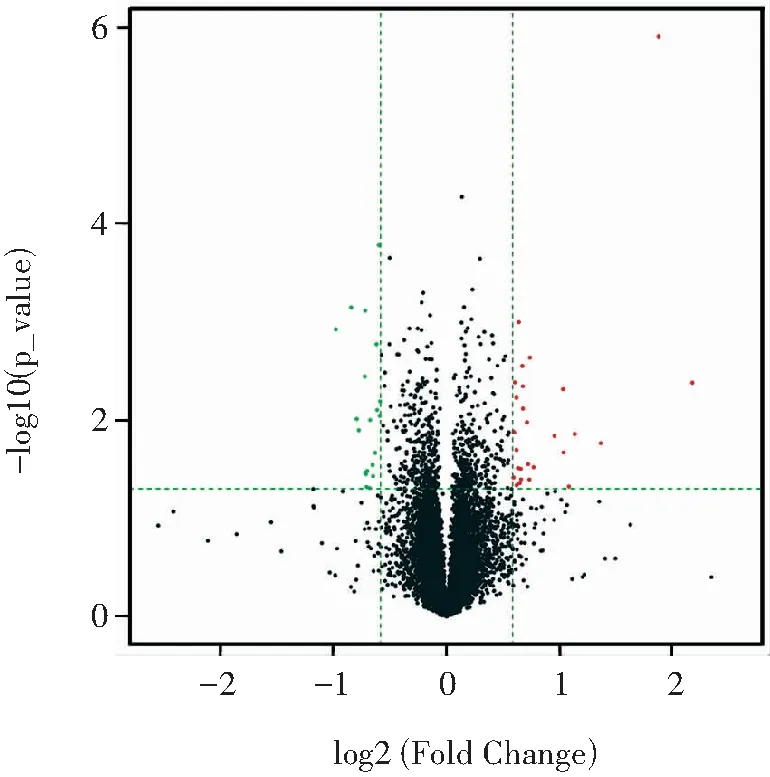
图4 小鼠脾脏组织CD11c+树突状细胞的DEGs表达火山图
2.4 GO富集分析
以Tfamfl/fl小鼠脾脏的CD11c+树突状细胞为对照组,GO富集分析结果(表2-3):

表2 上调DEGs的GO富集分析
上调的DEGs参与的BP与291种GO富集条目有关,按富集得分排序,选取得分前五的GO富集条目,参与的BP细胞杀伤的正向调节、免疫系统过程的调节等有关,相关的DEGs分别是Ccr5、Cd160、Cd226、Cxcr2、Itgam等;下调的DEG参与的BP与89种 GO 富集条目有关,按富集得分排序,选取得分前五的GO富集条目,参与的BP与线粒体有关的GO 富集条目有线粒体中的RNA代谢过程、线粒体基因表达、线粒体呼吸链复合体组装,相关的DEGs分别是Cdk5rap1、Tfam、Ndufaf4。
上调的DEGs与CC有关的GO 富集条目有28种,按富集得分排序,选取得分前五的GO富集条目,上调的DEGs主要位于质膜外侧、AP-1转录因子复合体等细胞位置,对应位置相关的DEGs为Ccr5、Cd200r4、Cd226等;下调的差异表达基因与CC有关的GO 富集条目只有1种,位于线粒体,对应的DEGs是Cdk5rap1、Ddit4、Ndufaf4、Tfam。
上调的DEGs与MF有关的GO 富集条目有48种,按富集得分排序,选取得分前五的GO富集条目,上调的DEGs的分子功能与蛋白质结合、主要组织相容性复合物I b受体反应等有关,相关的DEGs分别是Ahnak、Ccr5、Cd160、Cd200r4、Cd226、Cxcr2、Fos、Gdf15、Id1、等;下调的差异表达基因与MF有关的GO 富集条目只有5种,下调的DEGs的分子功能与泛素蛋白连接酶活性、泛素-蛋白转移酶活性等有关,相关的DEGs分别是Ccnc、Rnf26、Cdk5rap1、Tpk1、Atxn1l、Hoxc4、Mmp12、Tfam。
表3 下调DEGs的GO富集分析
2.5 KEGG富集分析
KEGG富集分析显示,以Tfamfl/fl小鼠脾脏的CD11c+树突状细胞为对照组,DEGs与83条信号通路有关,按照富集得分,选取前10条通路(图7),差异表达的基因与恰加斯病、松弛素信号通路、雌激素信号通路、催产素信号通路等有关,相关的DEGs为Fos、Jun、Plcb1、Plcb4、Itgam、Lilrb4a、Ccr5、Cxcr2、Id1。
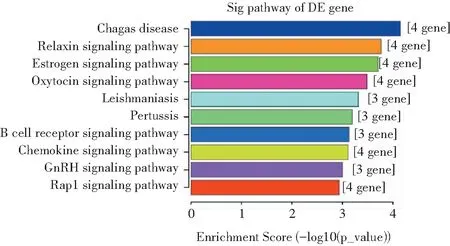
图7 DEGs前10位的KEGG富集分析结果
2.6 qPCR验证
选取一部分与GO和KEGG分析显示DEGs主要富集在免疫系统过程的调节、免疫相关的反应、线粒体代谢、线粒体基因的表达等相关的基因Cdk5rap1、Ndufaf4、Plcb4、Cxcr2、Plcb1进行验证,验证结果与测序结果一致(图8)。

注:*P<0.05,**P<0.001
3 讨 论
本研究以Tfamfl/fl小鼠脾脏组织的CD11c+树突状细胞为对照组,通过GO分析,下调的差异表达基因参与的生物过程与线粒体中的RNA代谢过程、线粒体基因表达及线粒体呼吸链复合体组装有关,相关的DEGs分别是Cdk5rap1、Tfam、Ndufaf4。Ndufaf4即泛醌氧化还原酶复合物组装因4,是一种蛋白质编码基因。与Ndufaf4相关的疾病有线粒体复合物I缺乏症,Ndufaf4的替换恢复了患者细胞中的复合物I活性[14]。Cdk5rap1即Cdk5 调节亚基相关蛋白1,Cdk5rap1是一种作用于细胞核和线粒体RNA的甲硫转移酶[15]。下调的DEGs与CC有关的GO 富集条目只有1种,下调的DEGs的细胞位置位于线粒体。Tfam基因与线粒体基因的表达有关,当Tfam基因下调时,线粒体相关基因Cdk5rap1、Ndufaf4表达减少。
通过GO分析,上调的DEGs参与的生物过程与细胞杀伤的积极调节、免疫系统过程的调节等有关。相关的DEGs分别有Cxcr2、Plcb1等。Cxcr2基因编码的蛋白质是G蛋白偶联受体家族的成员,这种蛋白质是IL-8的受体,该受体介导中性粒细胞迁移到炎症部位。Plcb1参与细胞周期和细胞增殖,在小细胞肺癌、乳腺癌和大肠癌中被证明是候选肿瘤启动子。上调的DEGs的分子功能与蛋白质结合、主要组织相容性复合物I b受体反应、主要组织相容性复合物I蛋白复合物结合等有关,相关的DEGs分别是Ahnak、Ccr5、Cd160、Cd200r4、Cd226、Cxcr2、Fos、Gdf15、Id1、Itgam、Jun、Lilrb4a、Mob4、Plcb1、Plcb4等。Klrc1与细胞毒性和调节性淋巴细胞亚群上的KLRD1复合,识别非经典主要组织相容性(MHC)Ib类分子HLA-E,其负载有源自经典MHC Ia类分子信号序列的自身肽,使细胞毒性细胞能够监测健康细胞中MHC类分子的表达并自我耐受[16]。
KEGG富集分析显示DEGs与恰加斯病、松弛素信号通路、雌激素信号通路等有关,相关的DEGs为Fos、Jun、Plcb1、Plcb4、Itgam、Lilrb4a、Ccr5、Cxcr2、Id1。人类疾病中基于性别的差异部分是由调节线粒体代谢的内源性类固醇激素的水平引起的。在细胞水平上,雌激素调节包括繁殖和行为在内的各种细胞功能的机制是通过与雌激素受体α,β(ERα)和G蛋白偶联ER(GPER1)结合。ERα和ERβ是结合基因组和线粒体DNA以调节基因转录的转录因子。一小部分ERα和ERβ与质膜相关的信号蛋白相互作用,以激活细胞内信号级联反应,最终改变转录反应,包括线粒体形态和功能[17]。
现有的报道表明,线粒体生物发生需要几个基因,TFAM是线粒体和细胞核之间的重要调节因子,因为Tfam基因从细胞核表达但作用于线粒体。TFAM调节ETC蛋白的13个基因的转录,转移RNA的22个基因和mtDNA编码的核糖体RNA的2个基因。来自细胞核的信号传导可以通过TFAM调节线粒体基因表达或mtDNA复制,以响应细胞代谢挑战或环境信号[18]。
线粒体除了作为细胞内能量生成的关键细胞器,还参与细胞凋亡、自由基生产、脂质代谢等代谢过程。一些研究报道指出,线粒体功能异常会导致许多常见疾病的病理,包括神经退化、代谢疾病、心脏衰竭、缺血再灌注损伤和原生动物的感染等。因此,线粒体是这些高度流行疾病的一个重要药物靶点。呼吸链复合物I缺失是影响线粒体疾病最多的一个因素,其通常导致神经炎症和神经元死亡[19]。Tfam的敲除影响肿瘤细胞的自噬[20]。含有多个mtDNA缺失的帕金森症患者神经元中TFAM表达和总mtDNA拷贝显著降低[21]。
综上所述,本研究基于转录组学测序及生物信息学的方法,对Tfam基因敲除的CD11c+树突状细胞进行了mRNA转录组测序分析,GO和KEGG 分析显示 DEGs 主要富集在免疫系统过程的调节、免疫相关的反应、线粒体代谢、线粒体基因的表达等,相关的DEGs有Cdk5rap1、Ndufaf4、Ccr5Cxcr2、ItgamPlcb1、Plcb4等。这些结果对Tfam基因与线粒体代谢相关疾病或者神经系统性疾病、肿瘤等疾病研究起到提示作用。通过转录组测序发现了小鼠脾脏组织中CD11c+树突状细胞上的Tfam基因敲除与否的DEGs,为揭示Tfam基因在线粒体代谢相关疾病、神经系统性疾病、肿瘤等其他相关疾病发生发展中的生物学作用和相关分子机制奠定基础。
