不同细胞分裂素对鹅毛玉凤花无菌苗一步成苗的影响
2022-08-17邵丽
邵 丽
(上海辰山植物园城市园艺技术研发与推广中心,上海松江 201602)
鹅毛玉凤花[Habenaria dentate (Sw.)Schltr.]是兰科玉凤花属地生草本植物,别名双肾参、双肾子、天鹅抱蛋、对对参等,为国家二级重点保护野生植物,生于海拔630~1500m 的山坡林下,花期在8-10 月,在中国主要分布于安徽、浙江、江西、福建、台湾、湖北、湖南、广东、广西、四川、贵州、云南、西藏[1]。鹅毛玉凤花是珍贵的药用植物,其块茎可入药,具有补肺肾、利尿等功能,主治肾虚腰痛、病后体虚、肾虚阳痿、疝气痛、胃痛、肺结核咳嗽、睾丸炎及尿路感染等[2]。鹅毛玉凤花野外资源稀缺,过度采挖、破坏生境可能是其野生种群逐渐减少的原因。该植物有较高的经济价值,但生长缓慢、繁殖困难,通过自然方式繁殖系数极低,长期以来,民间均依靠采挖野生资源作为药用,只挖不栽,造成了资源的枯竭。而目前有关鹅毛玉凤花组培快繁的相关研究和报道都较少,陈娅娅等[3]在药用植物鹅毛玉凤花胚培养的研究中已探讨过其无菌播种的影响因子,萌发率可达82%。
本研究针对不同细胞分裂素6-BA(6-苄氨基腺嘌呤)、TDZ(噻苯隆)和KT(激动素)对鹅毛玉凤花种子无菌播种以及萌发后原球茎分化成苗的影响[4],筛选出种子萌发后一步成苗的最佳培养基,为大规模人工快速繁殖建立基础,也为该物种的种群回归、恢复以及药用经济价值的开发研究提供参考和理论依据。
1 材料与方法
1.1 试验材料
选取无病虫害的健康鹅毛玉凤花植株,在开花后1~3d 内花粉活性较强时进行人工授粉。自交授粉1~2周后,若柱头膨大、花瓣下垂内卷,则授粉成功。鹅毛玉凤花种子成熟时间较短,2 个月后种子成熟,即可采收果实并播种。若采下后不能及时播种,可将种子干燥保存于4℃冷藏室中,但储存时间不宜过久,最好在10 d内播种。
1.2 试验方法
1.2.1 种子消毒灭菌。将鹅毛玉凤花蒴果用少许洗洁精轻轻搓洗后,在水流下冲洗30min,在无菌工作台上用75%酒精浸泡30s,然后用0.1%升汞溶液震荡消毒10~15min,无菌水冲洗3 次,滤纸吸干果荚表面水分,待用[5]。
1.2.2 种子无菌播种。将已消毒的蒴果在无菌环境剖开,取出种子并均匀接种在配制好的培养基上。将基础培养基设为1/2MS,附加0.2mg/L NAA(萘乙酸)、0.5g/L活性炭、30g/L 蔗糖、7.5g/L 琼脂,pH 值5.8~6.0。并设置13 个处理组,处理1~12 分别添加不同种类不同浓度梯度的细胞分裂素,分别为0.5mg/L、1.0mg/L、1.5mg/L、2.0mg/L 的6-BA;0.1mg/L、0.5mg/L、1.0mg/L、1.5mg/L 的TDZ;0.2mg/L、0.4mg/L、0.8mg/L、1.6mg/L 的KT,处理13为对照组,不添加细胞分裂素。每个处理接种12 瓶,每瓶约100 粒种子,培养室温度设置为25±2℃,光照时间为12h/d,光照强度为2000Lux[6]。
1.3 数据处理
记录萌发时间并统计萌发率,统计时以形成白色肉眼可见的原球茎为准。种子萌发率(%)=萌发种子数量∕播种总数×100[7]。种子萌发成原球茎30d 后,统计原球茎膨大率、分化率,再过60d 统计成苗率。原球茎膨大率(%)=原球茎膨大数量∕萌发原球茎数量×100;分化率(%)=原球茎分化数量∕萌发原球茎数量×100;成苗率(%)=成苗数量∕萌发原球茎数量×100。
运用SPSS16.0 统计分析程序对试验结果进行数据处理。
2 结果与分析
2.1 不同细胞分裂素对鹅毛玉凤花种子无菌萌发的影响
通过预试验发现,鹅毛玉凤花种子在1/2MS 附加NAA 和6-BA 的培养基中比MS 培养基的萌发率高,且附加6-BA 的培养基可使种子萌发后原球茎膨大、叶片分化并直接成苗。仅添加NAA 的1/2MS 培养基上的种子可萌发形成白色卵圆形原球茎,但原球茎长时间不分化直至变成黄褐色、萎缩死亡。而不添加任何生长素和细胞分裂素的培养基上,种子萌发率不到20%。因此,生长调节剂对鹅毛玉凤花种子萌发和原球茎分化成苗有一定促进作用,而不同种类生长调节剂和不同浓度配比对其影响有显著差异。本研究仅探讨不同种类和浓度的细胞分裂素对其影响,生长素均使用NAA。由表1 可知,添加KT、TDZ 和6-BA 和未添加分裂素的培养基上种子均能萌发且萌发时间都为10d。未添加分裂素的培养基上种子萌发率为48.7%,显著低于其他添加了分裂素的培养基,且种子萌发成原球茎后均停止生长,不分化直至变黄褐色萎缩。不同分裂素的培养基萌发率有差异但不显著,添加了KT 的处理组萌发率随着浓度增加而先上升后下降,可见,0.8mg/L 的KT 是适合种子萌发的浓度;添加TDZ 和6-BA 的处理组中最适合种子萌发的浓度分别为1.0mg/L 和0.5mg/L,萌发率分别为69.05%和65.56%,但萌发率并不随分裂素浓度增加而有规律的变化。13 组处理的原球茎生长都有不同程度的变黄萎缩,但添加了分裂素的原球茎都有部分膨大,有些甚至能直接分化成苗,而未添加分裂素的处理13种子萌发成原球茎后停止生长并逐渐萎缩死亡。
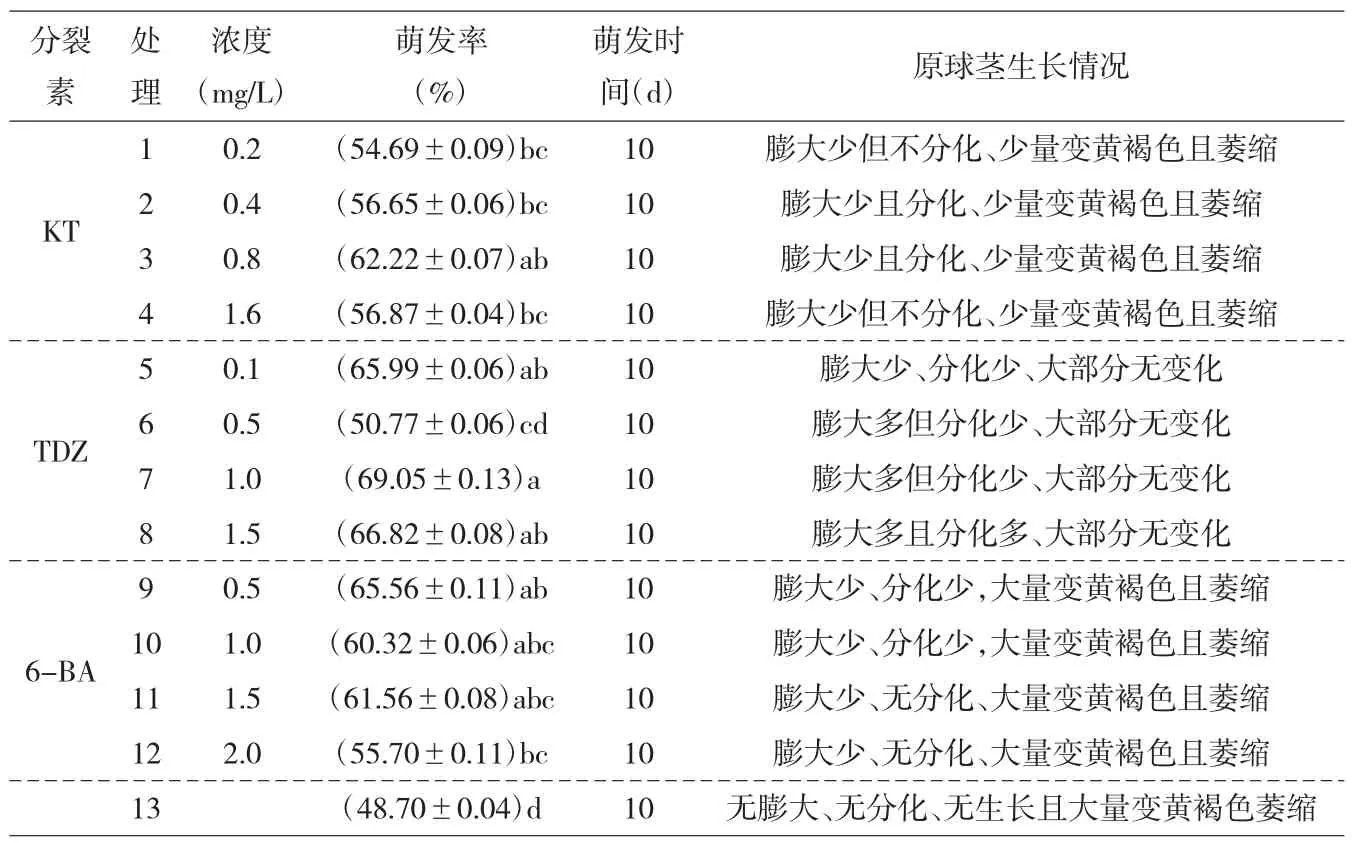
表1 不同细胞分裂素对鹅毛玉凤兰种子萌发的影响
2.2 不同细胞分裂素对原球茎分化成苗的影响
此试验周期为从播种到原球茎分化成苗的100d。表2 显示,未添加分裂素的处理13 原球茎在试验期间并无明显生长现象,且逐渐萎缩死亡;添加了分裂素的原球茎均有部分分化。可见,分裂素在萌发培养基中能使种子萌发的原球茎一步成苗;分裂素的不同种类和不同浓度的促进作用也有显著差异。3 种分裂素都能促使原球茎膨大,TDZ 处理组在原球茎膨大量、分化量和成苗量上都为最佳,且随着TDZ 浓度的上升,这3个指标也呈上升趋势。TDZ 的处理7、8 显著优于处理5、6,但处理7 和处理8 的差异不显著。处理组7、8 分别在萌发后40d 和45d 长根,100d 后苗高为4~5cm,根数1~2 根,根长3~4cm。KT 和6-BA 处理组的原球茎长势无明显规律,其中KT 组的原球茎长势相对最差,成苗率也低;0.5mg/L 和1.0mg/L 6-BA 有少部分原球茎也能直接分化成苗,但大量不生长的原球茎变黄褐色且萎缩死亡。
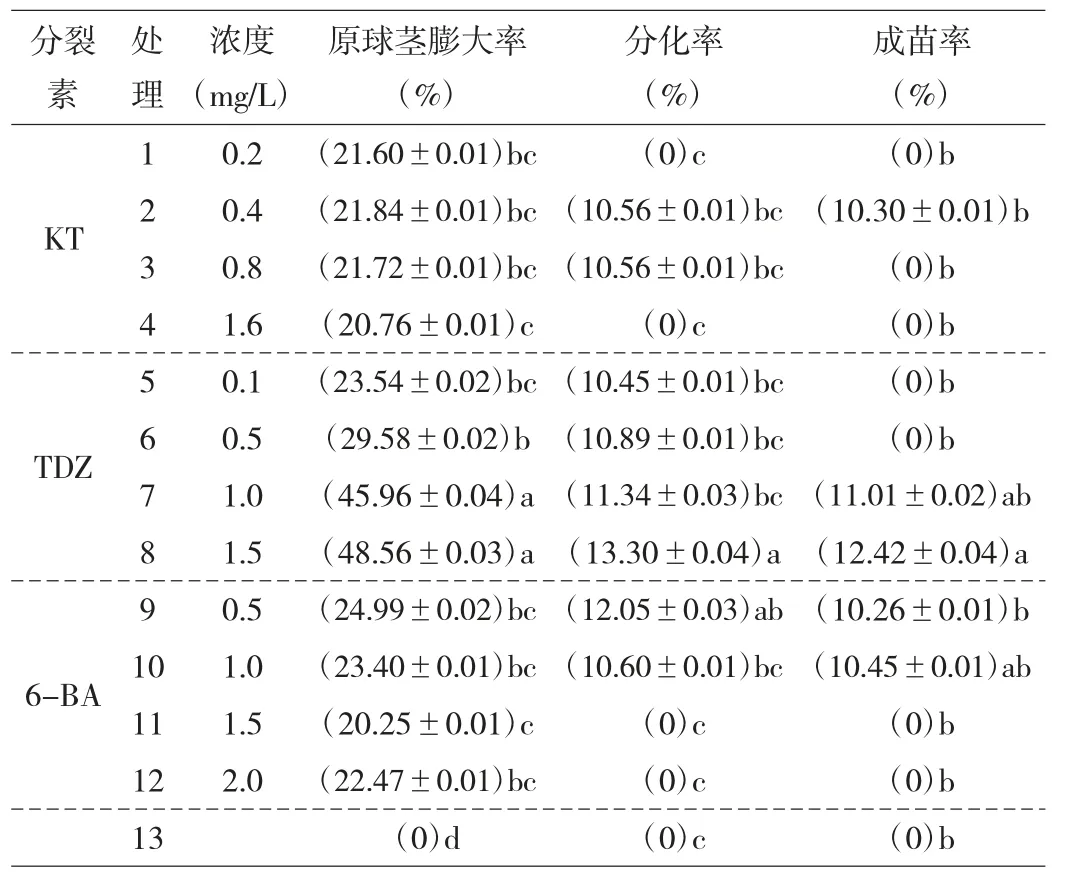
表2 不同细胞分裂素对鹅毛玉凤兰原球茎分化的影响
3 炼苗移栽
将长至5cm 以上的鹅毛玉凤花无菌瓶苗转移到温室内炼苗,5~7d后将无菌苗从培养瓶中取出,冲洗掉植株上残留的培养基,将幼苗种植在含树皮(1~3mm)、草炭、兰石(1~3mm)的介质中,配比为1∶2∶1。置于温室内遮阴处,光照3000~5000Lux,室温22~28℃,保持湿度60%~80%,待植株稳定生长后可进行常规水肥管理。
4 讨论
鹅毛玉凤花在野生状态和人工栽培条件下生长缓慢,且冬季时植株进入休眠期,只留块茎在地下或盆土中,很难采用其他兰科植物常用的分株繁殖方式,用植株器官进行组培也会伤及母株影响生长。而鹅毛玉凤花的种子细小,且胚发育不完全,自然状态下人工播种难以萌发,须借助共生菌类供给养料[8]。因此,利用种子无菌播种的培养方式即可有效解决繁殖困难、繁殖系数低和周期长的问题。
影响鹅毛玉凤花种子无菌繁殖的因素有多种,如种子活性、培养环境等,本试验在其他因素都相同的情况下,仅研究细胞分裂素对其产生的影响,并探讨无菌苗一步成苗的可能性。通常兰花种子到成苗要经过无菌播种、原球茎分化、生根壮苗和炼苗移栽4 个步骤,需要继代培养2~3 次。因此,研究鹅毛玉凤花无菌苗一步成苗需要对培养基中的营养成分和生长调节剂配比作出调整。1/2MS 培养基上的种子萌发率高于MS,说明低盐分培养基更有利于种子萌发。生长素NAA 对种子萌发有一定作用,但萌发后的原球茎无法继续分化生长,需要转入含分裂素的分化培养基上做继代培养,细胞分裂素可刺激细胞分裂,促进芽分化和生长。试验结果表明,未添加分裂素的萌发培养基无法做到一步成苗。在KT、TDZ 和6-BA 中,1.5mg/L TDZ 对原球茎直接分化成苗的促进作用最佳,但能够一步成苗的处理组的成苗率并不高,且同一种培养基上成苗所耗时间不同,可能是由于生长调节剂浓度配比和培养条件设置不准确或者需要添加一些营养物质如香蕉、椰青、马铃薯等来促进植株器官组织生长[9]。后续还需通过试验研究其他因素对其影响,探索一步成苗的最佳方法。
鹅毛玉凤花的种子萌发后形成的原球茎可以促使它直接分化形成完整的植株,也可以进行原球茎的增殖和丛生苗的诱导,从而获得大量的组培苗。而研究其一步成苗的方法意在快速得到成年植株,缩短培养周期,节约人工和培养成本,短期快速提供优质组培苗,为科学研究和大面积栽培奠定基础[10]。
