非编码RNA靶向调控TGF-β影响骨肉瘤进展研究
2022-08-16张帅魏巍
张帅 魏巍
骨肉瘤(Osteosarcoma,OS)是骨科最常见的恶性肿瘤,具有较高的侵袭性和转移性,青少年是主要发病人群。OS细胞中转化生长因子-β(Transforming growth factor-β,TGF-β)含量与其生物学行为呈正相关,非编码RNA可调控转化生长因子-β含量,进而影响OS生物学行为[1]。本研究就近年来非编码RNA靶向调控转化生长因子-β影响OS进展的研究作一综述。
OS发病人数约为2~3百万/年[1],其中10%~20%的患者在初次就诊时已发生了肺转移。尽管通过联合化疗方案和手术切除等治疗手段取得了一定进展,但目前OS患者5年生存率仍处于较低水平。因此,寻找OS细胞中高敏感性和特异性的生物标记物,并应用于OS诊断、治疗中,对于提高OS治疗水平具有重要意义。
非编码RNA(Non-coding RNA)是指不翻译成蛋白的RNA[2],其中包括微小RNA(microRNA,miRNA),长链非编码RNA(Long non-coding RNA,lncRNA),环状RNA(circular RNA,circRNA)等,在RNA水平行使各自的功能,如:非编码RNA与DNA、RNA和蛋白相互作用、基因的激活和沉默、降解下游靶基因等。TGF-β由不同的基因编码,可调节细胞生长和分化的细胞因子,主要包括TGF-β1、β2和β3[3]。其中TGF-β1与炎症、创伤、肿瘤发生发展等关系密切;TGF-β2不仅在增殖分化、骨的形成方面具有重要作用,还抑制T细胞的免疫监视功能,有利于肿瘤生长;TGF-β3可以促进细胞外基质形成和血管形成,还可以调节骨的形成。
肿瘤细胞中TGF-β可促进血管形成并增强肿瘤细胞与细胞外基质的相互作用,促进肿瘤侵袭和迁移[4],目前有关OS的研究表明,TGF-β含量与OS进展呈正相关,即OS细胞中TGF-β含量升高,促进OS进展;TGF-β含量降低,则抑制OS进展。非编码RNA又可调控OS细胞中TGF-β含量,从而影响OS生物学行为。作者将从miRNA、lncRNA、circRNA等非编码RNA调控OS细胞中TGF-β含量影响OS生物学行为展开综述。
1 miRNA调控TGF-β影响OS进展
miRNA结构序列较短,可以通过完全互补下游mRNA 3'UTR降解下游mRNA或不完全互补下游mRNA 3'UTR阻止基因表达两种方式对下游靶基因进行调控。研究表明OS细胞中miRNA异常表达,TGF-β含量相应受到调节,进而对OS细胞生物学行为产生影响。
1.1 OS细胞中miRNA调控TGF-β促进骨肉瘤进展 有报道[5]OS细胞中miR-124低表达,miR-124含量与TGF-β含量呈负相关,TGF-β过表达促进OS细胞增殖、侵袭和迁移,miR-124通过TGF-β介 导 的AKT/GSK-3β/SNAIL-1信 号通路调控OS生物学行为;Zhao等[6]发现OS患者血清中miR-95-3p含量升高,miR-95-3p通过调控TGF-β/CDKN1A/p21/cyclin D1通路促进OS细胞增殖、抑制凋亡;另外,有研究[7]发现OS细胞中miR-522高表达,可促进OS细胞增殖、迁移,抑制凋亡,实验证明miR-522靶向结合PPM1A刺激TGF-β/Smad通路促进OS进展。
1.2 OS细胞中miRNA调控TGF-β抑制骨肉瘤进展 Fu等[8]发现OS组织中miR-181c含量降低,miR-181c过表达可抑制OS细胞增殖、侵袭和迁移,miR-181c含量与TGF-β1和SMAD7含量呈负相关,结果表明miR-181c通过靶向调控TGF-β和SMAD7抑制OS生物学进展。综上研究表明在OS细胞中多种miRNA可调控TGF-β,对OS生物学行为产生影响,表明miRNA具有成为OS诊疗靶点的潜力。见表1。

表1 miRNA调控TGF-β影响OS生物学行为的研究
2 lncRNA靶向调控TGF-β影响OS进展
lncRNA序列较miRNA长,结构上超过200个核苷酸[15],主要发挥竞争性内源RNA(competing endogenous RNAs,ceRNA)的作用,竞争占有miRNA,减弱其生物学功能,从而调控增殖、凋亡和分化等生物学行为,部分lncRNA调控下游miRNA含量,miRNA下游靶基因TGF-β含量因此发生变化,继而调控OS生物学行为。
Zhang等[16]发现OS细胞中lncRNA NEAT1含量升高,miR-339-5p含量下调,miR-339-5p可抑制TGF-β1表达,由此发现OS细胞中NEAT1、miR-339-5p、TGF-β1轴及其促进OS进展的作用。此外,有研究[17]发现OS组织中lncRNA PCAT6高表达并且预示着较差的预后,PCAT6通过miR-185-5p、TGF-βR1/2轴来促进OS进展。有研究[18]发现OS组织和细胞中lncRNA LINC00174高表达,促进OS细胞的增殖、侵袭和迁移,LINC00174可抑制miR-378a-3p表达,降低LINC00174表达或上调miR-378a-3p表达可抑制TGF-β/SMAD信号通路。
Kong等[19]发现OS患者血清中lncRNA LINK-A和TGF-β含量升高,LINK-A可对TGF-β1进行正向调控,促进OS生物学进展。见表2。
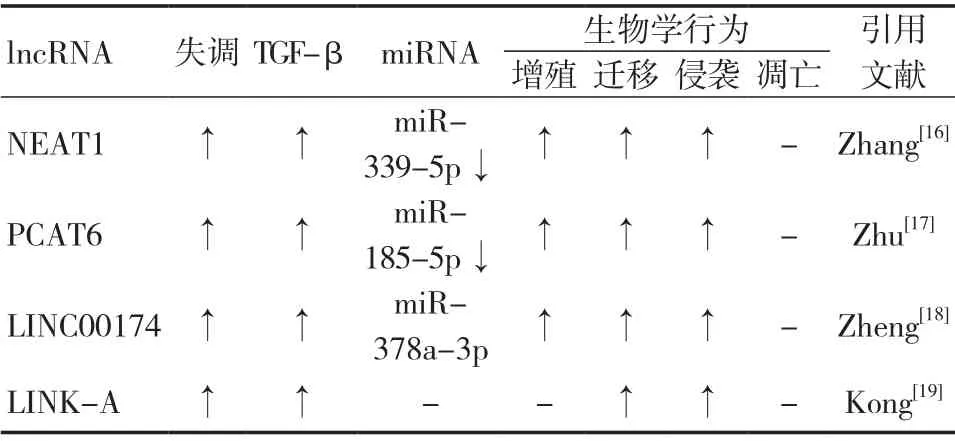
表2 lncRNA 调控TGF-β影响OS生物学行为的研究
3 circRNA靶向调控TGF-β影响OS进展
circRNA呈封闭环状,具有较强的稳定性。结构上具有丰富的miRNA结合位点,通过“分子海绵”效应结合占有miRNA,下游靶基因得以行使功能[20]。与lncRNA调控TGF-β一样,circRNA主要发挥ceRNA的作用并对TGF-β进行调控。有研究[21]发现OS组织中circRNA 0051079高表达,预示着较差的预后,0051079负调控其下游miR-26a-5p,TGF-β1又为miR-26a-5p的下游靶基因,从而该研究发现0051079通过miR-26a-5p、TGF-β1轴促进OS细胞增殖、侵袭和迁移。
近年来,研究[22]表明非编码RNA调控TGF-β与OS发生发展具有密切关系,见图1,具有成为OS诊断、治疗生物靶点的潜力。除了本文中所介绍的miRNA对TGF-β的调控,TGF-β信号可对miRNA作用[22],但我们对OS细胞中TGF-β信号对miRNA的作用知之甚少。除此之外,仍有许多未知,如:是否还存在未知的可调控TGF-β的非编码RNA;不同的非编码RNA分子调控不同类型的TGF-β是否存在特异性调控机制;不同病理类型OS表达非编码RNA分子及TGF-β的差异性如何等。
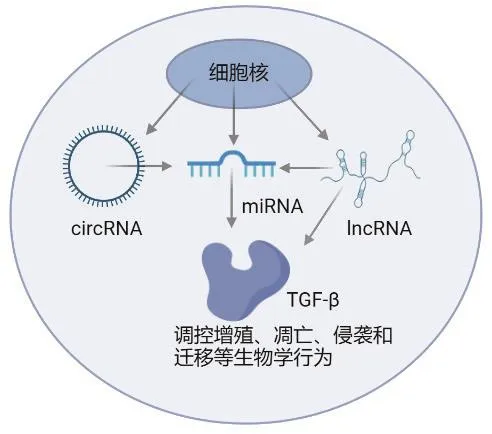
图1 非编码RNA调控TGF-β影响OS生物学行为模式图
4 结语
随着对非编码RNA、TGF-β和OS三者之间相互关系研究的不断深入,非编码RNA和TGF-β相关作用研究必将为阐明OS发生、发展机制提供有力帮助, 如:通过检测非编码RNA或TGF-β含量,提高临床医师对OS发展阶段的把握;或可研制靶向药物影响非编码RNA或TGF-β含量,抑制OS进展,从而提高OS患者5年生存率。
