基于稳定同位素技术的灵山岛及周边海域渔业生物群落营养结构分析❋
2022-08-15张宇洋董建宇詹启鹏王林龙张秀梅
张宇洋, 董建宇, 孙 昕, 詹启鹏, 王林龙, 张秀梅
(1.海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003; 2.浙江海洋大学水产学院, 浙江 舟山 316022)
食物网是描述生态系统物种间营养关系的网络,研究食物网对了解群落生物组成和种间复杂的营养相互作用、揭示生态系统的物质循环与能量流动过程具有重要意义,食物网研究是生态学研究热点领域之一[1]。其中,确认各物种营养位置以及种间营养关系是食物网研究的基础[2]。胃含物分析法是食物网研究的传统分析手段[3],其具有直观、操作灵活、无硬性设备要求等优势[4],但也存在所需样本量大、不能代表长期食物组成、存在人为误差等局限[5]。稳定同位素技术近年来被广泛应用于物种食物来源分析,其能够反映生物体长期的摄食特征,估算生物营养位置,构建简化食物网,稳定同位素技术已成为研究水域生态系统营养动力学的重要手段之一[6-8]。稳定同位素分析最常用的测定值为碳(δ13C)和氮(δ15N)。由于δ13C在各营养级富集度较弱(每一营养级富集约为0.4‰),其通常用于确定消费者的食物来源[9]。因为δ15N在各营养级间富集度较高(每一营养级富集约为3.4‰)[10],所以其更常用于评估营养级和确定食物网结构。国内外诸多学者应用稳定同位素技术开展了一系列研究,如麻秋云等[11]用该技术构建了青岛胶州湾海域渔业生物的连续营养谱,将其主要生物种类划分为 4 个营养组群,发现该海域绝大多数渔业生物都属于初级和中级肉食性种类; Bouaziz等[12]用该技术分析了法国Canche河口鱼类的食物网结构和季节变化特征,发现陆源有机质对当地食物网的影响较小,而底栖微藻和海洋颗粒有机物对当地食物网的贡献最大;Zhang等[13]用该技术比较了山东小黑山岛海域人工鱼礁建设前后的营养结构变化,发现投礁后大部分鱼类营养级下降,而无脊椎动物营养级上升。
灵山岛是青岛市最大的海岛,其周边海域水深较浅(20 m),受沿岸流和黃海暖流影响[14],此处渔业生物种类繁多,是多种经济鱼、虾、蟹类等索饵、繁殖和育幼的场所,也是一处重要的增殖放流区域。目前,关于该海域仅开展了渔业资源评估和群落结构特征研究[15-16],但关于该海域主要渔业生物营养位置及食物网结构的研究尚未见报道。为探究青岛市灵山岛及周边海域渔业生物群落的营养结构特征,于2019年秋季对该海域进行了3个航次的底拖网调查,应用稳定同位素技术测定了主要渔业生物的δ13C和δ15N值,初步查明了该海域主要渔业生物的营养级,探讨了不同生物类群(鱼类、头足类和甲壳类)的营养结构特征,比较分析了该海域渔业生物群落营养结构的稳定性。以期为该海域渔业资源的科学养护和可持续开发利用提供参考。
1 材料与方法
1.1 样品采集
于2019年秋季(9—11月)对灵山岛及周边海域进行3个航次的底拖网调查(见图1)。调查方法参照《海洋调查规范》(GB/T12763.6—2007)。调查船为220 kW单拖网渔船(鲁胶南渔69076),每一站位拖网时长0.5 h,拖网速度为2 kn。渔获物样品按站位分别冰冻保存。同时,各站位分别用浅水Ⅱ型和Ⅲ型浮游生物网从底层至表层垂直拖网采集浮游生物样品,样品冷藏后带回实验室进行后续分析。

图1 研究区域与调查站位
1.2 样品处理
测定渔获物的体长与体质量,同一生物选取不同规格的个体,其中鱼类取背鳍基部肌肉,头足类取胴体腹部肌肉,虾类取腹部肌肉,蟹类取第一螯足内部肌肉。浮游植物处理过程如下:挑出杂质后用筛绢(150 μm)过滤掉样品中的浮游动物和悬浮碎屑,用蒸馏水静置后,将上清液在经过500 ℃灼烧6 h的Whatman GF/F玻璃纤维滤膜上抽滤。浮游动物处理过程如下:在海水中清养2 h进行空胃处理,筛绢(100 μm)过滤后在显微镜下分拣出杂质,将剩余的浮游动物混合后,用锡纸包裹以备后续分析。所有渔获物样品均经超纯水冲洗后置于-80 ℃冷冻干燥48 h以上,研磨成粉末后用脱脂溶液(甲醇∶氯仿= 2∶1)进行脱脂处理(除浮游生物)[17]。脱脂后用去离子水多次冲洗,随后置于-80 ℃冷冻干燥24 h,用于后续稳定同位素测定。
1.3 稳定同位素测定
样品经去离子水冲洗、脱脂和脱水等处理后研磨成粉末置入锡囊,使用Flash EA 1112型元素分析仪和EA-IRMS MAT 253同位素比值质谱仪(美国Thermo Finnigan公司)进行碳氮稳定同位素测定。为保证仪器的稳定性和测量结果的精确性,每测量10个样品后加测一个标准样(IAEA-N-2,δ15N:20.41‰± 0.07‰;USGS-40,δ13C:-26.39‰±0.09‰,δ15N:-4.52‰ ±0.12‰;IAEA-CH-6 δ13C:-10.45‰±0.07‰)进行校准。相关计算公式如下:
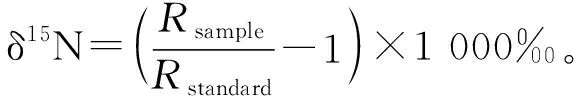
式中R为13C/12C 或15N/14N 的比率。
1.4 数据分析
采用SPSS 19.0软件分析同位素数据,使用Shapiro-Wilk和Leven检验样本数据的分布特性,采取非参数Kruskal-Wallis检验各类群同位素值(δ13C和δ15N)是否存在显著差异。
营养级计算公式如下[10]:
TL=[(δ15Nconsumer-δ15Nbaseline)/Δδ15N]+TLbaseline
式中:δ15Nconsumer表示消费者氮稳定同位素比值;δ15Nbaseline表示基准生物氮稳定同位素平均比值,本研究取浮游动物(δ15N=6.26‰)为基线生物;Δδ15N表示各营养级间的氮富集度,采用Post的计算结果3.4‰[10];TLbaseline为基线生物(TL=2)的营养级。
使用ggplot2包绘制灵山岛渔业生物的δ13C和δ15N值的双位图和连续营养谱。
Layman等[18]基于碳氮稳定同位素双位图提出了6个群落营养结构指标,从不同角度定量分析了群落营养结构。Jackson等[19]基于此,提出了核心生态位宽度(Standard ellipse area,SEA)为营养生态位宽幅评价指标。各指标的描述如下:
(1)δ13C差值(δ13C range,CR):某类群碳稳定同位素值的差值,用于评估功能群食物来源的多样性。
(2)δ15N差值(δ15N range,NR):某类群氮稳定同位素值的差值,用于评价该功能群落的食物链长度。
(3)多边形总面积(Total area,TA):表示功能群整体的生态位宽度,即所有样本同位素坐标点形成的凸多边形面积,代表功能群在食物网中营养多样性的总体范围。但多边形总面积易受到个体极端值的影响。
(4)矫正后标准椭圆面积(Corrected standard ellipse area,SEAC):表示群落的核心生态位,在δ13C和δ15N双位图中为功能群中各点构成的椭圆面积。
(5)平均离心距离(Mean distance to centroid,CD):表示群落的营养多样性,为δ13C和δ15N双位图中各点到质心的平均欧氏距离。
(6)平均最近相邻距离(Mean nearest neighbor distance,MNND):反映功能群营养相似性,其值越低,群落的营养冗余度越高。在δ13C和δ15N双位图中,为各类群与其最近相邻坐标点的欧氏距离平均值。
(7)最近相邻距离的标准差(Standard deviation of nearest neighbor distance,SDNND):反映功能群的营养均匀度。在δ13C和δ15N双位图中,为各类群与其最近相邻坐标点欧氏距离标准偏差的平均值。
本研究选取以上7个指标用于分析灵山岛各生物类群和该海域渔业生物群落的营养结构特征,并利用SIBER包(Stable Isotope Bayesian Ellipses in R)绘制各渔业生物类群(纳入计算的各物种样品数≥3)的贝叶斯标准椭圆图。
2 结果与分析
2.1 灵山岛海域主要渔业生物的碳、氮稳定同位素特征
本文分析了48种渔业生物的碳、氮稳定同位素值(见表1和图2)。48种渔业生物为32种鱼类、5种头足类和11种甲壳类。灵山岛及周边海域食物网δ13C值范围为-19.56‰~-16.08‰,平均值为-17.42‰±0.97‰,δ15N值范围为7.66‰~13.47‰,平均值为10.74‰±1.12‰。
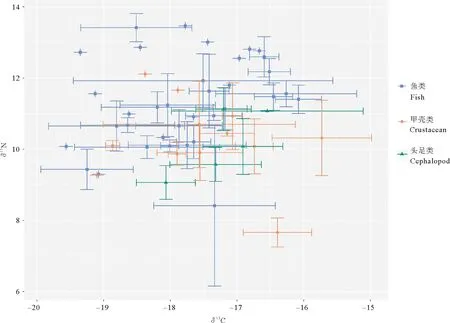
图2 灵山岛及周边海域不同渔业生物δ13C和δ15N值分布图
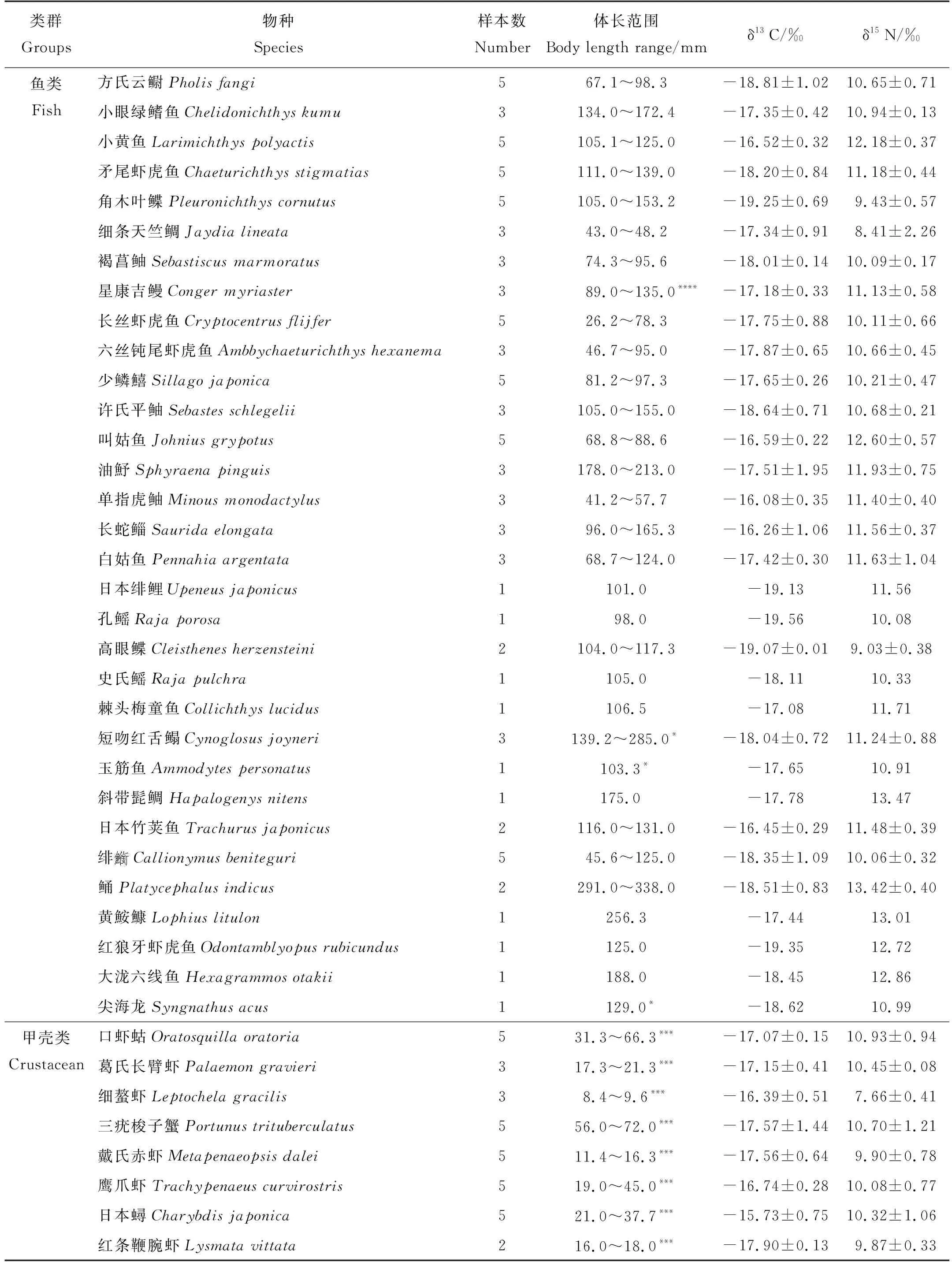
表1 2019年秋季灵山岛及周边海域渔业生物与浮游生物的稳定同位素信息
灵山岛海域各渔业生物的碳、氮同位素比值差异较大。其中,鱼类δ13C值的范围是-19.56‰(孔鳐(Rajaporosa))~-16.08‰(单指虎鲉(Minousmonodactylus)),平均值为-17.77‰,跨度为3.48‰;而δ15N值的范围是8.41‰(细条天竺鲷(Jaydialineata))~13.47‰(斜带髭鲷(Hapalogenysnitens)),平均值为11.00‰,跨度为5.06‰。甲壳类δ13C值的范围为-19.1‰(双斑蟳(Charybdisbimaculata))~-15.73‰(日本蟳(Charybdisjaponica)),平均值为-17.15‰,跨度为3.37‰;而δ15N值的范围是7.66‰(细螯虾(Leptochelagracilis))~10.93‰(口虾蛄(Oratosquillaoratoria)),平均值为10.08‰,跨度为3.27‰。头足类δ13C值的范围是-18.10‰(长蛸(Octopusvariabilis))~-16.55‰(枪乌贼(Loligosp.)),平均值为-17.06‰,跨度为1.55‰;而δ15N值的范围是9.57‰(双喙耳乌贼(Sepiolabirostrata))~11.07‰(枪乌贼(Loliolussp.)),平均值为11.00‰,跨度为1.50‰。
2.2 营养级与连续营养谱
根据营养级公式估算了灵山岛及周边海域主要渔业生物的平均营养级,以此构建了该海域的连续营养谱(见图3)。灵山岛海域各生物的营养级范围为1.37(浮游植物)~4.12(斜带髭鲷)。其中,浮游植物位于1~2营养级;位于2~3营养级上的生物共有6种,包括3种鱼类、2种甲壳类和1种头足类,占物种数的14%;位于3~4营养级上的生物种类有40种,其中鱼类27种、甲壳类9种、头足类4种,占物种数的80%;营养级高于4的种类仅有斜带髭鲷和鲬(Platycephalusindicus)2种。鱼类的营养级范围为2.63~4.12,其中84%的鱼类位于3~4营养级范围内。仅细条天竺鲷、高眼鲽(Cleisthenesherzensteini)和角木叶鲽(Pleuronichthyscornutus)的营养级低于3。在甲壳类中,口虾蛄营养级最高(3.37),细螯虾营养级最低(2.41),除细螯虾外,其余甲壳类均属于3~4营养级。在头足类中,枪乌贼营养级最高(3.41),金乌贼次之(3.39),双喙耳乌贼营养级最低(2.97)。
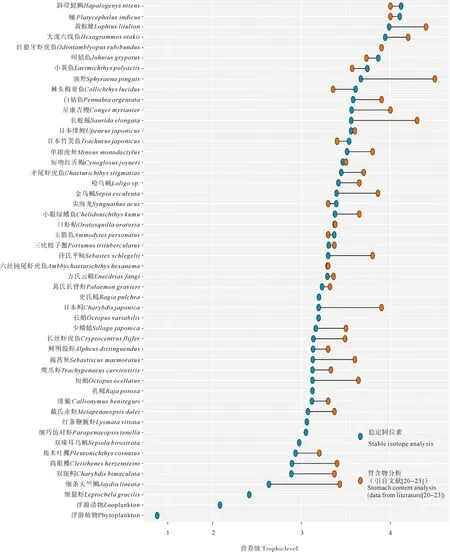
(蓝色图标:基于稳定同位素分析法测定的平均营养级;红色图标:胃含物分析数据 (引自文献[20-23])。Blue icon: average trophic level based on stable isotope analysis. Red icon: trophic levels based on stomach contents analysis(data from literatures[20-23].)
续表1
2.3 不同类群营养结构的差异及群落营养特征指标
利用SIBER包分析了灵山岛3种渔业生物类群的碳氮稳定同位素,并计算了各生物类群以及整个群落营养特征指标(见图4和表2、表3)。营养结构特征指标在各类群中区分较明显,鱼类的食物链长度(NR)最大,营养多样性(CR)最高,生态位宽度(TA)显著高于其他类群,但表征核心营养生态位(SEAC)的各指标与甲壳类相似。甲壳类的营养位置差异(MNND)最大,头足类次之。除MNND外,头足类各项指标均低于其他类群,但头足类的核心生态位居于所有类群的中央(见图4),鱼类和甲壳类矫正后的标准椭圆几乎完全将其涵盖。
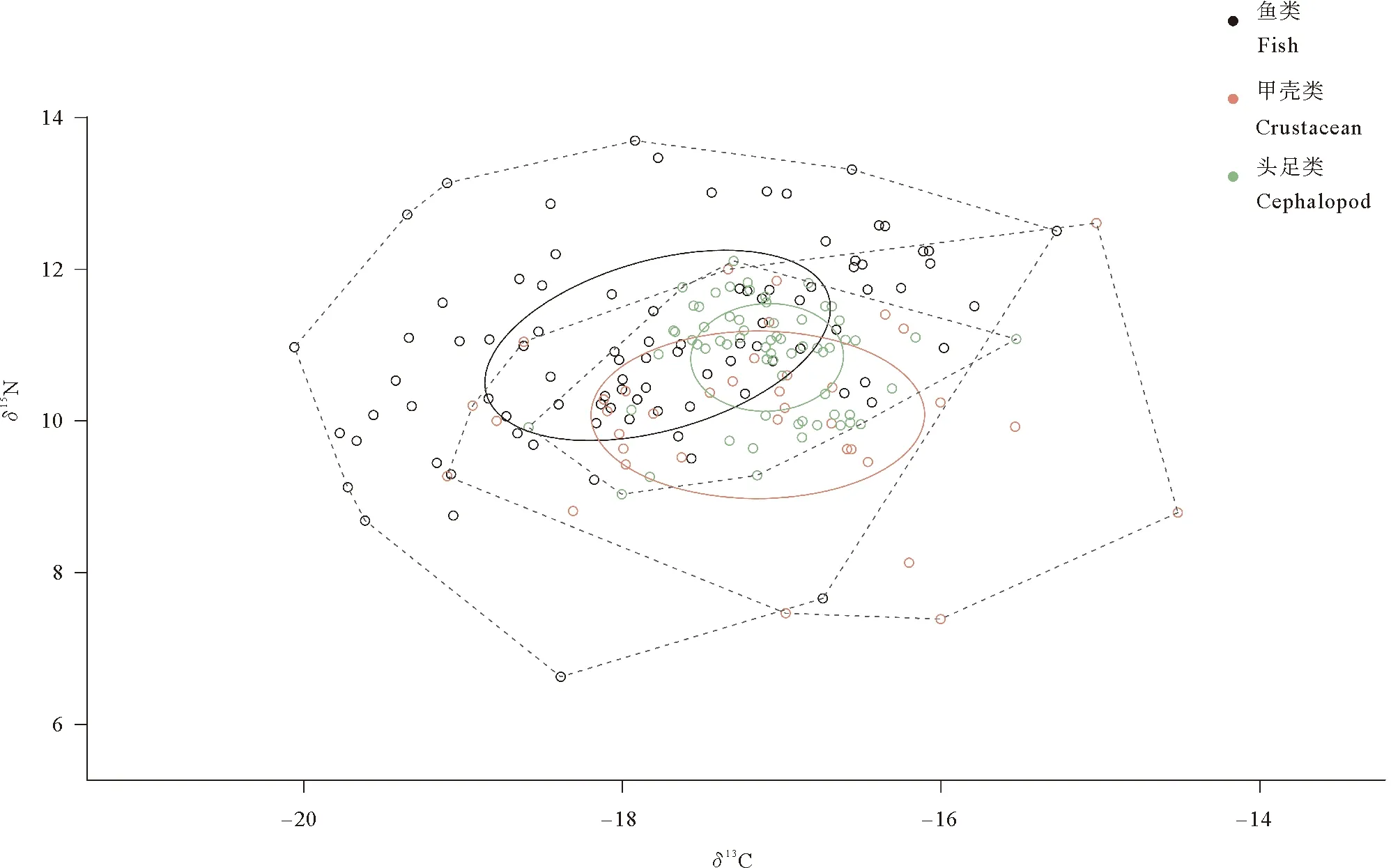
图4 灵山岛海域3种渔业生物类群矫正后的标准椭圆面积(实线)和多边形面积(虚线)

表2 灵山岛海域三种渔业生物类群的营养特征指标
3 讨论
3.1 灵山岛及周边海域渔业生物的同位素特征及营养级
本研究收集的用于稳定同位素分析的渔获物种类基本涵盖已报道的灵山岛海域秋季资源评估发现的渔业生物种类(48种)[15-16],能够反映灵山岛及周边海域营养结构的基本状况。
δ13C在食物链中的富集度较低,故常被用于确定消费者的食物来源和栖息环境[9]。灵山岛海域鱼类、甲壳类、头足类的δ13C均值均在-17‰左右,远高于浮游生物,灵山岛周边海域渔业生物群落可能以底栖食物链为主[24],通过碎屑食物链传递能量的可能性较大。研究表明碎屑食性物种对生态系统抗干扰能力要高于大多数高营养级的肉食性鱼类,随着生态系统的过度开发利用,肉食性物种数量会逐渐减少,群落优势类群会向碎屑食性物种过渡[25],由此认为这也是近年来灵山岛海域资源过度开发利用的一种表现。能量流动与物质循环研究是了解生态系统功能和恢复力的基础,对于生境资源修复工作具有重要意义[26]。但目前关于该海域的碳源尚不明确,今后应聚焦于不同碳源(如浮游植物、悬浮物、沉积物等)对各类生物的贡献率开展深入研究。
δ15N在各营养级间变动较大,故常用于分析生物的营养位置[10]。本研究查阅以往调查数据[20-23],共获得依据胃含物分析法判定的灵山岛海域41种生物营养级。比较发现,以往的调查数据与本研究估算的34种生物的营养级误差在0.5范围内,平均高出本研究结果0.33个营养级。相较于稳定同位素分析,胃含物分析仅能反映捕食者短期内的食物组成,且受肉眼观察的影响往往会忽视一些小型饵料生物,因此可能造成营养级的计算结果较实际值偏高,一般认为0.5个营养级差值在误差控制范围内[27]。此外,大量基于稳定同位素的食性研究发现同种鱼类的体长差异会影响营养级的测定,如小黄鱼(Larimichthyspolyactis)[28]、方氏云鳚(Pholisfangi)[29]、星康吉鳗[30](Congermyriaster)、细条天竺鲷[31]等,本次调查许氏平鲉(Sebastesschlegelii)体长范围为105~155 mm,星康吉鳗肛长范围为89~125 mm,高眼鲽体长范围为104~117.3 mm,角木叶鲽体长范围为105~153.2 mm,样品规格均偏小。张波[32]对高眼鲽食性的研究表明,不同体长组食物组成存在一定差异,而体长小于119 mm的高眼鲽主要以磷虾类和底层虾类为食,营养级偏低,由此推测规格差异可能造成了营养级的偏差。综上,本研究中81%的渔获生物营养级在误差范围内(除了5种鱼类、1种甲壳类和1种头足类),可以认为稳定同位素估算的营养级与胃含物分析的结果无显著差异。
根据营养级计算结果,本研究构建了灵山岛及周边海域的连续营养谱,灵山岛海域食物链长度为4.12,与Zanden等[33]计算的全球47个水域生态系统的平均食物链长度(约为4)相似。参考麻秋云、杨春霞、纪炜炜等[27,34-35]的营养结构划分标准,将灵山岛海域渔业生物划分为 4 个营养群:初级消费者(2.5~3.0)5种,如双喙耳乌贼、细条天竺鲷组成的小型杂食性动物,主要摄食太平洋磷虾(Euphausiapacifica)、细螯虾和虾类幼体等[31,36]。次级消费者(3.0~3.5) 27种,种类最多,以营浮游或底栖食性的混合食性生物为主,包括以浮游生物为食的玉筋鱼(Ammodytespersonatus)、方氏云鳚、尖海龙(Syngnathusacus)等小型鱼类[29,37],以小型底栖生物、鱼类幼体为食的金乌贼、短蛸(Octopusocellatus)、长蛸、口虾蛄、鲜明鼓虾(Alpheusdistinguendus)等无脊椎动物[21]。中级消费者(3.5~4.0) 13种,由混合食性鱼类和游泳生物食性的鱼类组成,其中混合食性鱼类包括大泷六线鱼(Hexagrammosotakii)、小黄鱼、星康吉鳗等,游泳生物食性鱼类包括单指虎鲉、长蛇鲻(Sauridaelongata)、油魣等,其主要摄食对象为鳀(Engraulisjaponicus)、枪乌贼、短鳍(Callionymussagitta)等[38]。高级消费者(TL≥4.0)2种,为斜带髭鲷和鲬,属于凶猛肉食性鱼类,处于食物链顶端。
本次灵山岛海域秋季调查未采集到高营养级中大型肉食性鱼类,如带鱼(Trichiurusjaponicus)、狮子鱼(Liparissp.)、真鲷(Pagrusmajor)等[16],且黄鮟鱇(Lophiuslitulon)、斜带髭鲷数量稀少;受渔获物规格影响,星康吉鳗、许氏平鲉、高眼鲽、角木叶鲽等中级消费者的营养级普遍偏低,渔业生物主要由次级、中级消费者组成。灵山岛海域的营养结构组成反映了该海域的渔业资源呈一定程度的衰退,这可能与近年来该海域的捕捞压力强度大有关。
3.2 群落营养多样性及结构稳定性
各类群的营养结构特征表明,灵山岛海域鱼类在NR、CR、CD、TA和SEAC等方面均高于甲壳类和头足类,营养多样性和生态位利用率较高。甲壳类的MNND和SDNND最高,表明甲壳类营养冗余度最低,居于相似营养生态位的生物较少,抗干扰能力较差[39]。这与Ponce等[40]对智利海域底栖鱼类和甲壳类的营养结构特征研究结果相似。可能归因于各类群的摄食习性差异,甲壳类多为底栖碎屑或腐食食性生物[41],其潜在碳源的多样性导致其种间发生了一定程度的营养特化,占据不同的营养生态位。头足类的SEAC明显低于鱼类和甲壳类,表明其摄食偏好较专一,可能归因于该海域能够为其提供较充足的同一类群的饵料生物[42]。
灵山岛及周边海域各生物类群的核心营养生态位(贝叶斯椭圆面积)存在一定程度的重叠,表明这些生物的食物来源和栖息环境相近,部分物种间可能会存在一定程度食物竞争关系。本研究中的头足类居于群落的营养核心位置,且与鱼类、甲壳类的营养生态位重叠度较高,营养关联较紧密,表明头足类在该海域食物网中起着承上启下的作用。这与以往的研究结果相一致,即头足类是连接低营养级生物和高营养级生物间能量流动的桥梁[43-44]。因此头足类资源的变动会对当地的群落营养结构产生一定程度的影响[45]。另一方面,头足类的SDNND最低,表明其营养分布更为均匀,种内竞争弱。这可能与头足类个体生长发育阶段中存在营养生态位的分化有关[46]。金乌贼是该海域头足类的优势种之一,先前研究观察到该海域金乌贼补充群体的营养级会随着个体生长而变化[47],这也印证了该观点。这种现象表明,头足类可能会利用生态位分化的方式来维持一种较低的种间或种内竞争模式,从而增强其类群的抗干扰能力,保证其在食物网结构稳定性中的生态作用。
灵山岛海域食物网的NR和CR均高于临近的海州湾和黄海南部海域[34,48](见表3),营养多样性较高,这可能归因于灵山岛周边近岸海域受陆源输入影响较大。灵山岛海域生物群落的MNND略低于其他海域,表明该海域生物群落的营养冗余度较高,群落内部相似营养生态位的生物较多,抗外界干扰能力较强,个别物种消失或替换,不会导致该海域食物网结构失衡[49]。
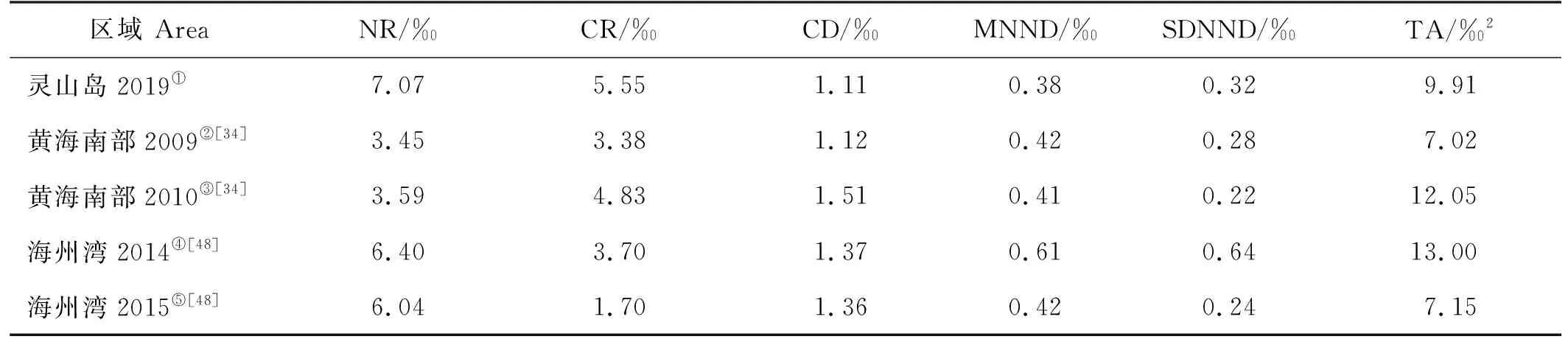
表3 灵山岛海域与黄海其他海域的营养结构指标
此外,在同位素双位图中位于凸多边形顶点的生物(见图4)占据着特殊的营养生态位,它们的资源变动会导致NR、CR、TA等多个群落营养指标发生变化[21]。这些关键顶点生物对于维持整个群落营养结构发挥着重要作用。灵山岛及周边海域关键顶点生物主要有游泳动物食性的鲬、斜带髭鲷、黄鮟鱇等高级消费者,营底栖食性的红狼牙虾虎鱼(Odontamblyopusrubicundus)、方氏云鳚、角木叶鲽等次级、中级消费者,以及营浮游生物食性的细条天竺鲷、戴氏赤虾、细螯虾等初级消费者。因此,在开展灵山岛海域渔业资源保护与利用时,应更多地关注这些渔业生物的变动,以确保渔业资源能够得到合理的开发利用。
3.3 基于群落营养结构对灵山岛增殖放流种类的甄选——以金乌贼为例
基于贝叶斯标准椭圆发现(见图4),头足类居于群落的营养核心位置,与其他类群营养关系较紧密。金乌贼是灵山岛海域的主要增殖放流物种之一,其资源变动可能会影响当地海域的营养结构变化。基于本文研究,就金乌贼种群的科学养护和可持续开发利用而言,在摄食生态学层面上,灵山岛海域是适宜的金乌贼放流点,原因如下:(1)以金乌贼为代表的头足类种内竞争弱,生态位利用率较低,表明其摄食偏好较为专一。以往研究表明金乌贼饵料生物组成以戴氏赤虾、口虾蛄等甲壳类和小型鱼类为主[21]。上述物种均为秋季灵山岛海域的优势物种[16],表明该海域金乌贼的饵料生物较充足,有利于放流苗种的存活;(2)基于灵山岛海域的连续营养谱,多数渔业生物以次级、中级消费者为主,营养级普遍偏低,本次调查未能捕获到金乌贼的天敌如带鱼、狮子鱼,而其余天敌如星康吉鳗、许氏平鲉、黄鮟鱇等凶猛肉食性鱼类规格普遍较小,营养级偏低。该海域金乌贼的捕食者较少,更有利于放流苗种的存活。
许多研究证实,增殖放流种类在一定程度上能改变或增强渔业资源群落结构。李忠义等[50]研究表明三疣梭子蟹(Portunustrituberculatus)的增殖放流会增强放流海域游泳生物群落结构的稳定性。Qin等[51]发现紫海胆增殖放流会在一定程度上影响当地物种的分布,增加群落的营养多样性。以恢复受损生态系统为目标的资源增殖放流是未来研究的重点[50,52]。由于增殖放流活动通常集中于某一时期大批量放流人工培育苗种,势必会对其放流海域的种群、群落乃至食物网结构产生影响。而本研究基于灵山岛海域营养结构稳定性分析认为,目前金乌贼的增殖放流不会对该海域营养结构产生较大影响:(1)根据各生物类群抗干扰能力的强弱,分析认为灵山岛及周边海域甲壳类营养结构最易受到放流苗种的影响,头足类次之,再次为鱼类。而研究表明金乌贼存在食性转换现象,伴随生长发育放流苗种的饵料生物会由小型甲壳类过渡为底栖鱼类[47]。因此,随着放流时间的推移,金乌贼放流苗种对营养结构的干扰程度会逐渐减弱。(2)就食物网结构而言,头足类平均营养级为3.35,处于鱼类和甲壳类营养级之间,架起了高低营养级间能量流动的桥梁,其苗种放流将会使该海域食物网的营养关联更加紧密。(3)与黄海其他海域相比,灵山岛海域渔业生物群落营养结构较稳定,抗干扰能力较强,是一处较理想的增殖放流海区。
本文基于渔业生物群落营养结构特征,以金乌贼为例,探讨了其增殖放流的生态影响。但受伏季休渔限制,未能获得夏季灵山岛海域的渔业生物样品,放流苗种对当地海域生物群落结构的影响尚需进行更深入的研究。
