CO2 加氢制备高级醇研究进展
2022-08-13龚琛凡杨海艳
龚琛凡,杨海艳,高 鹏,
1.中国科学院上海高等研究院,中科院低碳转化科学与工程重点实验室,上海 201210;
2.中国科学院大学,北京 100049
随着各国生活水平的提高,对能源的需求逐渐增大,使得化石能源如煤、天然气和石油被过度消耗,二氧化碳排放量的持续增加导致全球气候变暖。为了稳定大气中的CO2含量,不仅需要减少其排放量,也可通过有效利用CO2这种途径来实现[1]。作为一种丰富、廉价、无毒且可再生的碳源,近年来CO2的利用受到了广泛关注[2-4],利用CO2可生产燃料、添加剂、药物和芳香化合物等[5]。将捕获的CO2催化转化为液体燃料可以改善全球气候变化,并有效减少人类对化石燃料的过度依赖,但是CO2中的碳处于最高氧化态,其还原和转化过程需要大量的能量输入。氢气作为一种较为清洁的高能原料,常被用于CO2转化制取高附加值产品过程[6-7],目前的氢源主要为煤制氢、工业副产氢、天然气制氢[8],也可利用太阳能、风能、地热能和水能等可再生能源将CO2和水转化成绿色液体燃料。Shih等[9]提出了“液体阳光”的概念,即利用太阳能将CO2转化成稳定、易于运输、能量密度高的液体燃料。近年来,将可再生能源转化成电能,然后电解水制得的H2用于CO2加氢生产液体燃料(PTL)的相关研究层出不穷[10-14],包括汽油(C5-11)、喷气燃料(C8-16)和柴油(C10-20)的液态烃(C5+),以及甲醇、乙醇和其他高级醇(C2+OH)[9,15-16]。
CO2加氢选择性转化为高级醇比转化为甲醇或C2+烃类产物面临更大的挑战,因为与烃类(CHx)加氢相比,CO2加氢产生的一氧化碳(逆水煤气变换,RWGS)插入的能量势垒更高[17]。同时各种反应路线的复杂性以及催化剂表面C—C 偶联(C≥2 分子生产的重要步骤)的不可控性,均不利于C2+OH的合成。Fang[18]开发了新型Cu-Fe 基催化剂,在合成气(CO/H2)制混合醇(HAS)反应中实现乙醇的时空收率大于0.23 kg/(kg-cat·h)。Caparros 等[19]研究发现,Pd-Fe3O4单原子催化剂在CO2加氢制乙醇中表现出显著的催化性能,在常压、300 ℃下乙醇的选择性为 97.5%,乙醇时空收率为0.41 mmol/(g-cat·h)。近年来CO/H2和CO2/H2合成C2+OH 已经取得了较大进展,但仍需开发更高效的催化体系、明晰其反应机理,尤其是CO2加氢合成高级醇过程。
CO2加氢反应的最终产物种类与C—O 键的活化类型和C—C 连接方式密切相关。在C—C 偶联之前,CO2加氢合成C2+OH 反应通常需要在C—O 键解离活化(烷基化)和C—O 非解离活化(形成醇)之间取得平衡[20]。已知CHx-CO(或CHx-CHO,CHx-HCOO)偶联反应是C2+醇合成的关键步骤,它可能发生在与CO 加氢生成C2+OH 相同或相似的表面活性位点上[15,21],因此,在合成气制混合醇反应中的一些优良催化剂在CO2加氢反应中也可能具有较好的反应性能,但是这类催化剂应用到CO2加氢制备C2+OH 反应的前提是应同时具有RWGS 反应活性,即能够高效催化CO2加氢转化为CO。在RWGS 路径中具有较高活性的铑基催化剂[22]、钯基催化剂[23]、铜基甲醇合成(MS)催化剂[24]和钼基催化剂[25]已有相关报道,因此,进一步探究这类催化剂在后续的合成气制混合醇中的反应性能具有重要意义。除此之外,对于改性费托合成(FTS)催化剂,其在CO2加氢制备C2+OH 反应中很难控制C—C 耦合过程,反应产物中醇的碳数分布受安德森-舒尔茨-弗洛里(ASF)理论模型限制,乙醇的比例约为35%[25-28],因而催化材料的性能仍有待进一步改善。
近年来,在针对Cu 基、Mo 基以及双功能催化剂等应用于以合成气为原料的HAS 领域的综述中,讨论了催化剂的类型、构效关系以及CO 对HAS 的作用机理,并且考虑到CO2是合成气中的低含量组分或伴随产物或中间体,因而对于相关的CO2加氢制C2+OH 过程也有一些讨论[20,29-32]。Prieto等[33-35]也对CO2加氢反应的最新进展进行了总结,然而C2+OH 只是其众多产物中的一部分[36-37],迄今针对CO2加氢制C2+OH 研究进展的综述较少。本综述总结了近年来CO2直接加氢制高级醇的研究进展,包括各种催化剂的反应性能及其可能的反应路径,讨论了高选择性催化剂所具有的不同活性位点以及所产生的反应中间体和对催化路径的选择,还对CO2加氢制备C2+OH 反应机理做了进一步总结和归纳。
1 CO2 加氢反应的热力学分析
CO2加氢制高级醇的反应网络复杂,存在许多平行和串联反应,产物涉及各种C1产物(如CH3OH,CO 和CH4)和C2+产物(例如C2+烷烃、烯烃和C2+OH)[35-36]。
(1)逆水煤气变换(RWGS): CO2+ H2→CO + H2O
(2)CO2加氢制烷烃:nCO2+ (3n+1)H2→CnH2n+2+ 2nH2O
(3)CO2加氢制烯烃:nCO2+ 3nH2→CnH2n+ 2nH2O
(4)甲醇合成(MS): CO2+ 3H2→ CH3OH + H2O
(5)高级醇合成:nCO2+ 3nH2→ CnH2n+1OH + (2n-1)H2O
上述除了RWGS 反应,大多数CO2加氢反应路线是放热过程且在低温下具有良好的反应性能,所以RWGS 反应不太可能单独进行,但如果整体热力学有利于所有反应,它可能会作为平行的副反应发生。根据标准焓变、平衡常数以及标准吉布斯自由能变化的计算,可知乙醇合成具有较低的Gibbs反应自由能和较大的平衡常数,因此在低温下该过程比甲醇合成更有利。烷烃形成过程的平衡常数在所有温度下都显著高于CO2加氢制备C2+OH 过程,这也说明烷烃(如甲烷和C2+)是热力学更有利的产物[38]。
如图1a 所示,当发生甲烷化反应时,乙醇的平衡产率接近于零,这时催化剂的选择性调控就非常重要,因为需要抑制热力学更有利的甲烷化过程;当只有一氧化碳和乙醇作为主要含碳产物时,乙醇在350 ℃以下的平衡浓度较大(图1b),由此可知乙醇合成在低温下的动力学过程更容易进行。此外,由于MS 反应与HAS 反应占据相同的活性位点用于氢化C—O 键,并且不会在醇形成过程中发生C—O 键断裂,这使得两者在动力学上仍有竞争性。纵观整个HAS 反应过程,本质上可以认为是改性FTS 和MS 过程的组合。因此,对于HAS 催化剂不仅需要使得改性FTS 与MS 路线顺利结合,而且还需提高烷烃形成的动力学能垒,从而实现C2+OH 的高选择性合成。
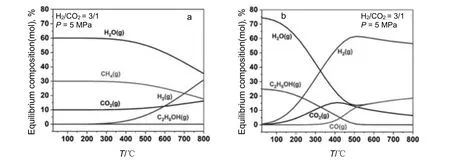
图1 CO2 加氢反应的平衡组成[38]Fig.1 Equilibrium composition of CO2 hydrogenation reactions [38]
2 贵金属催化剂
在过去几年中,有研究者发现具有空气敏感性的有机配体均相催化剂可以催化CO2加氢选择性合成C2+产物,但这些均相催化剂很难再生,也难以从反应体系中分离出来。相比之下,多相催化剂,如负载型贵金属(Au,Pd,Pt 等)催化剂,由于具有较好的C—C 偶联能力,有利于CO2加氢且易于再生,因此在CO2加氢反应中受到了广泛的关注,其中贵金属基催化剂的种类以及形态,对于CO2加氢反应也会有较大的影响。下文将重点介绍间歇反应釜中催化CO2加氢直接合成乙醇的贵金属(Au,Pt,Ir,Rh)基催化剂的开发[39-42]。
2.1 Au 催化剂
负载型金纳米粒子(Au-NPs)及金纳米团簇(Au-NCs)作为多功能催化剂在精细化学合成方面具有良好的活性和选择性,并且Au 催化剂由于在CO2加氢制甲醇的反应中具有较高活性,因此不少研究者开始探究金催化剂在温和条件下进行CO2加氢合成乙醇的可能性。Wang 等[39]研究了TiO2负载的Au-NCs,用于CO2加氢直接合成乙醇。Au-NCs 与底层TiO2载体(特别是具有丰富氧空位的锐钛矿晶相的a-TiO2)之间具有独特的协同效应,在温度为200 ℃、压力为6 MPa 的条件下反应10 h,Au-NCs/a-TiO2表现出优异的乙醇选择性(>99%)和较高的乙醇时空收率(STY),为942.8 mmol/(g-Au·h)。相比之下,Au/r-TiO2和Au/b-TiO2的活性较低,而结晶度较差的Au/am-TiO2的活性最低。Liu 等[42]的研究发现,相同的TiO2载体上通过降低Au 负载量可使金属颗粒的尺寸减小,同时提高活性组分的分散度,其性能也得到显著提高,Au-NCs 显示出高的乙醇STY,为635.4 mmol/(g-Au·h)。该团队还研究了具有锐钛矿(a-)、金红石(r-)、板钛矿(b-)和无定形(am-)的不同晶型TiO2对Au/TiO2催化剂的影响,结果表明Au 负载后载体没有结构变化,表面具有丰富氧空位的锐钛矿负载金纳米团簇催化剂(Au-NCs/a-TiO2)拥有强金属-载体相互作用,可高效催化CO2加氢直接合成乙醇。上述研究证明了TiO2作为载体可以提供缺陷氧空位,对于调节金属-载体相互作用至关重要,可以显著促进乙醇的直接合成,并且规模化制备Au/a-TiO2催化剂仍具有强烈的金属-载体相互作用,表现出在贵金属催化剂中较高的活性和对目标产物乙醇的高选择性以及优异的稳定性,但是对于载体晶形要求较高,不易操作和大规模制备,同时较高的成本也阻碍了其发展。
2.2 Pt 基催化剂
为了探究低温CO2加氢反应,催化性能优异的Pt 基催化剂进入了研究者的视野。He 等[41]的研究结果表明,水促进了CO2加氢生成C2+醇反应,在温度为220 ℃,压力为8.0 MPa 的条件下,水与1,3-二甲基-2-咪唑烷酮(DMI)的混合溶剂中反应15 h,Pt-Co3O4催化剂上C2+醇的选择性高达88.1%,Co3O4载体在还原性气体下还原后可形成氧空位,然后空位和负载的金属可以在氧化物-金属界面处将H2O 分解为H+和OH–。不同温度下该反应的结果如图2 所示,发现在这一催化体系中生成高级醇所需的温度较低,且水可以有效地促进高级醇的合成,还能够增加催化剂表面的羟基含量,从而改善DMI 等溶剂在CO2溶解和CO2与催化剂相互作用方面的性能。通过13C 标记测试发现,甲醇可以作为该催化体系中乙醇合成的碳源。有报道表明,水可以促进Cu(111)表面的甲醇解离[43]。该实验结果也证实水可参与反应并能促进C2+OH 的形成,这主要归因于水可以将甲醇质子化形成质子化甲醇,其容易分解为CH3*、OH*和H*(或H2O)物种;CH3*物种可以进一步与CO 偶联成CH3CO*,然后在Pt/Co3O4催化剂的活性位点将其加氢成乙醇。因此,可以看出,含Pt 催化剂与水溶剂之间具有很好的协同作用,在促进反应的同时也使得反应条件更加温和。

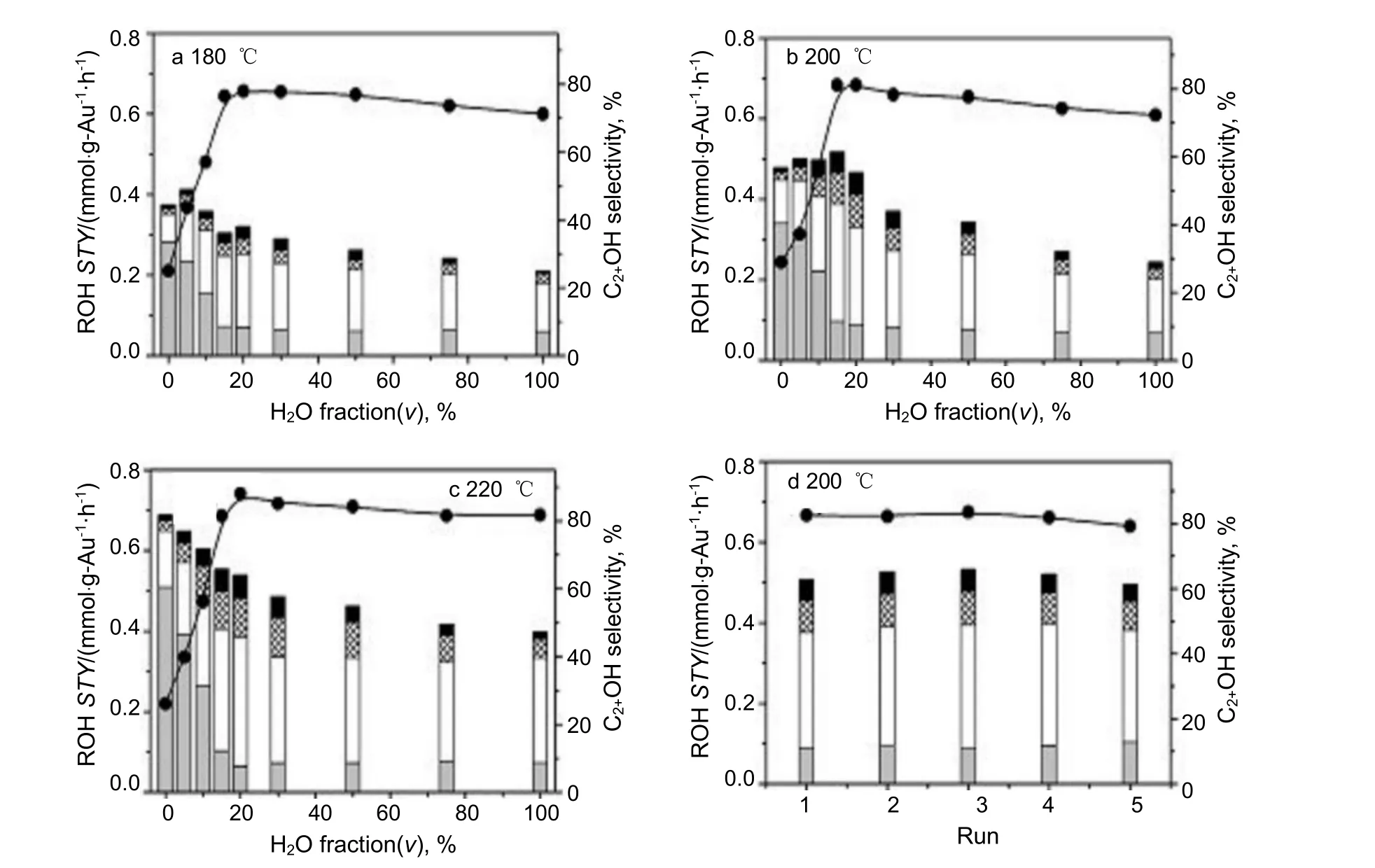
图2 混合溶剂中H2O 体积分数对反应结果的影响(a-c)以及Pt/Co3O4 催化剂重复使用性能(d)[41]Fig.2 Effect of H2O volume fraction in the mixed solvent on the reaction results(a-c) and the reusability of Pt/Co3O4(d) [41]reaction conditions: catalyst 20 mg, initial pressure 8.0 MPa (H2/CO2=3:1), 15 h
2.3 Ir 基催化剂
在CO2加氢制备高级醇的反应中,催化剂活性位点的分离对于控制碳链增长至关重要。Ye 等[44]设计了一种双功能单原子催化剂Ir1-In2O3(In2O3上Ir 的负载量为0.2%质量分数),通过将单原子Ir锚定在In2O3载体上来整合两个催化活性中心,这种Ir1-In2O3单原子催化剂在液相CO2加氢反应中具有较好的性能,在温度为200 ℃,压力为6.0 MPa 条件下反应5 h,乙醇选择性高达99%,且单位时间内单位活性位点的催化剂转换频率(TOF)为481 h-1。Martin 等[45-47]的研究表明,In2O3是CO2加氢制甲醇的有效催化剂,基于Ir 的单核配合物可以催化甲醇羰基化,因此Ir1-In2O3双功能催化剂对于乙醇合成的探究有重要意义。Ye 等[44]也通过理论计算和红外光谱表明,单原子Ir 与In2O3上相邻的氧空位(Ov)之间可形成路易斯酸碱对,形成Ir-Ov 和In2O3两个不同的催化活性中心,将CO2还原为活性中间体,然后促进C—C 偶联形成乙醇。
Ye 等[44]将Ir1-In2O3单原子催化剂用于水溶液中的CO2加氢反应,结果见图3。在反应后气态和液态产物中仅检测到了甲醇和乙醇,而纯In2O3催化反应只产生甲醇,结果表明单原子Ir 的加入使得乙醇选择性和TOF 增加(见图3a 和图3b),Ir1-In2O3比In2O3的乙醇选择性高,但使用其它Ir 负载量的催化剂(Ir-In2O3)时其乙醇选择性和TOF 却降低。通过TEM 表征与性能对比,说明Ir 的质量负载量在0.2%时得到的Ir1-In2O3单原子催化剂性能优于负载量高的Ir-In2O3纳米颗粒催化剂。图3c 显示,较低的温度更有利于乙醇的生产。由图3d 可知,在反应初期乙醇产率相对较低,为0.016 mmol/(g·h),反应5 h 后增至0.99 mmol/(g·h),乙醇选择性从51.6%增加到99.7%;而甲醇的产率一直很小,最终恒定在0.012 mmol/(g·h)。由于甲醇在反应中更容易产生,如果反应过程中生成的甲醇没有消耗,甲醇的产率应随反应时间增加有所上升,图3d 结果说明乙醇选择性与甲醇的相对产量有关,间接表明甲醇可能是乙醇合成的重要中间体。
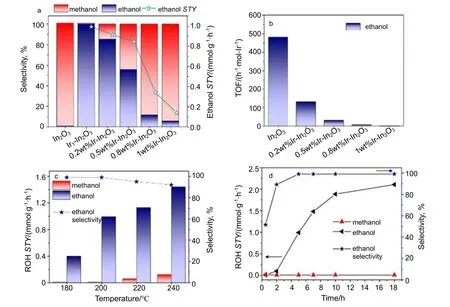
图3 不同条件下CO2 加氢反应结果[44]Fig.3 Results of CO2 hydrogenation under different conditions[44]
通过原位漫反射红外线傅里叶变换光谱法对Ir1-In2O3催化过程中CO2的转化进行了验证。在200 ℃下吸附CO2后,Ir1-In2O3上出现了一氧化碳中间体,印证了Irδ+-CO*的形成[48-50];还检测到Ir1-In2O3在碳酸盐和碳酸氢盐处的峰强度高于纯In2O3,这意味着Ir-Ov 和In2O3两个不同的催化活性中心,促进了CO2的活化。此外,Ian 等[51-52]检测到了另一个重要的中间体CH3O*,而使用纯In2O3很少观察到这些谱峰,这表明Ir 单原子也有助于稳定Ir1-In2O3的Ov 上的甲醇盐。结合13CH3OH 同位素实验可知,Irδ+-CO*和CH3O*-Ov 的稳定中间体是C—C 偶联的关键物质[41]。由此,Ye 等[44]归纳出Ir1-In2O3上CO2加氢的可能反应路径如图4 所示。该催化剂在贵金属催化剂中是一个较为新颖的探索,且将竞争产物甲醇作为中间体,提升了乙醇的选择性,在贵金属催化剂中表现出了较好的高级醇制备性能,但是双功能单原子催化剂的制备较为繁琐,且CO2转化率较低,因此广泛使用还不太成熟。
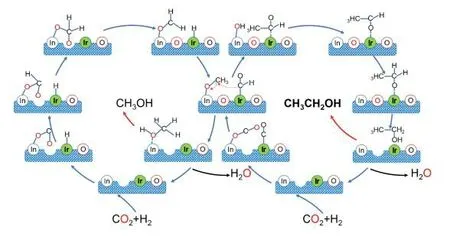
图4 Ir1-In2O3 催化剂用于CO2 加氢制乙醇可能的催化机理[44]Fig.4 A proposed catalytic mechanism of CO2 hydrogenation to ethanol on the Ir1-In2O3 catalyst[44]
2.4 Rh 基催化剂
早在1975 年就有Rh 基催化剂用于一氧化碳加氢制乙醇的研究报道[53],由于Rh 具有独特的吸附和活化一氧化碳的特性,因而是实现合成气高效制C2+含氧化合物的催化活性组分。Yin 等[54]对CO加氢制乙醇催化过程进行了深入研究,开发了低含量的Rh 基催化剂并进行了年产1 万吨的工业放大装置建设,并得到了工业应用。Rh 在CO2加氢中也表现出良好的乙醇选择性。Wang 等[55]的研究报道,Rh 基催化剂可同时催化其相邻原子的Rh0-Rhn+物种对一氧化碳的解离和吸附,从而形成C2+含氧化合物,包括乙醇、乙醛和乙酸(AA)。因此,除了在合成气合成C2+OH 中的应用,Rh 用作CO2加氢反应的催化材料也值得探讨。Inoue 等[22]首次报道了Rh 基催化剂用于催化CO2加氢制C2+OH,发现Rh/TiO2和Rh-Na/TiO2催化剂有利于CO2加氢合成乙醇。Yang 等[52]对负载在TiO2纳米棒和纳米粒子上的Rh-Fe 进行了比较研究,发现由于Rh-Fe 和具有丰富羟基的TiO2纳米棒之间的强相互作用,Rh-Fe基纳米粒子可以高度分散在TiO2纳米棒上,促进了CH3*中间体的产生,在250 ℃和3 MPa 的条件下,乙醇选择性高达32%,CO2转化率为15%。Kusama 等[56-57]发现,Li 改性和Fe 改性的Rh/SiO2催化剂对于CO2加氢合成乙醇是可行的,在5 MPa 和260 ℃条件下,Rh-Fe/SiO2催化剂催化的CO2转化率为26.7%,乙醇选择性为16.0%。Yang 等[52,58]也在研究中发现,在250 ℃和3.0 MPa 的条件下,Rh-Fe-Li/TiO2催化的CO2转化率约为 15%,含碳产物中乙醇选择性高达 32%,乙醇产率为1.65 mmol/(g-cat·h),且稳定运行了20 h。由于一氧化碳或甲烷是纯Rh 催化剂上CO2加氢的主要产物,因此需要加入碱金属或过渡金属来促进C2+产物和C2+含氧化合物的形成。反应过程中CH3*物种和H*可通过富含电子的Rh 表面达到稳定的状态,增加能量势垒以抑制甲烷形成,促进CO*与CH3*的耦合,从而实现C2+含氧化合物的合成[59]。
与其他催化剂体系相比,Rh 的C—C 偶联能力相对较低,所以乙醇是Rh 基催化剂制备C2+OH的主要产物,而Rh 基催化剂载体的研究和设计为催化剂结构、活性中心电子态和催化性能的调控提供了指导。由于Rh 的成本较高,大规模应用仍很难实现,因此选择双金属或具有多个活性位点的多种金属,并准确规定基本反应步骤,包括RWGS,CO*加氢生成CH3*或H3CO*中间体,以及CO*插入的过程,对于高效催化CO2加氢生成C2+OH 至关重要。
3 非贵金属催化剂
由于贵金属催化材料对载体材料晶型结构要求较高[39-40,42],部分贵金属催化剂的制备较复杂[44],且商用金属催化剂成本较高,许多研究者将目光转向用廉价且丰富的第一排过渡金属替代稀有且昂贵的贵金属,特别是用于传统费托合成的Co,Cu 和Mo 等催化材料,对其加以改性用于催化CO2加氢合成C2+OH 反应。
3.1 Co 基催化剂
Co 基催化剂是一种典型的FTS 催化剂,在CO2加氢制备C2+OH 反应中受到众多研究者的关注。然而,金属Co 的RWGS 反应活性较低,且具有很强的加氢能力,因此其催化CO2加氢的主要产物为甲烷[60-61]。Okabe 等[62]首次报道了Co 基催化剂用于催化CO2加氢反应,产物乙醇的选择性为7.9%。在Co 基催化剂上实现C2+OH 合成的方法有多种,其中采用有缺陷位点的Co3O4代替金属Co 的方法可有效提高C2+OH 合成中的催化性能。Ouyang 等[63]合成了负载Pt 纳米带形式的Co3O4催化剂,在2 MPa和200 ℃条件下,C2+醇的产率为0.5 mmol/(g-cat·h),但醇类产物中C2+OH含量太低(约为22%)。进一步研究发现[64],采用有序介孔Co3O4促进了碳链增长,并且提高了C2+OH 收率和C2+OH 选择性,分别为0.75 mmol/(g-cat·h)及41.8%(见图5)。Yang 等[65]合成了具有低还原性和高RWGS 活性的Cu-Co3O4催化剂,在3 MPa,250 ℃下,催化CO2加氢的转化率为13.9%,乙醇产率为1.87 mmol/(g-cat·h)。由此可见,抑制Co3O4完全还原为金属Co 是制备C2+OH 催化剂的关键。另一种方法是利用Co 与载体之间的强相互作用稳定大面积还原的活性Co 中心。Zhang 等[66]研究了载体(Al2O3,ZnO,AC,TiO2,SiO2和Si3N4)在Co 催化CO2氢化合成高级醇中的作用,发现惰性载体(如SiO2和Si3N4)可用于稳定环境中的CO2,并且提供了有效的催化位点;结果表明Na-Co/SiO2的催化活性最好,CO2转化率为18.8%,C2+OH 总选择性为8.7%,C2+OH 占总醇中的比例为87.5%。Wang 等[15]采用Co-Al层状双氢氧化物(LDH)衍生的CoAlOx催化剂催化CO2加氢反应,在140 ℃下的乙醇选择性为92.1%,乙醇时空收率为0.444 mmol/(g-cat·h)。此外,进一步在CoAlOx催化剂中引入Ni 物种,发现其加速了相对稳定的CHx中间体形成,使得Co0.52Ni0.48AlOx具有将CO2选择性转化为乙醇的优异性能[67]。
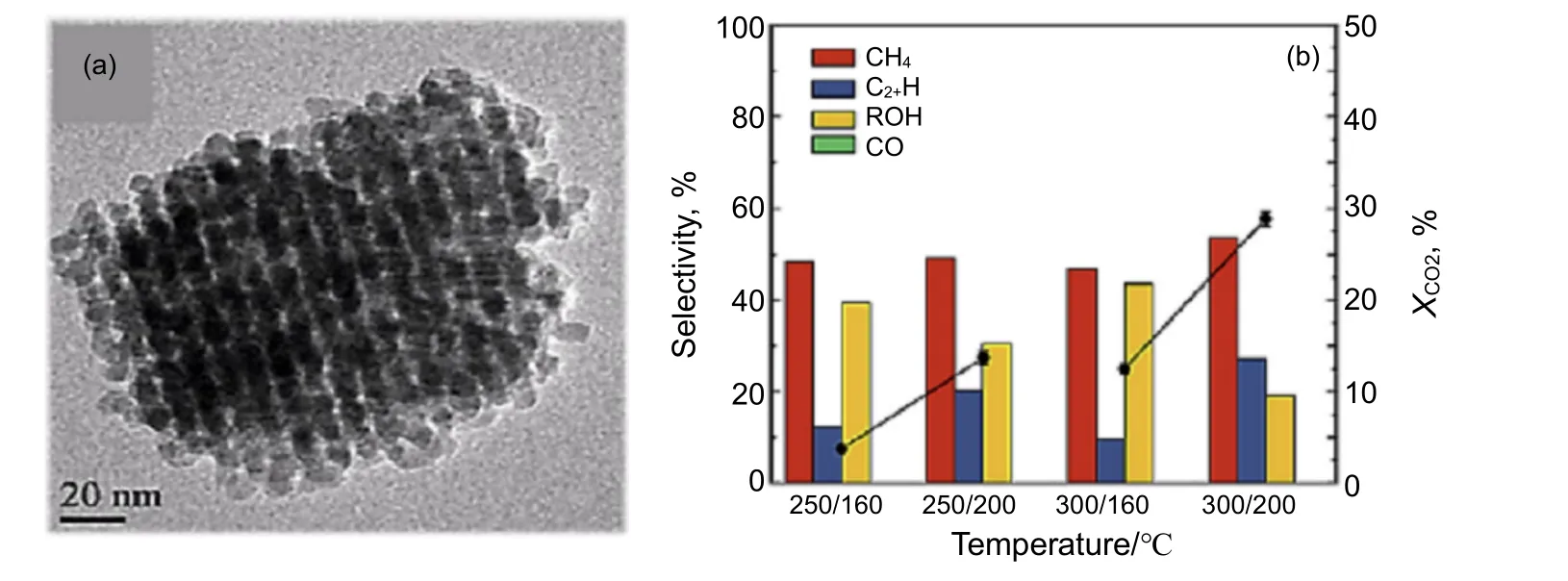
图5 有序介孔Co3O4 的TEM 照片(a)及在不同条件下的催化性能(b)[62]Fig.5 TEM image (a) and catalytic performance (b) of ordered Mesoporous Co3O4 under different conditions[62]catalysts were prereduced at 250 ℃ or 300 ℃ and catalytic tests were performed at 160 ℃ and 200 ℃
为了确定Co 的物相对催化性能的影响,Wang 等[15]分析了CO2和H2之间的相互作用在Co 催化剂上所产生的反应中间体,通过原位傅里叶变换红外光谱(FT-IR)检测,确定了乙氧基的FT-IR 振动峰(1 038 cm-1和1 362 cm-1)和乙酸盐的振动峰(1 471,1 584 和2 895 cm-1),说明在CoAlOx-600催化剂上CO2加氢反应形成了生产乙醇的重要中间体——乙氧基和乙酸盐物质。再通过傅里叶变换红外光谱对在具有脉冲氢气的连续CO2流中的CoAlOx-600 催化剂进行研究,结果表明确实存在CHx*插入甲酸盐转化的C2+氧化物,阻碍了CHx*进一步加氢形成甲烷。由以上结果可以推测,乙醇的形成是通过CO2吸附和活化、甲酸盐的形成、CHx*插入转化为乙酸盐以及加氢的过程。该研究表明,CoAlOx-600 对乙醇的高选择性是由于表面氧化物的高还原性增强了生成CHx*的能力,更易于将甲酸盐转化为乙酸盐的中间体,也证实乙酸盐是乙醇生成的重要中间体这一猜测。
在间歇釜反应器中,在相对较低的反应温度(140~220 ℃)下,一般是能够通过上述催化剂获得较高的C2+OH 选择性(特别是对乙醇);在固定床反应器中,相对较高的反应温度(>250 ℃)有利于部分催化剂直接将CO2加氢生成C2+OH[58]。Zhang 等[66]发现,负载型Co2C 催化剂在250 ℃、5.0 MPa 条件下反应40 h,CO2加氢反应的转化率约为18%,醇类分布中乙醇选择性为62.8%。对于该反应过程,可以视为CO2通过RWGS 在Co2C 位点形成一氧化碳,然后插入CHx中间体生成乙醇。
3.2 Cu 基催化剂
Cu 基催化剂被广泛用于催化CO/CO2加氢反应,它的活性以及对产物的选择性与催化剂载体的性质的关系较大。由于Cu 本身没有C—C 耦合的能力,因而对于Cu 基催化剂的研究主要集中在双功能催化剂上。Xu 等[21]报道了Cs 改性Cu-Fe-Zn 催化剂用于催化CO2加氢合成C2+OH 反应,在固定床反应器中于330 ℃和5.0 MPa 条件下反应3 h,CO2转化率为36.6%,C2+OH 选择性为19.8%,醇分布中的C2+OH 分数为93.8%,且C2+OH 具有较高的STY,为73.4 mmol/(g-cat·h)。并提出Fe7C3和Cu 分别负责一氧化碳解离形成CHx物种和一氧化碳非解离吸附(图6),在不同金属组成的催化剂中,Cu:Fe:Zn(物质的量之比)为0.8:1.0:1.0、Cs 质量分数为3%的催化剂(Cs3w%-Cu0.8-Fe1.0-Zn1.0)的性能最佳。尽管在这些改性FTS 催化剂上很容易获得的含高比例C2+OH 的醇,但所有产物中的总醇选择性却非常低(<20%),主要产物仍然是烃类和一氧化碳。
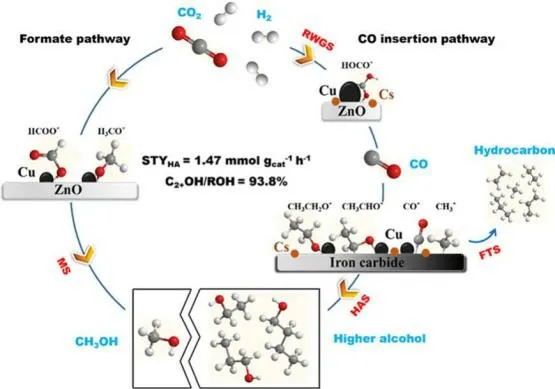
图6 Cs-Cu-Fe-Zn 催化剂上CO2 加氢的反应途径[21]Fig.6 Reaction pathways of CO2 hydrogenation over the Cs-Cu-Fe-Zn catalyst[21]
对于氧化物衍生的Cu 催化剂,电化学还原二氧化碳(CO2RR)为多碳(C2+)产物的活性位点是近年来一直在探究的问题。近期Cheng 等[68]采用神经网络(NN)电位的分子动力学模拟了氧化物衍生过程,基于神经网络电位的高通量测试对150 多个表面位点进行分析后,结合密度泛函理论计算,确定了三个用于C—C 耦合的方形位点;通过理论与实验结果结合,定量证明了Σ3 晶界如平面方形位点和凸方形位点负责乙烯生产,而阶梯方形位点,即n(111)×(100),具有稳定乙醛中间体和破坏Cu—O 相互作用的几何效应,更有利于生成醇。并根据模拟结果绘制了该反应中CO2还原的反应途径(如图7 所示):乙烯途径通过C—O 键的裂解进行,醇则通过进一步质子化形成;在平面方形(p-sq)和凸方形(cv-sq)位点上,与α-C 质子化形成CH3CHO*中间体相比,C—O 键断裂形成C2H4过程热力学更有利;相反,阶梯方形(s-sq)位点更利于进一步加氢,从而抑制了生成C2H4途径,促进了醇的产生。结果表明p-sq 和cv-sq 位点负责产生乙烯,而s-sq 有利于醇类的产生[68]。
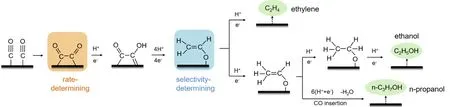
图7 二氧化碳电化学还原(CO2RR)中C2+产物的反应途径[68]Fig.7 Reaction pathway for C2+ products in electrochemical reduction of carbon dioxide (CO2RR) [68]
Gao 等[58,69]研究了Cu@Na-Beta 催化剂。Cu 纳米颗粒包裹在Na-Beta 沸石晶体颗粒中,由于沸石晶体颗粒与Cu 纳米粒子之间的协同作用,在固定床反应器中该催化剂能够将CO2在沸石骨架周围高选择性地转化为乙醇(见图8a),且反应中没有形成碳氢化合物和甲醇,乙醇和一氧化碳是唯一的产物(见图8b)。在实验条件下,压力为2.1 MPa 时的乙醇选择性占总醇的100%,一氧化碳选择性为21%,CO2转化率为18%。该研究指出,CH3COO*物种是CO2生产乙醇的最重要中间体,它是由CO2*和CH3*在Cu(211)纳米颗粒的台阶位点之间键合形成的,通常很难在单个Cu 位点获得C2+产物,因此抑制了Cu 表面的CO2反应,并阻断了副产物的产生。这项工作的创新点在于使用三维沸石骨架以笼状结构限制和调控Cu 纳米粒子的大小,以实现在Cu 表面精确的C—C 偶联[56]。从这个角度来看,利用具有特殊孔结构的材料,如MOF、沸石和介孔硅来调节催化剂的结构、晶粒尺寸和电子状态是一个很好的选择。
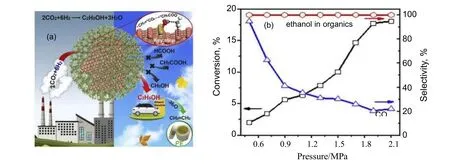
图8 Cu@Na-Beta 催化剂上的CO2 加氢制乙醇反应过程(a)以及反应压力对CO2 加氢反应的影响(b)[69]Fig.8 The reaction process of CO2 hydrogenation to ethanol over Cu@Na-Beta catalyst (a)and influence of reaction pressure on CO2 hydrogenation(b) [69]reaction conditions: 300 ℃; 12 000 mL/(g·h); H2/CO2 = 3
3.3 Mo 基催化剂
钼基催化剂(如Mo2C,MoO3,MoS2和MoP)在合成气制乙醇中的性能已经进行了较多研究[70-73],关于其催化CO2加氢制C2+OH 也有少量报道。Tatsumi 等[25]使用碱金属盐和Mo 盐浸渍二氧化硅的方法制备了具有一定C2+OH 选择性的碱处理Mo/SiO2催化剂,首次将Mo 催化剂应用在CO2加氢制C2+OH 中,在250 ℃以及CO2/H2体积比为1 的条件下,选择性地获得了C1~C5醇。Catafat 等[74]用K 促进的Co-MoO4催化剂催化CO2加氢合成乙醇,发现K 可以抑制烃类合成并能够促进乙醇生成,且Co 的存在有助于乙醇的生成,但催化性能不理想,CO2转化率仅为7.2%,乙醇选择性约为6.5%。Chen 等[75]研究了槽式反应器中Mo2C 负载金属(如Cu,Pd,Co 和Fe)催化剂上的CO2加氢反应,发现添加Cu 和Pd 可促进甲醇的生成,添加Co 和Fe 可以提高催化剂的C—C 偶联能力,从而促进乙醇的生成,说明烃类是FTS 过程中生成一氧化碳中间体后产生的产物,而CO2产生甲酸酯中间体是得到甲醇的主要来源。Liu 等[76-77]合成了较大粒径的Mo-Co-K 催化剂,在5 MPa 和320 ℃条件下,催化剂的催化性能最佳,其CO2转化率为8.1%,C2+OH 选择性为15.9%,C2+OH/ROH 占比为27%。
Dubois 等[78]总结了一系列碳化物催化剂的性能,发现Mo2C 和Fe3C 在220~280 ℃时比碳化钨(WC)和碳化钽(TaC)更具活性。135 ℃时甲醇是主要产物,其选择性超过79%,其余产物为少量一氧化碳和甲烷。图9 所示为135 ℃和200 ℃时M/Mo2C(M 为Cu,Pd,Co,Fe)催化剂上甲醇和乙醇形成速率的比较。
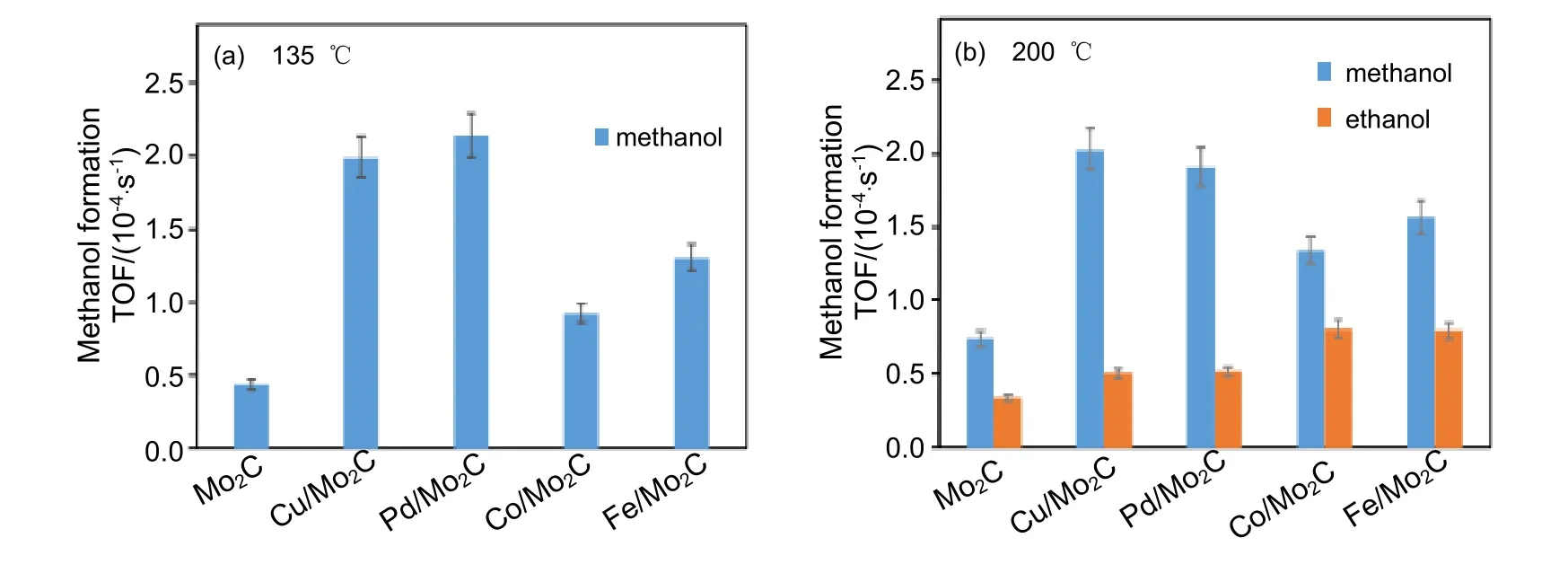
图9 M/Mo2C 催化剂上甲醇和乙醇生成的TOF [75]Fig.9 Turnover frequencies for formation methanol and ethanol over M/Mo2C catalysts [75]reaction conditions: 1.0 MPa CO2, 3.0 MPa H2; 37.5 mL 1,4-dioxane
由图9 可知,200 ℃时M/Mo2C 催化剂上除了生成甲醇外,也会产生乙醇产物,所有M/Mo2C 催化剂上的总醇TOF 值相似(26×10–4~30×10–4s–1)[75]。Schaidle 等[79]发现,Mo2C 以离解和缔合的方式吸附一氧化碳,然后一氧化碳负责链增长形成醇。碳转化率低和C2+OH 选择性低是钼基催化剂的缺点,并且该类催化剂的活性位点与反应机理还不确定,因此在合成C2+OH 中的应用仍有待发掘。
4 总结与展望
近年来,热催化CO2加氢制C2+OH 反应受到了极大的关注并取得了一定的进展,该反应所需的温度条件较为温和,是一个可行且有应用前景的方向,但是该过程催化剂的开发并不完备,仍处前期探索阶段,反应的醇收率低、CO2转化率不高以及催化剂寿命短等问题还有待解决。研究者们在开发双金属体系以及可还原金属氧化物等高效新型催化剂的同时,也逐步探讨催化活性位点和反应机理。贵金属催化剂(如Rh、Ir 基催化剂)普遍显示出较高的C2+OH 选择性,但CO2转化率较低,而且贵金属基催化剂的负载量较高,通常高于2%(质量分数),使得这类催化剂虽然具有优异的选择性但成本较高。非贵金属催化剂普遍存在活性不高以及醇的低选择性问题,且难以确定其活性位点。比较而言,铜基催化剂具有相对较高的CO2转化率和较为稳定的C2+OH 选择性,Co 基FTS 催化剂和Mo 基催化剂虽然抑制了CO2向CO 的转化,但由于甲烷化能力强,所以C2+OH 的选择性仍然很低。考虑到催化剂的成本,Cu 基和Co 基催化剂仍有较好的前景。此外,人们对CO2加氢制C2+OH 的反应网络还不确定,这也严重阻碍了高级醇合成的大规模工业化进程,目前对于CO2加氢制备C2+OH 过程更加认可的是CO 插入机理,碳链增长过程中不断插入CO 从而生成更高碳的含氧化合物,但CO 的插入方式和插入速率难以调控。随着研究方法的发展,这些现实问题有望在未来的研究中得到解决。
综合上面有关催化剂的介绍,对催化剂的合理设计、研究和制备以进一步提高催化性能,提出以下见解:(1)结合并利用密度泛函理论计算(DFT)和分子动力学模拟来预测活性中心和反应机理,从而指导实验中催化剂组成和结构的设计。借助理论计算预测的活性中心,利用助剂、载体或新的合成方法构建独特的结构和电子态。例如,利用原位拓扑转化合成高密度的界面位点,以增强活性位点和中间体的协同作用;或增加催化剂表面的缺陷位,促进CO2的吸附和活化,并降低中间反应的能垒[80]。目前性能较优的具有多孔结构的二维或三维材料(例如MOF 和沸石分子筛)也可用于封装活性金属以实现限制效应、催化剂电子状态和形貌的调节来实现选择性催化。(2)探索确切的活性位点,可以通过建立模型催化系统来简化研究。结合多种原位表征技术(X 射线衍射技术、X 射线光电子能谱分析、透射电子显微镜、X 射线吸收精细结构和红外光谱等)研究催化剂在反应条件下的真实动态变化,以进一步提高催化性能。(3)基于反应耦合的策略实现反应中间体高效转化并调控反应网络。例如高温甲醇催化剂和分子筛串联的甲醇合成与甲醇制烃类(MTO,MTG 和MTA 等)反应的耦合,探索这种策略在高级醇合成中的更多应用,以提升C—C 偶联能力,提高选择性。例如将RWGS 和一氧化碳插入反应(CO+CHx)的结合,或者甲醇合成反应(生成CH3O*)和烃类合成反应(形成CHx*)的整合,以实现CH3O*和CHx*之间的偶联,可以提高C2+OH 的选择性。(4)使用更多用于有效搜索和设计催化剂的实验技术和计算手段。例如高通量催化剂合成和性能评估、3D 打印、原位表征和监测等实验技术越来越多地被用于快速发现新型催化剂和材料[58]。例如高通量和自动化计算模拟和反应建模以及机器学习算法,促进了对新催化剂的理论理解和预测[81-83]。这些实验技术和计算手段也可根据多相催化剂中的应用所需而有所调整,因此有望将这类技术与催化剂的设计结合起来。
CO2的大量排放引起了严重的环境问题,将CO2加氢合成C2+OH 是一个具有挑战且有意义的研究。本文从催化剂材料的种类、催化机理以及反应系统设计等多个方面进行了总结并提出展望,希望该综述能为CO2加氢合成C2+OH 的进一步发展奠定基础,期待出现更多新的研究来克服CO2加氢制备高级醇的挑战。
