CRISPRi 技术沉默MRP1 基因表达增强A549/DDP 细胞对TSN 的敏感性
2022-08-12孟令雪郭旭孙新迪沈洋张伟伟杨清竹邵淑丽
孟令雪,郭旭,孙新迪,沈洋,张伟伟,2,杨清竹,2,邵淑丽,2
(齐齐哈尔大学 1.生命科学与农林学院,2.抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
肺癌是最常见的癌症类型之一.2020 年,全球约有1 930 万例新癌症病例,1 000 万例癌症死亡病例.肺癌的新发病例排第二位(11.4%),约有180 万人因肺癌死亡(18%),其是癌症死亡的主要因素[1].在肺癌治疗中,化学疗法被认为是所有阶段的重要治疗手段[2],但不可避免癌细胞出现耐药性,进而导致化疗失败.多药耐药(MDR)常见的机制是癌细胞中ATP 结合盒(ABC)外排转运蛋白的过表达.多药耐药相关蛋白1(MRP1)是第一个被发现的ABCC 亚家族转运蛋白,也被称为ABCC1[3],它是一个在人体组织中广泛表达的谷胱甘肽转运泵,通过将GSH 和化疗药物一同泵出细胞外发挥了保护细胞的作用[4-5].已有研究证实,MRP1的过表达会导致肺癌[6]、上皮性卵巢癌[7]、乳腺癌[8]、原发性神经母细胞瘤[9]等肿瘤细胞产生耐药性,进而影响患者的化疗效果.因此,干扰MRP1的表达是逆转癌细胞耐药性的关键环节.
成簇的规则间隔短回文重复序列(CRISPR)-Cas(CRISPR 相关蛋白)是一种原核适应性免疫系统,只存在于细菌及古生菌中,在真核生物及病毒中未发现.目前使用最广泛的是可用于编辑人类基因组的酿脓链球菌Ⅱ型CRISPR/Cas9[10].CRISPRi 工具采用灭活的Cas9(dCas9),其上的2 个核酸酶域发生突变,会与DNA 结合,但不具有DNA 切割活性.因此,该方法可以抑制基因转录,导致基因沉默[11].目前,应用CRISPRi 技术逆转肿瘤细胞多药耐药的研究已经逐渐深入[12].
本研究利用CRISPRi 技术构建MRP1干扰表达载体,沉默A549/DDP 细胞内MRP1基因的表达,检测其对川楝素敏感性的变化,为肺癌耐药性逆转提供理论依据.
1 材料与方法
1.1 材料与试剂
人肺癌A549 细胞株,人肺癌顺铂耐药株A549/DDP 细胞(北京肿瘤生物中心);川楝素(南通飞宇生物科技有限公司);RPMI-1640 培养基干粉(Gibico 公司);胎牛血清(以色列Biological Iudustries);质粒pSPgRNA(Genscript 公司(Scotch Plams USA),由实验室前期保存);E.coliDH5α,质粒快速小量提取试剂盒,UNIQ-10 柱式总RNA 提取试剂盒,M-MuLV 第一链cDNA 合成试剂盒,全蛋白提取试剂盒,DNA Marker(1Kb),蛋白Marker,吖啶橙,EDTA(上海生工生物工程股份有限公司);Power SYBR®Green PCR Master Mix 试剂盒(Bioteke Corporation);MRP1,β-actin一抗,羊二抗(美国LI-COR 公司).
1.2 实验方法
1.2.1 CRISPRi 技术构建MRP1干扰表达载体 根据靶点预测网站(http://zifit.partners.org///www.ZiFiT/CSquare9Nuclease.aspx)对MRP1基因启动子区进行靶位点预测,结合转录因子预测软件(http:genomatix.de/en/index.html)预测的MRP1启动子上节能结合的转录因子确定3 个CRISPRi 干扰位点(见表1),每个片段的5′加BbsⅠ酶切位点序列送sangon 合成.
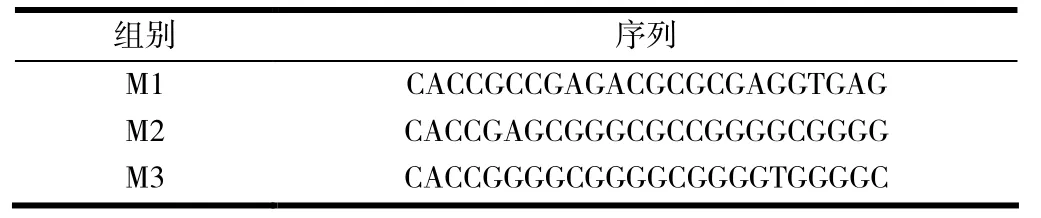
表1 靶向MRP1 启动子的3 个CRISPRi 干扰位点
1.2.2 细胞培养 在37 ℃,5% CO2与饱和湿度环境下的细胞培养箱中,用含10%胎牛血清的RPMI-1640培养基培养人肺癌A549 和A549/DDP 细胞,根据细胞生长状态进行传代及后续处理,并收集细胞样品用于实验.
1.2.3 qRT-PCR 检测MRP1mRNA 的表达 收集各组细胞,使用Trizol 法提取总RNA,用TOYOBO 反转录试剂盒将RNA 反转录为cDNA,以cDNA 为模板,用TAKARA 荧光定量试剂盒进行qRT-PCR,反应体系为:5 μL 染料、2.5 μL 水、上下游引物共1 μL,cDNA 1.5 μL.选用GAPDH为内参,上游引物序列为:5′-CAATGACCCCTTCATTGACC-3′,下游引物序列为:5′-GACAAGCTTCCCGTTCTCAG-3′.MRP1上游引物序列为:5′-GGGGTCCTCATTATCTTCTGG-3′,下游引物序列为:5′-TGGTCTCAGGGTAGGGGTTAG-3′.所得结果以2-△△Ct方法计算mRNA 相对表达量.
1.2.4 Western blot 检测MRP1 蛋白表达 将细胞接种到6 孔板中,待细胞生长到对数期,将干扰载体转染进细胞中培养48 h,RIPA 裂解液提取总蛋白,SDS-PAGE 电泳后将蛋白样电转移至PVDF 膜上,5%脱脂奶封闭1.5 h,MRP1 一抗(均按1∶500 进行稀释)4 ℃孵育过夜,PBST 洗膜3 次,兔二抗(1∶1 000稀释)室温避光孵育1 h,PBST 洗膜3 次,用Odyssey IR 成像仪避光扫描蛋白条带,数据使用ImageJ 进行分析处理.
1.2.5 MTT 法检测细胞药物敏感性 收集A549/DDP、转染无关对照组及sgRNA-MRP1-2 组48 h 后的细胞,用完全培养液将收集到的细胞制成单细胞悬液并计数,按照每孔5×105个的密度接种到96 孔板中,分别加入浓度为0,20,40,60,80,100 nmol/L 的川楝素作用24 h,在每孔中加入20 μL 5 mg/mL 的MTT继续培养4 h,每孔加入180 μL DMSO,轻轻晃动后,静置15 min.在单波长570 nm 处测定光吸收值,计算各药物浓度下的细胞存活率,确定IC50值.细胞存活率(%)=实验组吸光度值/对照组吸光度值×100%.
1.2.6 激光共聚焦检测人肺癌A549/DDP 细胞凋亡 取对数生长期的细胞,传代至装有盖玻片的6 孔板中,细胞数达到一定量时,采用PEI 转染法转染Scrambled 及sgRNA-MRP1-2 重组载体48 h 后,加入终浓度为60 nmol/L 的川楝素继续培养48 h.再用1 mL 预冷PBS 洗涤细胞,用1 mL 甲醇固定30 min,滴加200 μL吖啶橙,使吖啶橙覆盖所有细胞,用镊子将玻片取出,倒扣在处理干净的载玻片上,用蓝色光激发,激光共聚焦显微镜下观察细胞形态并拍照.
1.2.7 统计学处理 实验数据以均数±标准差(¯x±s)表示,用SPSS 25 软件分析,采用Graphpad Prism 5软件作图.使用student t 检验进行组间比较.
2 结果与分析
2.1 CRISPRi 技术构建MRP1 干扰载体
根据MRP1基因启动子序列,设计合成3 对CRISPRi 片段,定向克隆到pSPgRNA 载体上,重组载体测序结果见图1.由图1 可见,重组干扰载体序列与预期完全一致,3 种靶向MRP1干扰表达载体构建成功.
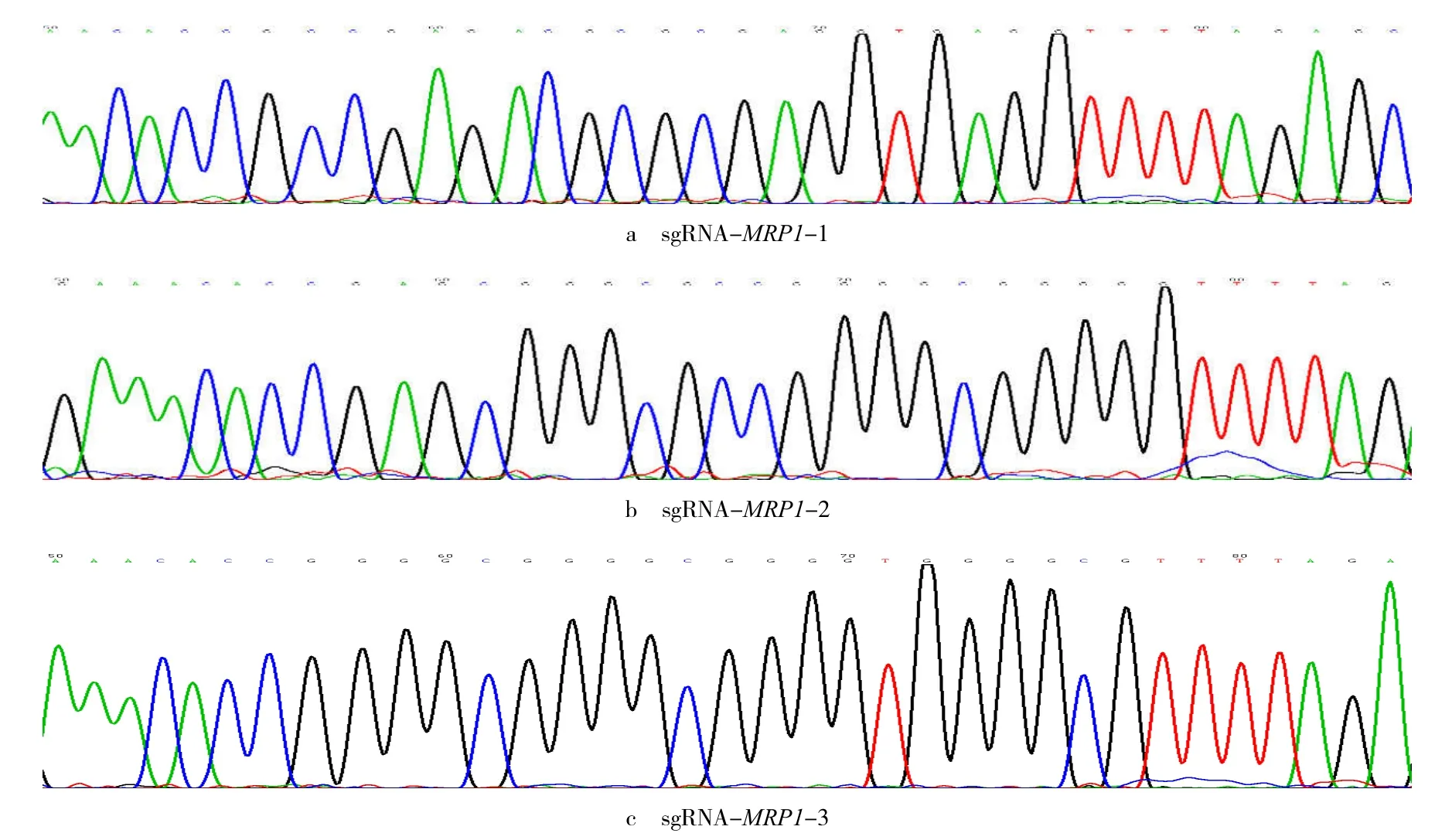
图1 MRP1 基因重组质粒测序图谱
2.2 qRT-PCR 和Western Blot 检测干扰载体对MRP1 基因表达的影响
转染干扰载体后,细胞中MRP1基因的表达见图2~3.与A549/DDP 细胞相比,各重组载体转染组细胞中MRP1基因的mRNA 和蛋白表达水平均显著降低(P<0.05).其中转染sgRNA-MRP1-2 重组质粒的细胞沉默效果最显著,MRP1mRNA 和蛋白的表达水平分别降低了59.3%,42.4%(P<0.05).
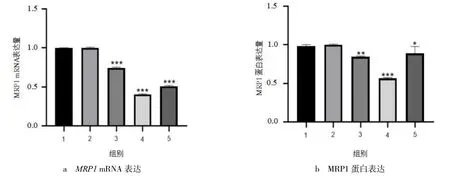
图2 各组细胞MRP1 mRNA 和蛋白表达情况
2.3 转染后细胞对药物敏感性变化的影响
顺铂对各组细胞的IC50值(见表2)显示,与A549/DDP 细胞相比,转染sgRNA-MRP1-2 组的IC50显著降低(P<0.001),无关对照组与A549/DDP 组无显著差异,表明沉默MRP1基因后细胞对川楝素的敏感性增强.

表2 各组IC50值
2.4 激光共聚焦显微镜下细胞形态
激光共聚焦显微镜下观察细胞形态(见图4).由图4 可见,未转染组与转染无关序列组,细胞均轮廓清晰,且镜下细胞数量较多,未出现明显凋亡特征.转染sgRNA-MRP1-2 组细胞部分发生破碎、边缘化,视野下细胞总数大量减少.
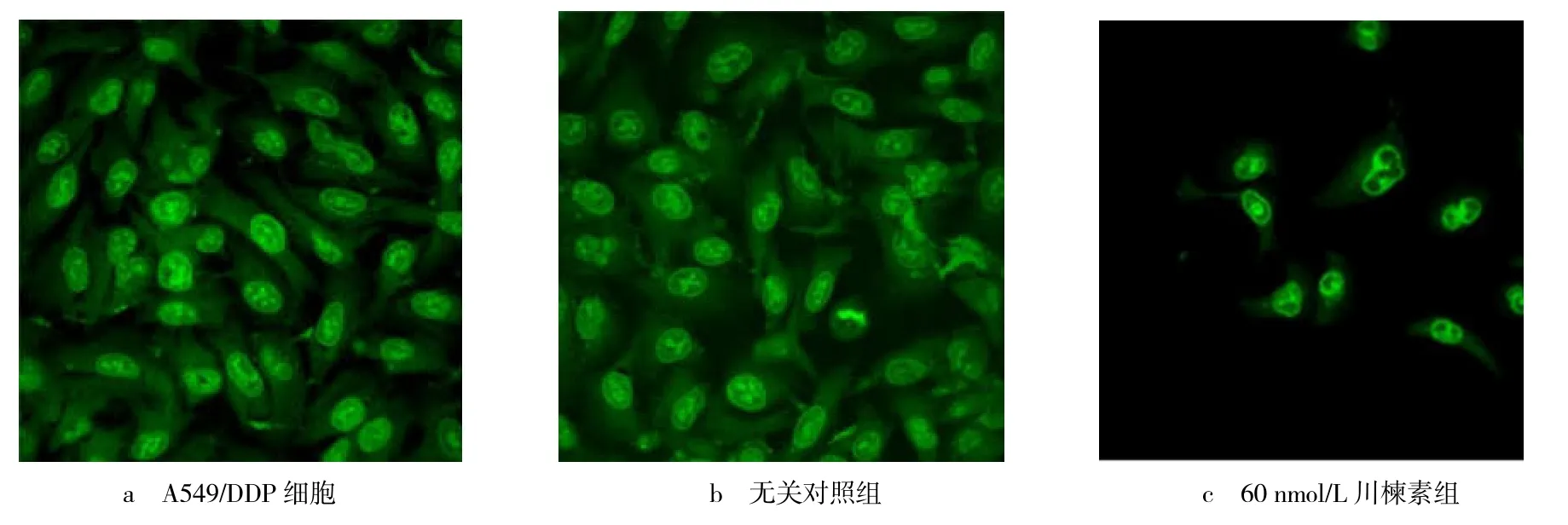
图4 TSN 处理48 h 后显微镜下细胞形态变化
3 结论与讨论
成功构建3 种靶向MRP1干扰表达载体并沉默A549/DDP 细胞中MRP1的基因表达,在60 nmol/L 的川楝素作用下,细胞凋亡程度增加,提高了细胞对川楝素的敏感性.
肿瘤的发生率和死亡率逐年上升,大多数肺癌患者发现时已是中晚期.除了早期手术之外,化疗是肿瘤治疗的重要手段,化疗效果不理想的主要原因之一是肿瘤细胞的多药耐药,肿瘤细胞的多药耐药的产生是一个非常复杂且相关因素较多的过程.导致肺癌多药耐药的因素中,P 糖蛋白(P-gp)和MRP 蛋白家族如MRP1的高表达是导致肺癌细胞产生多药耐药的重要原因之一.这些外排泵蛋白会将药物泵出细胞外,降低了细胞内的药物浓度,从而使细胞产生耐药性.如利用RNAi 技术沉默MRP1基因,逆转了肝细胞癌的多药耐药[13].因此,调节MRP1基因的表达有可能成为逆转癌症耐药并提高化疗成功率的有效策略之一[14-15].
CRISPRi 技术基于一个无核酸酶活性的dCas9 蛋白,其失去切割DNA 的活性,但仍保留结合DNA 的能力.当dCas9 被引导到某个基因的转录起始位点TSS(transcription start site)时,dCas9 能够物理性地阻碍RNA 聚合酶的通过,由此导致基因沉默,因此相较于RNAi 技术,CRISPRi 技术能抑制指定基因的转录起始,其拥有比RNAi 更高的干扰效率和更低的脱靶风险,在基因干扰能力上要优于传统RNAi 技术.
川楝素是从楝树根皮提取到的一种四环三萜类化合物[16].川楝素抗肿瘤的研究最早是由G R Pettit从楝科植物中提取的化合物对小鼠P388淋巴细胞白血病细胞系增殖的抑制作用[17].最近的研究发现,川楝素具有广谱抗肿瘤效果,能抑制多种肿瘤细胞的增殖,如肺癌A549细胞、白血病HL-60细胞和肝癌Hep3B细胞等[18-20].但其作为一种药物制剂,在作用的同时也会受到细胞耐药性的影响.本实验是在沉默MRP1基因的基础上,再加入60 nmol/L的川楝素作用于细胞,检测沉默MRP1对人肺癌A549/DDP细胞的药物敏感性和细胞形态的影响.结果与对照组相比,转染后加药组的药物敏感性显著增加,激光共聚焦显微镜下观察到细胞由梭形变为椭圆形等凋亡现象,说明干扰MRP1基因的表达,可逆转人肺癌耐药株A549/DDP细胞的耐药性,有效提升肿瘤细胞的药物敏感性.本研究结果可为川楝素在肿瘤临床治疗中研发应用提供实验依据.
