ChCl-Urea低共熔溶剂中Ni-P合金的电沉积行为研究
2022-08-11崔琳琳崔家宁张春霞战充波孙海静
崔琳琳,王 贺,崔家宁,张春霞,战充波,孙海静,周 欣,孙 杰
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
Ni-P合金具有很多优异的性能,多数作为装饰性镀层或应用于电化学领域[1]。在诸多制备Ni-P合金的方法中,化学沉积法引起许多科研工作者的关注,但化学镀存在很多缺点,如沉积速度慢、镀液需要加热、镀液不稳定等。相比于化学镀,电沉积Ni-P合金镀层具有制备简单、性能优异等许多化学镀所不具备的优点,故成为一种应用前景良好的首选保护性镀层。
低共熔溶剂是由氢键供体和氢键受体通过氢键作用而形成的一类独特的多组分溶剂体系,具有熔点低、无毒性、溶解性能好、导电性能优良、电化学窗口宽、合成简单等特点,是一种新型的绿色溶剂[2-3],其在电化学、化学反应、分离过程以及功能材料等领域的应用不断取得新的成果[4]。电沉积时,低共熔溶剂可以电沉积以水作为溶剂时不能沉积出来的金属,如铝、钛等,且没有副反应发生[5]。
目前,低共熔溶剂中非晶态Ni-P镀层的实验研究主要集中在化学镀方面,电沉积制备Ni-P镀层的研究较少。Lu Y等[6]以氯化胆碱-乙二醇离子液体为溶剂,室温下电沉积制得完全致密的球形Ni-P薄膜,利用循环伏安法和恒电流充放电试验研究了Ni-P薄膜作为锂离子电池阳极的电化学性能。You Y H等[7]采用摩尔比为1∶2的氯化胆碱-乙二醇深共熔溶剂,以NiCl2·6H2O、NaH2PO2·H2O为镍源和磷源,在室温下电沉积制得含磷量可调的Ni-P合金镀层。尤益辉[8]在摩尔比为1∶2的氯化胆碱-乙二醇深共熔溶剂中电沉积制备了Ni-P合金镀层,研究了电沉积的动力学过程、原子的形核机制,并对镀层的微观形貌、结构及耐腐蚀性能进行了分析。
本文采用摩尔比为1∶2的氯化胆碱-尿素为溶剂,电沉积制备Ni-P合金镀层,对镀层的耐腐蚀性能进行分析,并研究其电沉积机理。
1 实验方法
1.1 主要试剂
实验中使用的主要试剂有:氯化胆碱(C5H14CINO,ChCl),上海麦克林生化化工有限公司;尿素(CN2H4O,Urea)、氯化镍(NiCl2·6H2O)、次亚磷酸钠(NaH2PO2·H2O)、氯化钠(NaCl),国药集团化学试剂有限公司。所用试剂均为分析纯。
电沉积的基体为1cm×5cm×0.05cm黄铜片。
1.2 实验方法
配制镀液:将ChCl和Urea混合,加热至80℃,搅拌均匀至无色透明后,加入NiCl2·6H2O,使溶液浓度达到0.3mol/L,搅拌至得到亮绿色透明液体[9],加入NaH2PO2·H2O,使溶液浓度达到0.1mol/L,搅拌溶解至得到黄绿色液体,即得到ChCl-Urea-NiCl2-NaH2PO2镀液。
电沉积实验条件:温度70℃、沉积时间50min、沉积电压2V(SO-36V1-10A15ab稳压稳流电源控制,沈阳整流器厂)。
使用DDSJ-308A型电导率仪(上海仪电科学仪器股份有限公司)测试电导率,考察ChCl-Urea体系的导电性。
使用CHI660E型电化学工作站(上海辰华仪器有限公司)进行电化学测试,采用三电极体系,包括玻碳工作电极、银参比电极和铂辅助电极,实验前需打磨玻碳电极再使用。循环伏安测试扫描速率为50~90mV/s,计时电流测试高电位为-0.73~-0.76V(相对于银参比电极),测试温度由数显磁力搅拌器控制,均为50℃。
利用动电位极化曲线研究Ni-P镀层的耐腐蚀性能,采用三电极体系,包括镀片工作电极、甘汞参比电极和铂辅助电极。
采用日立S-3400N扫描电子显微镜(SEM/EDS)对镀层的微观形貌和元素组成进行分析。采用布鲁克 D8X射线衍射仪(XRD)对镀层的物相组成进行分析,其中靶材为Cu靶,测试电压为40kV,扫描速率为2.0°/min,扫描范围(2θ)为10~90°。
2 结果与讨论
2.1 低共熔溶剂的理化性能
分别对ChCl-Urea基础液和ChCl-Urea-NiCl2-NaH2PO2镀液进行电导率测试,在25~70℃间每隔5℃记录一次数据。两种溶液的电导率随温度的变化曲线如图1所示。

图1 ChCl-Urea基础液和ChCl-Urea-NiCl2-NaH2PO2镀液的电导率曲线
由图1可见,ChCl-Urea基础液和ChCl-Urea-NiCl2-NaH2PO2镀液的电导率均随温度升高而增大,且电导率与温度接近线性关系,该现象与文献[10]的研究结果相符。随着温度的升高,低共熔溶剂的黏度降低,离子迁移速率增加,故电导率增大[11]。两条曲线相比,ChCl-Urea-NiCl2-NaH2PO2镀液的电导率较大,说明NiCl2和NaH2PO2的加入使得溶液的电导率增大。这是由于温度升高,自由体积增大,离子进入自由体积的概率增大,电导率随之增大[2]。
ChCl-Urea基础液和ChCl-Urea-NiCl2-NaH2PO2镀液的循环伏安曲线(扫描速率50mV/s)如图2所示。

图2 ChCl-Urea基础液和ChCl-Urea-NiCl2-NaH2PO2镀液的循环伏安曲线
由图2可以看到,ChCl-Urea基础液的循环伏安曲线在负向扫描至-1.15V时,电流开始明显下降,说明溶剂在此电位下被分解[9]。在正向回扫到初始电位的过程中,从1.38V开始,电流开始升高,原因可能是ChCl中的氯离子被氧化生成氯气,导致电流升高,产生氧化峰[12]。由此可得,ChCl-Urea基础液的阴极极限电位为-1.15V,阳极极限电位为1.38V,该区间内没有明显的氧化还原峰,故其电化学窗口为2.53V。由图2中ChCl-Urea-NiCl2-NaH2PO2镀液的循环伏安曲线可以看到,当负电位扫描到-1.08V时,出现一个还原峰β,电位扫描到0.21V时出现一个氧化峰α。次亚磷酸体系电沉积Ni-P合金镀层时,在阴极上发生的还原反应为[13]
Ni2++2e→Ni
(1)
(2)

ChCl-Urea-NiCl2-NaH2PO2镀液在不同扫速下的循环伏安曲线如图3所示。

图3 ChCl-Urea-NiCl2-NaH2PO2镀液的不同扫描速率下的循环伏安曲线
由图3可知,峰电压和峰电流均与扫描速率有关。扫描速率增大,峰电压逐渐负移,峰电流逐渐增大,还原峰逐渐负移,氧化峰逐渐正移。
为进一步分析电极过程的控制步骤及可逆性,根据峰值电压Ep、峰值电流密度ip及扫描速率v等相关数据,对ip-v1/2及Ep-lnv间关系进行线性拟合,结果如图4和图5所示。
由图4可以看出,ip与v1/2呈现正比的线性关系。根据Randles-Sevci方程可知还原过程受扩散步骤控制[9]。不同电极反应的峰电压和峰电流与扫描速率的函数关系不同,可逆电极的还原峰电压Ep和还原半峰电压Ep/2均与电位扫描速率无关,不可逆电极的还原峰电压Ep与lnv呈线性关系,且Ep与Ep/2均与电位扫描速率有关;准可逆电极的可逆性与扫描速率v有关,在低扫描速率时,电极反应表现为可逆特性,在高扫描速率时,则转换为不可逆特性。由图5可以看出,Ep与lnv呈线性关系,由此可知ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P合金镀层的电极反应为不可逆反应。

图4 ChCl-Urea-NiCl2-NaH2PO2镀液的峰电流与扫描速率的拟合关系图
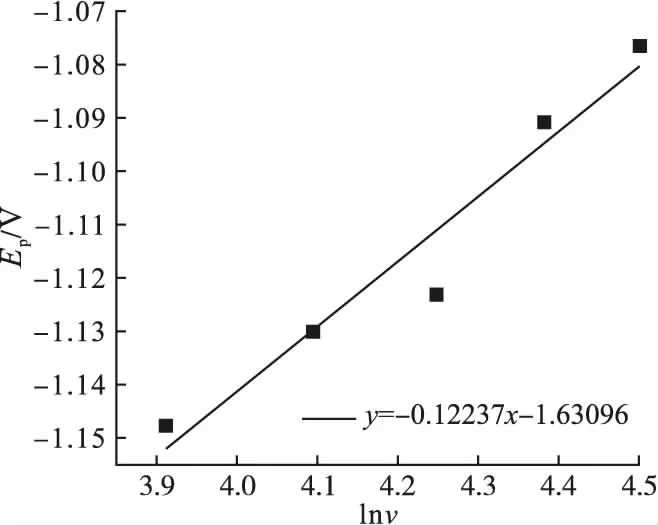
图5 ChCl-Urea-NiCl2-NaH2PO2镀液的峰电压与扫描速率的拟合关系图
2.2 Ni-P镀层的成核机理研究
为探究Ni-P合金镀层在ChCl-Urea-NiCl2-NaH2PO2镀液中的成核方式,采用计时电流法,测得计时电流曲线结果如图6所示。

图6 ChCl-Urea-NiCl2-NaH2PO2镀液的计时电流曲线图
由图6可见,随着时间的增长,电流首先增大,达到最大值。这是因为阶跃电位后,电极表面经过短暂的双电层充电,阴极电流开始增大,达到成核诱导时间时,电流达到最大。随后电流下降并趋于某一数值。
根据金属电沉积的成核理论[14],二维成核生长时,随着时间的增长,电流最终趋近于零,而三维成核生长时,随着时间的增长,曲线先升高至最大值后下降,最后趋近于某一数值。由图6所示曲线可以初步判断,ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P合金镀层的成核方式为三维成核。
为进一步探究ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P镀层的具体成核方式,对计时电流曲线进行(i/im)2-(t/tm)关系拟合,其中t为时间,i为时间t对应的电流密度,im为最大电流密度,tm为最大电流密度对应的时间。根据形核理论,三维瞬时成核时(i/im)2-(t/tm)关系为
(3)
三维连续成核时(i/im)2-(t/tm)关系为
(4)
电位从-0.73V变化到-0.76V的拟合结果如图7所示。
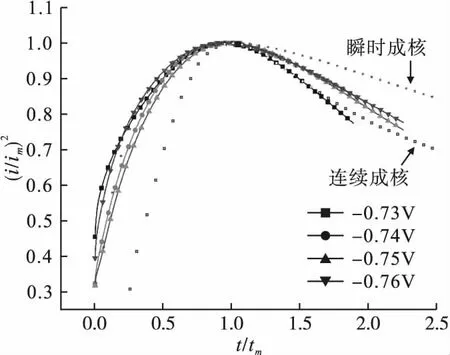
图7 ChCl-Urea-NiCl2-NaH2PO2镀液的计时电流拟合曲线
由图7可见,拟合后的(i/im)2-(t/tm)曲线更符合三维连续成核曲线,即Ni-P合金镀层在ChCl-Urea-NiCl2-NaH2PO2镀液中的成核机理符合三维连续成核。
2.3 Ni-P合金镀层的耐腐蚀性能分析
在3.5%NaCl溶液中对1.2沉积实验条件下制备的Ni-P合金镀层进行动电位极化曲线测试,结果如图8所示。极化曲线对应的腐蚀电流密度和腐蚀电位见表1所示。文中腐蚀电位为相对于饱和甘汞电极的电位。

图8 Ni-P合金镀层在3.5% NaCl溶液中的极化曲线

表1 极化曲线对应的腐蚀电流密度和腐蚀电位
由表1可见,Ni-P镀层和基体黄铜相比,腐蚀电流较小,腐蚀电位较大。由文献[15]可知,镀层腐蚀电位降低,腐蚀电流增加,镀层的耐腐蚀性能降低。故Ni-P合金镀层的耐腐蚀性能较强,对Cu基体有一定的保护作用。
2.4 Ni-P合金镀层的元素和物相组成分析
在ChCl-Urea-NiCl2-NaH2PO2镀液中,按1.2沉积实验条件制备的Ni-P合金镀层的SEM图如图9所示。
由图9可以看到,铜基体表面有明显的镀层,沉积物为银白色具有金属光泽,镀层致密,表面较为平整。

图9 ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P合金镀层的SEM图
为研究镀层的元素组成,检测得到镀层的EDS图如图10所示。
由图10可见,谱线上仅显示出Ni、Cu、Zn、P四种元素的能量峰,说明无杂质生成,实验中的Cu、Zn元素均来自黄铜基体。故可判断,电沉积所得镀层为Ni-P镀层。

图10 ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P合金镀层的EDS图
为进一步探究ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P合金镀层的物相组成,对镀层进行XRD分析,结果如图11所示。

图11 ChCl-Urea-NiCl2-NaH2PO2镀液中Ni-P合金镀层的XRD图
由图11可见,在衍射角10~20°间有一“馒头”状衍射峰,此为非晶态合金的显著特征[16],可推知电沉积得到的Ni-P合金镀层为非晶态镀层。在42.24°、49.2°、72.1°和87.24°可以看到Cu-Zn的衍射峰,分别对应晶面(111)、(200)、(220)和(311),这是由于测试时射线打到基体所致。在44.42°可以看到Ni的衍射峰,对应其(111)晶面,说明电沉积Ni-P合金镀层的过程中有晶态Ni生成。
3 结论
(1)ChCl-Urea基础液和ChCl-Urea-NiCl2-NaH2PO2镀液的电导率均随着温度的增大而增大,电导率大有利于电沉积反应;
(2)ChCl-Urea基础液的阴极极限电位为-1.15V,阳极极限电位为1.38V,电化学窗口为2.53V,电化学窗口较宽,电解质稳定性较好;
(3)循环伏安测试表明,Ni-P合金在ChCl-Urea-NiCl2-NaH2PO2镀液中可能为一步还原,电沉积的还原过程呈不可逆特性;
(4)计时电流测试表明,Ni-P合金镀层在ChCl-Urea-NiCl2-NaH2PO2镀液中的成核方式为三维连续成核;
(5)动电位极化曲线测试表明,ChCl-Urea-NiCl2-NaH2PO2镀液中制备的Ni-P合金镀层比铜基体耐腐蚀;
(6)电沉积制备的Ni-P合金镀层光亮、平滑、致密,且镀层可能为非晶结构。
