小麦 DA1基因家族成员的鉴定及其表达谱分析
2022-08-09宫盼盼宋成祥许书豪茆海亮
宫盼盼,陈 浩,宋成祥,许书豪,张 杏,茆海亮
(华中农业大学作物遗传改良国家重点实验室/华中农业大学植物科学技术学院,湖北武汉 430070)
编码泛素受体的DA1基因不仅在调节籽粒大小方面发挥着重要作用,而且在植物生长发育和逆境胁迫中也发挥着举足轻重的作用[1-4]。DA1基因家族已在多种作物中均有报道,如在油菜(Brassicanapus)中鉴定到了4个DA1基因[5],在大豆(Glycinemax)中鉴定到了11个DA1基因[3],在玉米(Zeamays)中鉴定到了6个DA1基因[6],在水稻(Oryzasativa)中鉴定到了4个DA1基因[7],在棉花(Gossypiumssp.)中鉴定到了21个DA1基因[8]。DA1基因首先在拟南芥(Arabidopsisthaliana)中被发现,当拟南芥AtDA1氨基酸序列第358位点上的精氨酸突变为赖氨酸(DA1R358K)时,种子、花、叶片、长角果等组织或器官的表型性状变化较大,另外,脱落酸(ABA)可促进AtDA1基因的表达,从而正向调节种子的大小[9]。研究发现,编码环状的E3泛素连接酶DA2可以与DA1蛋白结合,从而影响籽粒的大小,而控制水稻粒重和粒宽的E3泛素连接酶GW2与DA2蛋白同源,发挥着相似的功能和作用[10-11]。在拟南芥中有7个DA1相关基因(DA1-related,DAR),它们与DA1基因序列相似性较高,分别定点突变DA1和DAR1时,种子的大小没有发现明显的差异,但同时突变则使种子显著变大,说明二者有功能冗余[2,9];也有研究发现,DAR2基因可调节生长素的运输,且能影响根分生组织的大小[12-13],在种子发芽和叶片转绿过程中也能提高拟南芥根系对盐胁迫的耐受性[14]。
目前在小麦中已对TaDA1基因在籽粒大小方面进行了功能验证[15],但还未对DA1基因家族进行全面系统的鉴定分类和功能研究。本研究在全基因组水平上对小麦DA1基因家族进行了鉴定,并从系统进化、基因结构、启动子顺式作用元件、蛋白互作以及不同组织和逆境、ABA处理下TaDA1s的表达模式等方面进行了分析,以期为深入研究该基因家族在小麦发育过程中的功能奠定了基础。
1 材料与方法
1.1 小麦 DA1基因家族鉴定和理化性质分析
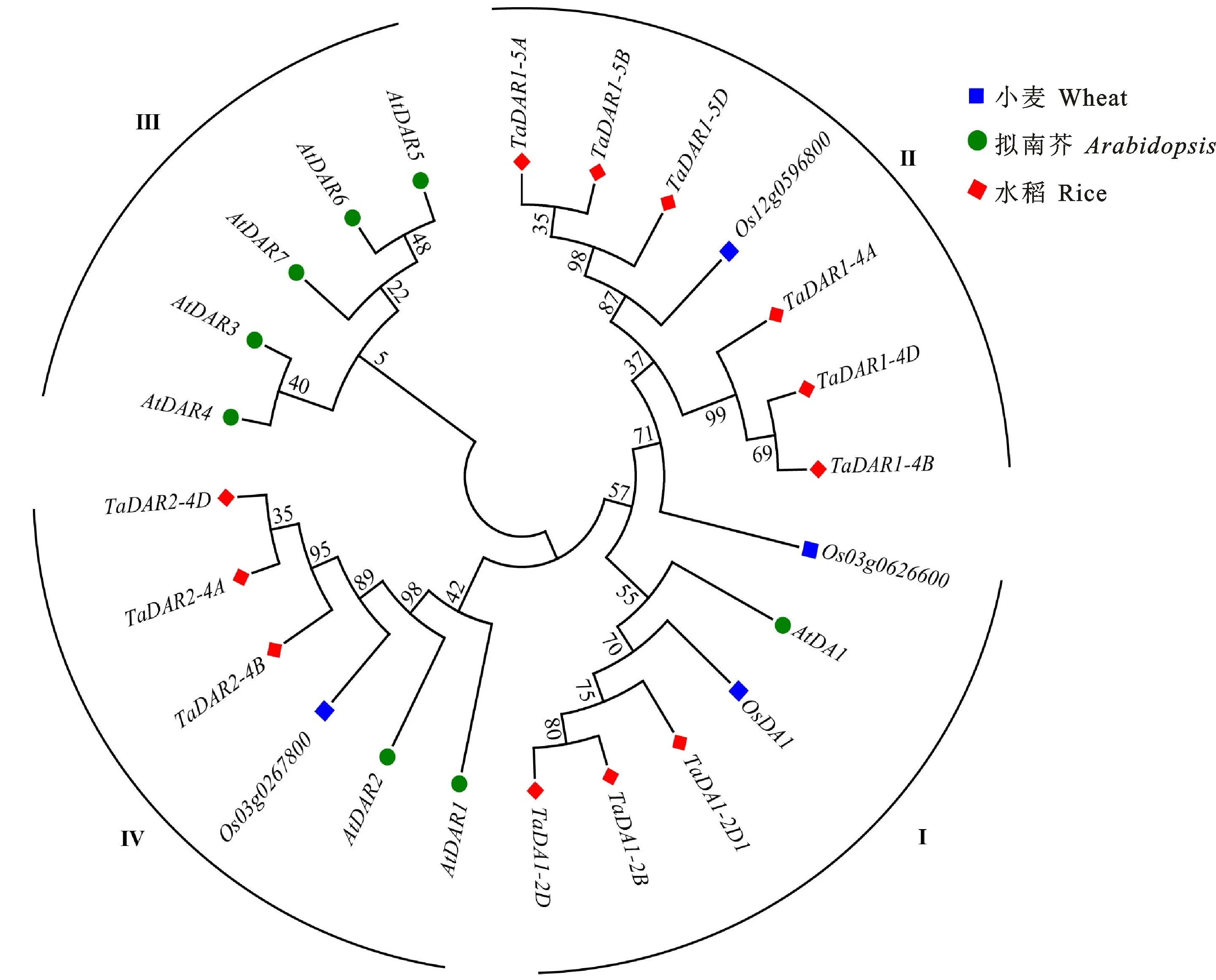
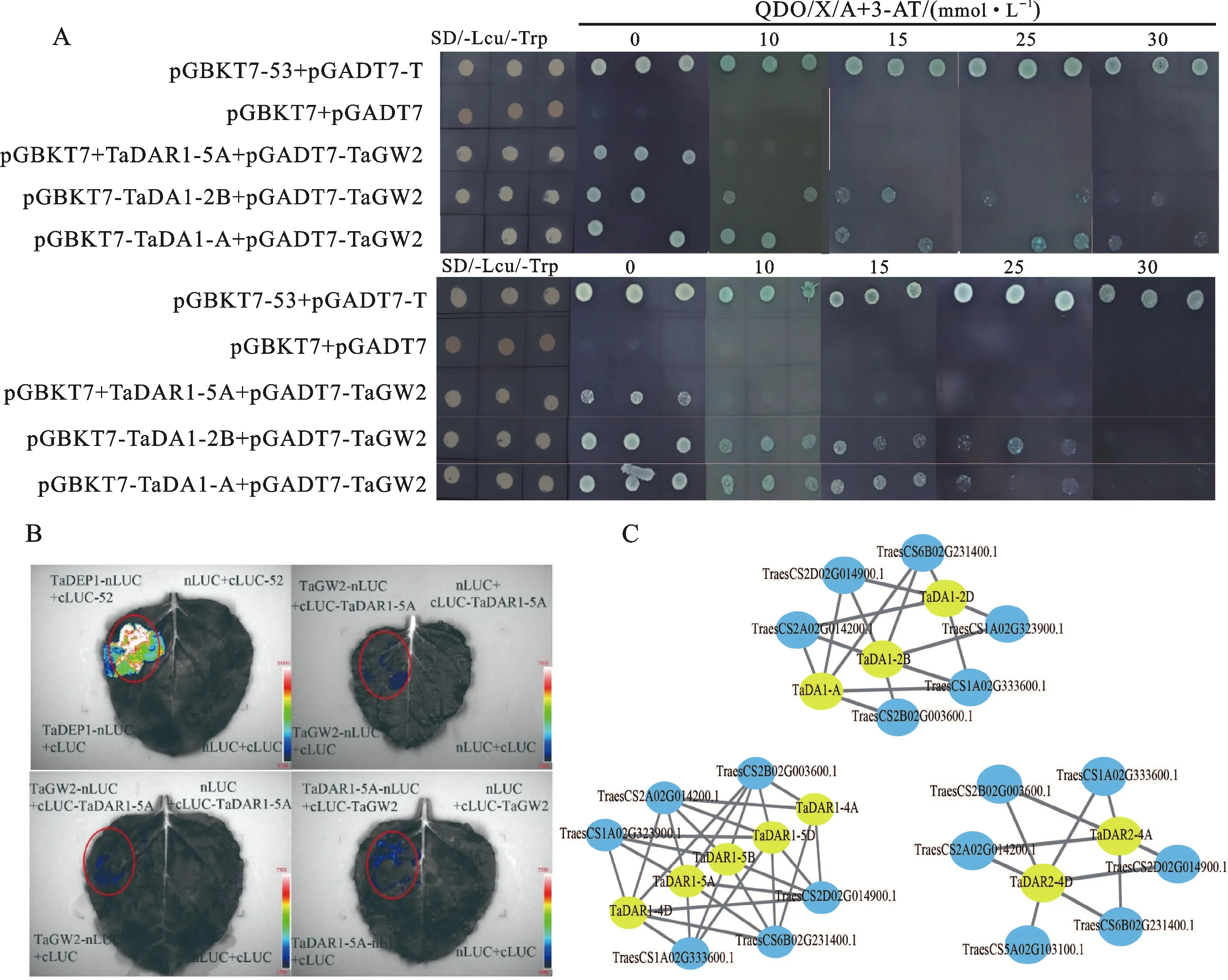
从PFAM网站(http://pfam.xfam.org/)下载DA1-like蛋白的hmm文件(Pfam号:PF12315),从Ensemble Plants数据库(http://plants.ensembl.org/Triticum_aestivum/Info/Index)下载小麦蛋白序列。用HMMER 3.0的隐马尔科夫模型(HMM)对小麦蛋白数据库进行检索,通过e值(e 用MEGA 7软件[17]对小麦、水稻和拟南芥DA1蛋白的氨基酸序列进行序列比对,采用最大似然法构建系统进化树,bootstrap值为1 000。获取小麦DA1基因在染色体上内含子、外显子和非编码区序列的位置信息,用GSDS 2.0(http://gsds.gao-lab.org/)[18]绘制基因结构图。用MEME(https://meme-suite.org/meme/)对小麦DA1基因中存在的保守motif进行预测,设置motif数量为10个,motif长度为6~50 aa。用TBtools软件[19]绘制小麦DA1基因家族的基因进化树、基因结构和motif综合图。 用STRING数据库(https://string-db.org)[20]搜索小麦DA1基因家族所有成员的互作基因,在WheatOmics(http://202.194.139.32/idConvert/)网站上进行基因ID转换,用Cytoscape软件[21]绘制蛋白互作网络图。用plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子区(基因上游1 500 bp)顺式作用元件分析,用TBtools软件对预测的结果进行可视化展示。 设计含有EcoR I和BamH I酶切位点的同源臂引物(表1),扩增小麦TaDA1-A、TaDA1-2B、TaDAR1-5A和TaGW2基因的CDS序列,分别与pGBKT7和pGADT7载体连接,构建酵母双杂重组载体。将连接在pGBKT7载体上的重组载体分别按Y2HGold转化说明书(唯地生物,上海)的操作转入酵母菌菌株Y2HGold感受态细胞中,并涂布在SD/-Trp和SD/-Trp/X-α-gal/AbA缺陷培养基上,观察菌落生长情况,进行毒性试验和自激活检测。随后将构建好的pGBKT7和pGADT7载体共转化至酵母Y2HGold感受态细胞中,点涂在SD/-Trp/-Leu、SD/-Ade/-His/-Leu/-Trp、SD/-Ade/-His/-Leu/-Trp/X-a-gal/AbA/3-AT(QDO/X/A)缺陷培养基上,确定其互作关系。 设计含有SalI和KpnI酶切位点的的同源臂引物(表1)扩增小麦TaDA1-A、TaDA1-2B、TaDAR1-5A和TaGW2基因的CDS序列,分别与771-nLUC和772-cLUC载体连接,构建LUC重组载体。将重组载体转入EHA105农杆菌感受态细胞中,收集菌液,用侵染液(0.01 mol·L-1MES + 0.01 mol·L-1MgCl2+ 1.5×10-5mol·L-1AS)调整菌液浓度OD600值为1.0,将验证的互作基因菌液按1∶1的体积比混合,利用注射器将菌液注射至烟草叶片,常温下培养1~2 d后,将荧光素酶底物注射至烟草相应位置,每个反应进行3个生物学重复,用分子成像仪(Tanon-5200)观察荧光信号。 表1 本研究所用的引物Table 1 Primers used in this study 用NCBI Blastp和HMMER两种方式对小麦全基因组进行鉴定,结果共发现12个小麦DA1基因家族成员。用SMART、Interpro和PFAM在线数据库进行结构域分析,发现12个DA1蛋白都含有DA1-like结构域。这些基因分布在2B、2D、4A、4B、4D、5A、5B和5D染色体上。序列特征分析发现,DA1基因家族编码的蛋白由220~550个氨基酸组成,分子量在24.78~62.10 kDa之间,等电点在5.68~8.60之间。亚细胞定位预测发现,所有DA1家族基因都定位在细胞核中(表2)。 表2 小麦 DA1基因家族成员特征Table 2 Characteristics of DA1 gene family members in wheat 利用小麦、拟南芥和水稻的DA1基因家族成员进行系统进化分析,结果发现,DA1基因家族成员可分为Ⅰ、Ⅱ、Ⅲ和Ⅳ四组,TaDA1s分布在Ⅰ、Ⅱ和Ⅳ组,分别包含3、6和3个DA1基因(图1)。由于拟南芥AtDAR3、AtDAR4、AtDAR5、AtDAR6和AtDAR7的序列中不存在UIM结构域,单独聚在第Ⅲ组,与小麦DA1基因家族成员亲缘关系较远。 图1 小麦、拟南芥和水稻 DA1基因家族的系统进化树Fig.1 Phylogenetic tree of DA1 gene family members in wheat,Arabidopsis and rice 根据小麦TaDA1s基因的CDS序列,分析小麦DA1基因家族成员的基因结构相关信息,发现除TaDA1-2D1基因只含有5个外显子外,其他基因均含有11~12个外显子(图2B)。用MEME在线网站对小麦DA1蛋白中的基序进行分析,发现TaDA1-2D1只包含DA1-like结构域的基序motif 2、motif 4和motif 5,而其他TaDA1s基因都包含一个LIM结构域(motif 1),一个或两个UIM结构域(motif 7、motif 6或motif 9)和DA1-like结构域(motif 2、motif 3、motif 4和motif 5),与拟南芥中AtDA1、AtDAR1和AtDAR2蛋白的肽链结构一致性较高,表明DA1基因家族成员编码的蛋白在不同物种中具有保守性(图2C)。 图2 小麦 DA1基因家族成员的进化关系(A)、基因结构(B)和motif(C)分析Fig.2 Phylogenetic tree(A),gene structure(B) and motif(C) analysis of wheat DA1 gene family member TaDA1s基因启动子区的顺式作用元件分析发现,除了含有核心功能响应元件(TATA-box、CAAT-box等)和目前未知的其他功能基序外,还含有响应逆境环境、激素以及与生长发育有关的元件,暗示这些TaDA1s的表达可能调控小麦生长发育,并受激素和干旱、低温等环境的影响(图3)。 图3 小麦 DA1基因家族成员顺式作用元件分析Fig.3 Cis-acting elements analysis of wheat DA1 gene family members 2.3.1TaDA1s在不同组织中的表达模式 根据小麦公共数据库中的转录组数据,发现除TaDA1-2D1在各个组织不表达外,其他TaDA1s在各个组织中均有所表达。取小麦中国春整个发育时期的不同组织(一叶期的根;一叶期、三叶期和五叶期的叶片和旗叶;幼穗;开花后0、5和15 d的籽粒)进行荧光定量PCR分析,发现TaDA1s在各个组织均有表达,且在根、叶片和幼穗中的表达量相对较高(表3)。进一步分析发现,TaDA1-2B和TaDA1-2D在籽粒发育过程下调表达,开花后15 d的表达量极显著低于开花后0 d的表达量;TaDAR1-5A在籽粒发育过程中上调表达,开花后15 d的表达量极显著高于开花后 0 d的表达量;TaDAR1-5B在籽粒发育过程中呈先下调后上调的表达模式,开花后15 d的相对表达量最高,显著高于开花后0 d的表达量;而TaDAR1-5D、TaDAR2-4B和TaDAR2-4A/4B/4D的表达量在籽粒发育开花后5 d最高,与开花后 0 d的表达量之间差异均达到显著或极显著水平,TaDAR2-4B在开花后15 d的表达量也极显著高于开花后0 d的表达量。暗示TaDA1s可能存在功能分化。 表3 小麦 TaDA1s在不同组织中的相对表达量Table 3 Relative expression levels of wheat TaDA1s in different tissues 2.3.2TaDA1s在激素处理和逆境胁迫条件下的表达模式 为进一步确定TaDA1s在不同激素处理下的表达模式,根据公共数据库中的转录组数据,发现细胞分裂素(CTK)、水杨酸(SA)、赤霉素(GA)和茉莉酸内酯(JA)等激素处理Fielder小麦叶片后,TaDA1s的相对表达量变化不明显,而ABA处理后TaDA1s均下调表达。进一步通过ABA处理苗期中国春小麦根部,qRT-PCR分析发现,大多数基因在ABA处理后均下调表达,与转录组数据相吻合(表4)。ABA处理3 h 后TaDA1-2B、TaDA1-2D、TaDA1-4B、TaDAR2-4B和TaDAR2-4A/4B/4D的表达量与处理0 h后的表达量之间差异达显著或极显著水平,ABA处理6 h后TaDA1-2B、TaDAR1-4B、TaDAR1-4D、TaDAR1-5A、TaDAR1-5B、TaDAR1-5D和TaDAR2-4A/4B/4D的表达量与处理0 h后的表达量之间差异达显著或极显著水平,ABA处理12 h后TaDA1-2B、TaDAR1-4A、TaDAR1-4D、TaDAR2-4B和TaDAR2-4A/4B/4D的表达量与处理0 h后的表达量之间差异达显著或极显著 水平。 根据低温[23]和盐胁迫[24]条件下TaDA1s的公共转录组数据,发现TaDA1s在低温条件下表达差异较为显著。进一步对中国春小麦苗期进行低温和盐胁迫处理(表4),发现大部分TaDA1s在低温胁迫处理后均上调表达,其中 4 ℃时TaDA1-2B、TaDAR1-4D、TaDAR2-4B和TaDAR2-4A/4B/4D的表达量与21 ℃时的表达量之间差异均达显著或极显著水平,说明TaDA1s可能参与小麦对低温胁迫的响应。对小麦苗期进行不同梯度的盐浓度处理,发现随着盐浓度的上升,大部分TaDA1s呈先上调后下调的表达模式,所有TaDA1s在0.1 mol·L-1盐浓度下表达量最高,其中TaDA1-2B、TaDA1-2D、TaDAR1-4B、TaDA1-4D和TaDAR2-4B的表达量与CK处理间差异均达显著或极显著水平;在 0.2 mol·L-1盐浓度下,TaDA1-2B、TaDAR1-5A、TaDAR1-5B、TaDAR1-5D和TaDAR2-4A/4B/4D的表达量明显下降,与CK处理间差异达显著或极显著水平。 表4 小麦 TaDA1s在逆境和ABA处理下的相对表达量Table 4 Relative expression levels of wheat TaDA1s under stress and hormone treatments Liu等[15]研究结果表明,TaDA1-A(Traes CSU02G007800)与TaGW2有互作关系。为了探索小麦DA1基因家族其他成员TaDA1-2B和TaDAR1-5A与TaGW2的互作关系,本研究使用酵母双杂交和萤火虫荧光素酶互补试验了解TaDA1-2B、TaDAR1-5A与TaGW2蛋白的互作关系,并对TaDA1-A和TaGW2蛋白的互作关系进行验证。酵母双杂交试验发现,TaGW2有较强的自激活现象[25],TaDA1-A、TaDA1-2B和TaDAR1-5A也有较强的自激活现象。将pGBKT7-TaDA1-A、pGBKT7-TaDA1-2B、pGBKT7-TaDAR1-5A重组载体与空载体pGADT7分别共转至酵母菌中,在QDO/X/A四缺培养基上能够很好地生长,且有变蓝的迹象,不同浓度的3-AT抑制剂均不能抑制pGBKT7-TaDA1-A、pGBKT7-TaDA1-2B和pGBKT7-TaDAR1-5A的自激活效应,因此不能得到TaDA1-A、TaDA1-2B、TaDAR1-5A与TaGW2互作的结果(图4A)。进一步利用萤火虫荧光素酶互补试验进行验证,发现含有TaDAR1-5A与TaGW2的载体共转的农杆菌注射烟草后有微弱的荧光信号,说明有微弱的互作效应,而含有TaDA1-A、TaDA1-2B与TaGW2的载体注射烟草后没有发现荧光信号(图4B)。 利用STRING数据库对TaDA1s编码蛋白的互作蛋白进行预测,共发现有7个互作蛋白,但不包括TaGW2。这些互作蛋白的功能主要涉及生长发育、育性调控、激素调控以及逆境响应等方面(图4C)。 A:酵母双杂交试验,QDO/X/A:含有X-α-gal和AbA的四缺培养基;3-AT:HIS3蛋白竞争性抑制剂3-氨基-1,2,4-三唑;pGBKT7-53 + pGADT7-T为试验阳性对照,pGBKT7+pGADT7为试验阴性对照。B:萤火虫荧光素酶互补试验,TaDEP1-nLUC + cLUC-52为试验阳性对照(试验数据未发表),红色圆圈内为菌液注射区域。C:TaDA1s蛋白互作网络图。 本研究利用生物信息学的方法,在小麦参考基因组上鉴定到了12个DA1家族基因(不包含未知染色体上的同源基因),这些基因结构和理化性质相对稳定,具有较高的功能保守性。小麦和拟南芥DA1基因家族成员的进化树分析结果与玉米和拟南芥DA1基因家族成员的进化树分析结果相一致[6],进一步证实单子叶植物DA1基因的进化关系更近。同时发现TaDA1-2D1基因编码的氨基酸片段较短,只含有DA1-like结构域,且在小麦生长发育的各个阶段都不表达,推测TaDA1-2D1可能为假基因。结合序列比对的结果,TaDA1-2D1蛋白序列全长与TaDA1-2D的部分序列同源性高度一致,只有两个碱基的差异,由此推测,该基因在进化过程中没有完全复制,进而造成其基因片段部分丢失[26-27]。 目前关于DA1基因控制植物器官大小的研究在多种作物中均有报道[3,5-9,15],但DA1基因在逆境方面的研究还相对较少。Zhao等[3]研究发现,过表达大豆GsoDA1基因能够提高拟南芥对盐胁迫的抗性。本研究对TaDA1s顺式作用元件分析发现,TaDA1s基因启动子区含有许多响应低温的元件,转录组和qRT-PCR结果分析也表明,低温能促进TaDA1s基因的表达,说明TaDA1s在低温环境中发挥着一定作用。本研究中TaDA1s在盐浓度为0.1 mol·L-1的处理下表达量上升,说明TaDA1s对盐胁迫环境中也发挥着一定作用。同时,TaDA1s基因对CTK、SA、GA、JA等激素没有明显响应,主要受ABA的负向调控,与拟南芥中ABA正向调控DA1基因的机制相反[9]。这为小麦DA1基因家族在逆境和激素响应方面的研究提供一定的参考价值。 TaDA1-A是位于未知染色体上的含有DA1-like结构域的基因。在本研究中,我们发现TaGW2和TaDA1-A存在转录自激活效应,通过不同3-AT浓度梯度进行筛选仍不能确定TaDA1-A与TaGW2的互作关系。而在Liu等[15]的试验中,是通过将TaDA1-A基因CDS的前297 bp片段截短进行TaDA1-A与TaGW2酵母双杂交验证工作,而本研究使用的是TaDA1-A基因CDS全长序列,这可能是造成结果不一致的原因。通过荧光素酶互补试验验证发现,TaDAR1-5A与TaGW2有微弱的互作关系,而TaDA1-A、TaDA1-2B与TaGW2在烟草中没有发现互作现象。通过数据库对TaDA1s互作基因进行搜索,共找到7个互作基因,但不包括TaGW2,该工作还需进一步研究验证。1.2 小麦 TaDA1s基因的系统进化、基因结构和保守motif分析
1.3 小麦 TaDA1s基因的顺式作用元件及其编码蛋白的互作网络分析
1.4 小麦 TaDA1s基因的表达模式分析

1.5 酵母双杂交和荧光素酶互补试验(验证蛋白互作)

2 结果与分析
2.1 小麦 DA1基因家族成员鉴定结果

2.2 小麦 TaDA1s的系统进化、基因结构和顺式作用元件分析


2.3 TaDA1s的表达模式分析


2.4 TaDA1s与 TaGW2编码的蛋白互作验证
3 讨 论
