GH/IGFs轴功能检测在矮小症儿童病因诊断中的应用及其临床意义
2022-08-09张学辉申金付
李 娟,张学辉,张 琴,牛 敏,申金付
矮小症是指儿童身高低于(同年龄、同性别、同种族)平均身高2个标准差以上或在第3百分位数以下,其发生与内分泌、遗传、环境、营养、心理、代谢、临床综合征等因素有关[1]。生理学研究[2]表明,生长激素-胰岛素样生长因子(growth hormone-insulin-like growth factors,GH/IGFs)轴对儿童的生长具有关键性的作用。新近研究[3]发现,矮小症儿童外周血胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、胰岛素样生长因子结合蛋白-3(insulin-like growth factor binding protein-3,IGFBP-3)水平低下,GH/IGFs轴功能检测可能有助于矮小症儿童的病因诊断。目前,与此相关的研究尚不多见,而且现有文献观点也不尽一致。基于此,本研究探讨GH/IGFs轴功能检测在矮小症儿童病因诊断中的应用及其临床意义,旨在为矮小症的临床诊疗与发病机制阐释等提供参考和依据。现作报道。
1 资料与方法
1.1 一般资料 2017年1月至2018年6月在我院内分泌科选取青春发育前期(按Tanner分期P1期)矮小症儿童90例,设为观察组。纳入标准:(1)符合《小儿内分泌学》关于矮小症的诊断标准[4];(2)患儿出生时的体质量和身高均正常;(3)肝肾功能无异常,无其他器官、系统疾病;(4)患儿手腕及膝关节X线片显示,骨垢线未完全闭合,患儿监护人要求治疗;(5)对本研究中拟使用的药物无过敏者。排除标准:(1)心、肝、肾等重要脏器功能不全;(2)合并其他严重的内外科疾病;(3)近3个月内参加其他临床试验项目者。另于同期在阜阳市人民医院儿童保健科按照性别、年龄与观察组相匹配的原则,选取身高正常的健康儿童50名,无内分泌代谢、遗传等疾病,设为对照组。观察组男58例,女32例;年龄4.0~14岁。对照组男32名,女18名;年龄3.5~14岁。本研究经医院伦理委员会审议批准,所有受试对象的监护人均自愿参加本研究,并签署知情同意书。观察组身高、体质量均明显低于对照组(P<0.01),身高标准差绝对值明显高于对照组(P<0.01)。2组受试对象的性别构成、年龄分布、体质量指数差异均无统计学意义(P>0.05)(见表1)。
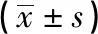
表1 2组儿童一般资料比较
1.2 方法
1.2.1 血清IGF-1、IGFBP-3测定 观察组患儿、对照组健康儿童,均于禁食一夜后、次日清晨空腹状态下采集肘静脉血4 mL,注入干燥试管中,3 000 r/min离心5min,分离血清,保存于-20 ℃冰箱中待测。采用SN-695B型智能放免γ检测仪(上海原子核研究所日环仪器厂),以免疫放射计量法(IRMA)检测血清IGF-1、IGFBP-3水平,IRMA试剂盒购自美国DSL公司,操作严格按照说明书进行。
1.2.2 GH激发试验 观察组患儿分先后2 d进行药物激发生长激素(growth hormone,GH)释放试验,采用精氨酸激发试验和胰岛素低血糖激发试验,均在清晨、空腹状态下进行。(1)精氨酸激发试验:选用25%精氨酸液,按0.5 g/kg体质量的剂量,加等量0.9%氯化钠溶液,静脉滴注,30 min内完成,精氨酸滴注前和滴注后30、60、90和120 min各抽取肘静脉血一次,分离血清,检测血清GH水平。(2)胰岛素激发试验:予人胰岛素0.1 IU/kg,加入0.9%氯化钠溶液2 mL中,2 min内静脉推注。胰岛素注射前和注射后20、30、60、90和120 min各抽取肘静脉血1次,检测血清GH水平。以两种方法测得的GH最高值为GH峰值。
1.3 病因诊断 根据2种药物激发试验的血清GH峰值,将观察组患儿分为3组:(1)GH完全缺乏(CGHD),GH峰值≤5 ng/mL 22例,男15例,女7例;(2)GH 部分缺乏(PGHD),GH峰值5~10 ng/mL 36例,男21例,女15例;(3)特发性矮小症(ISS),GH峰值≥10 ng/mL 32例,男22例,女10例。
1.4 诊断价值 将IGF-1、IGFBP-3数值低于对照组单侧95%下限者,判定为异常[5],对照组IGF-1、IGFBP-3的单侧95%下限值分别为52.8 ng/mL和3.12 μg/mL。敏感度指CGHD组中低于判定值患儿所占的百分数;特异度指非CGHD组中高于判定值患儿所占的百分数;准确度指低于判定值CGHD患儿数和高于判定值非CGHD患儿数之和占总患儿数的百分数。
1.5 统计学方法 采用方差分析、q检验和χ2检验。
2 结果
2.1 血清GH激发峰值、IGF-1和IGFBP-3水平 CGHD组、PGHD组、ISS组GH激发峰值依次升高(P<0.01)。观察组3组血清IGF-1、IGFBP-3水平均明显低于对照组水平(P<0.01);观察组血清IGF-1、IGFBP-3水平组间比较显示,均为CGHD组低于PGHD组和ISS组(P<0.01),PGHD组和ISS组差异无统计学意义(P>0.05)(见表2)。

表2 各组血清GH激发峰值、IGF-1、IGFBP-3水平比较
2.2 诊断价值 CGHD组22例中有18例患儿IGF-1水平低于判定值,22例患儿IGFBP-3水平均低于判定值;PGHD组36例IGF-1均高于判定值,13例IGFBP-3 低于判定值;ISS组32例无IGF-1低于判定值,4例IGFBP-3低于判定值。血清IGF-1检测诊断CGHD的灵敏度较高为100.00%,IGFBP-3检测诊断CGHD的特异度和准确度较高,分别为100.00%和95.56%(见表3)。

表3 血清IGF-1、IGFBP-3诊断CGHD的敏感性、特异度、准确度
3 讨论
流行病学研究[6]显示,目前全球约2%的儿童饱受矮小症的困扰,其中我国约有3 900万的矮小症儿童。除了身材矮小,矮小症儿童还可能存在不同程度的认知发育、个性、自尊心、自信心及社交能力等方面的问题[7],对患儿的身心健康和成长极为不利。早诊断早治疗可使部分矮小症儿童成年后获得较满意的身高,因此,早期病因诊断对于矮小症治疗具有重要的临床意义。
多年来,GH激发试验被作为诊断矮小症的“金标准”[8]。生理状态下,机体GH水平较低且为脉冲式分泌,昼夜波动大。测定某一个时间点的GH水平难以反映垂体的分泌功能,需行2种药物的GH激发试验进行病因诊断,一种为抑制GH的药物,一种为兴奋GH的药物,但这并也难以完全模拟GH的脉冲式分泌,因而具有较大的局限性[9]。20世纪90年代,GH促生长作用是通过IGF-1介导的机制被阐明[10],GHRH-GH-IGF-1轴在此过程中具有重要的作用。研究[11]表明,机体IGF-1和IGFBP-3无明显脉冲式分泌及昼夜节律变化,但其又主要依赖GH而变化,因此可以更好地反映机体内源性GH的分泌状态。生理状态下,腺垂体分泌的GH作用于细胞膜上的受体,通过一系列级联反应,合成、分泌IGF-1,IGF-1与IGFBPs结合运输到周围靶组织,作用于IGFR而发挥促生长作用的。一般认为,IGFBP-1、IGFBP-2、IGFBP-4、IGFBP-6抑制IGFs对骨的生长作用[12],而IGFBP-3、IGFBP-5刺激IGFs对骨的生长作用。基于此,有研究者[13]认为,通过检测血清IGF-1和IGFBP-3水平可用于GH缺乏型矮小症儿童的初筛,引入IGF-1/IGFBP-3可能有助于进一步提高检出率,进一步结合GH激发试验有助于矮小症的确诊。
本研究结果显示,矮小症患儿的血清IGF-1、IGFBP-3水平显著降低;不同类型的矮小症患儿比较,CGHD组血清IGF-1、IGFBP-3显著低于PGHD组、ISS组水平,这提示通过检测血清IGF-1、IGFBP-3可用于CGHD的初筛。进一步的研究提示,血清IGF-1、IGFBP-3检测诊断CGHD的灵敏度、特异度和准确度较高。这与类似文献[14-16]研究的结果是一致的,如JOHNSTON等[16]报道31例ISS病人血IGF-1水平低于第50百分位,其中64.5%低于第10百分位。虽然PGHD组血清IGF-1、IGFBP-3低于ISS组水平,但组间差异并无统计学意义,这提示血清IGF-1、IGFBP-3可能还难以区分PGHD、ISS,可能还需要联合其他指标进行病因诊断。但也有文献认为,GH激发峰值与IGF-1、IGFBP-3水平的相关性不够理想,如个别患儿GH激发峰值<10 ng/ml,而IGF-1、IGFBP-3 含量并不低[17];亦有GH 激发峰值>10 ng/mL的患儿,而IGF-1和IGFBP-3却降低的情况[18]。分析其原因,可能与IGF-1、IGFBP-3受较多因素影响有关[19-20],可能需要排除其他因素的干扰,还需要进一步的研究探讨。
综上所述,GH/IGFs轴功能检测在矮小症儿童病因诊断中具有较高的临床价值,血清IGF-1、IGFBP-3检测可能有助于CGHD的初筛,结合GH激发试验可能更有助于PGHD、ISS的确诊。
