福建省某规模化猪场三种病毒性疫病抗体监测和病原检测分析
2022-08-09南平市延平区农业农村局福建南平353000
骆 钰 南平市延平区农业农村局 福建南平 353000
猪繁殖与呼吸综合征(Porcine Reproductive and Respiratory Syndrome,PRRS)、 伪狂犬病(Pseudorabies,PR)和猪瘟(Classical Swine Fever,CSF)是当前我国开展“规模化猪场主要动物疫病净化示范场”和“规模化猪场主要动物疫病净化创建场”评估认证工作中必检的几种传染性病毒病, 也是规模化猪场最常见的几种主要病毒性疫病[1]。其中PRRS(俗称蓝耳病)以妊娠母猪的繁殖障碍(流产、死胎、木乃伊胎)及各种年龄猪特别是仔猪的呼吸道疾病为特征[2];PR又名狂痒病、疱疹病毒病和阿捷申氏病等,是由伪狂犬病病毒(Pseudorabies Virus,PRV)引起的多种动物共患的急性传染病[3];CSF 是由猪瘟病毒(Classical Swine Fever Virus,CSFV)引起的一种急性、热性、高度接触性、致死性传染病,是严重危害 养猪业发展的一种烈性传染病[4]。 感染PRRS、PRV、CSFV 或造成免疫抑制,对生长性能造成抑制,严重影响养殖户的经济效益, 阻碍养猪产业进一步发展并造成巨大经济损失, 甚至还会导致家畜及其产品的国际贸易受阻[2,5-6]。
因此, 做好上述几种病毒性疫病的抗体监测与病原检测分析十分必要。 为监测和评估福建省某规模化猪场猪群健康状况, 该猪场采用酶联免疫吸附试验(ELISA)分别对PRRS、PR 和CSF 进行抗体监测,同时,采用实时荧光PCR/RT-PCR 试验方法,取患猪组织进行病原检测。根据试验结果,能够对猪群疫苗免疫效果进行实时评估, 有利于进一步完善该猪场的疫苗免疫程序及疫病净化方案。
1 试验材料与方法
1.1 材料
1.1.1 血清 从该猪场随机选取保育猪10 头,分别于20 日龄、40 日龄和60 日龄时采集血清。 经调查,该猪场免疫程序见表1。
1.1.2 组织样本 检测蓝耳病、 伪狂犬病的肺脏和检测猪瘟的脾脏,均来自该猪场40~50 日龄患猪。
1.1.3 试剂盒 猪繁殖与呼吸综合征/猪蓝耳病(PRRS XR)抗体ELISA 试剂盒、猪伪狂犬病gB(PR gB) 抗体ELISA 检测试剂盒和猪瘟 (CSF) 抗体ELISA 检测试剂盒均购自BioChek BV,The Netherlands; 猪伪狂犬病抗体检测试剂盒购自IDEXX;核酸提取试剂盒、猪蓝耳病病毒通用型(PRRSV-U)核酸检测试剂盒(荧光PCR 法)、 伪狂犬病病毒通用(PRV-gH)核酸检测试剂盒(荧光PCR 法)和猪瘟病毒(CSFV)核酸检测试剂盒(荧光PCR 法)均购自广州维伯鑫股份有限公司。
1.2 方法
1.2.1 血清抗体检测 分别于该猪场保育猪20 日龄、40 日龄和60 日龄时采集血清各10 份并按200109-流水号(200109-01、200109-02......200109-30)进行编号,于3 000 r/min 离心5 min 分离血清。分离的血清样本按照编号顺序按抗体检测试剂盒说明书操作,分别检测PRRS、PR gB、PR gE 和CSF 的抗体水平并对结果进行判定。
1.2.2 核酸提取 分别取10 头40~50 日龄剖检患猪的脾脏和肺脏,分别将10 份脾脏和肺脏组织混合后磨碎, 根据广州维伯鑫股份有限公司生产的核酸提取试剂盒说明书提取核酸。
1.2.3 实时荧光PCR/RT-PCR 检测 将肺脏组织提取的核酸分别按照猪蓝耳病病毒通用型(PRRSV-U)核酸检测试剂盒(荧光PCR 法)和伪狂犬病病毒通用 (PRV-gH) 核酸检测试剂盒 (荧光PCR 法)说明书操作进行检测,观察各标准曲线和Ct 值进行判定;将脾脏组织提取的核酸按照猪瘟病毒(CSFV)核酸检测试剂盒(荧光PCR 法)说明书操作进行检测,观察各标准曲线和Ct 值进行判定。
2 结果与分析
2.1 血清抗体检测结果 30 份血清PRRS、PR gE、PR gB 和CSF 抗体检测结果见表2、图1。 该猪场的PRRS 抗体阳性率从20 日龄的50.00%升高到60 日龄的100%,然而该猪场未免疫过PRRS 疫苗,表明该猪场存在PRRS 野毒感染的可能性。 由于PR gE抗体检测试剂盒检测的抗体均为野毒感染的抗体,由于该猪场随机选择的10 头保育猪20~60 日龄均未检测出PR gE 抗体, 表明该猪场不存在PR 感染的风险。 PR gB 抗体检测试剂盒检测的抗体均为疫苗免疫抗体, 该猪场随机选择的10 头保育猪20 日龄、40 日龄和60 日龄PR gB 抗体分别为100.00%、100.00%和0.00%, 表明该猪场PR gB 抗体在40~60 日龄时急剧降低。 CSF 抗体由60.00%上升至100.00%。经了解,该猪场于适当日龄免疫过CSF 疫苗, 抗体监测结果显示该疫病的整体抗体阳性率较高,说明该猪场的CSF 疫苗免疫能够对生猪提供保护,疫苗免疫效果较好。
由PRRS、PR gE、PR gB 和CSF 抗体检测水平折线图表明,随着日龄增长,PRRS 和CSF 抗体呈上升趋势,PR gE 抗体一直保持在阴性水平,而PR gB抗体在40 日龄后有明显下降趋势。 该结果与PRRS、PR gE、PR gB 和CSF 抗体检测阳性率趋势一致。
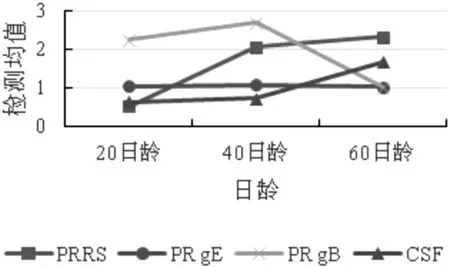
图1 PRRS、PR gE、PR gB 和CSF 抗体检测水平
2.2 PRRSV、PRV 和CSFV 实时荧光PCR/RTPCR 检测 将肺脏组织提取的核酸分别按照猪蓝耳病病毒通用型(PRRSV-U)核酸检测试剂盒(荧光PCR 法)和伪狂犬病病毒通用(PRV-gH)核酸检测试剂盒(荧光PCR 法)检测,结果见图2-图3。 由图2 可知,阳性对照的Ct 值≤35,且曲线为明显的指数增长曲线,阴性对照无Ct 值,二者均成立判定试验成立; 肺脏组织提取的核酸检测PRRSV Ct 值=26.4,且曲线有明显的指数增长曲线,表明该样品为PRRSV 阳性。 由图3 可知,阳性对照的Ct 值≤35,且曲线有明显的指数增长曲线, 阴性对照无Ct 值,二者均成立判定试验成立; 肺脏组织提取的核酸检测PRV 无Ct 值,表明该样品为PRV 阴性。

表1 猪场3 种病毒性疫病免疫程序
表2 PRRS、PR gE、PR gB 和CSF 抗体检测情况
该猪场通过免疫接种,PR gE 抗体未被测出,已在该猪场很好地控制了PR,目前感染风险较低。 说明目前在养猪领域主要采用的PRV gE 基因缺失活疫苗仍对本场具有较好的保护力[7]。
将脾脏组织提取的核酸按照猪瘟病毒(CSFV)核酸检测试剂盒(荧光PCR 法)说明书操作进行检测,结果见图4。 阳性对照的Ct 值≤35,且曲线有明显的指数增长曲线,阴性对照无Ct 值,二者均成立判定试验成立, 脾脏组织提取的核酸检测CSFV 无Ct 值,表明该样品为PRV 阴性。

图2 PRRSV 实时荧光RT-PCR 检测结果
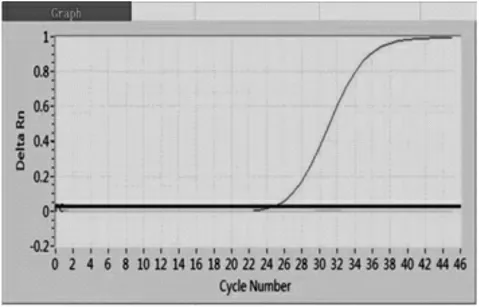
图3 PRV 实时荧光PCR 检测结果
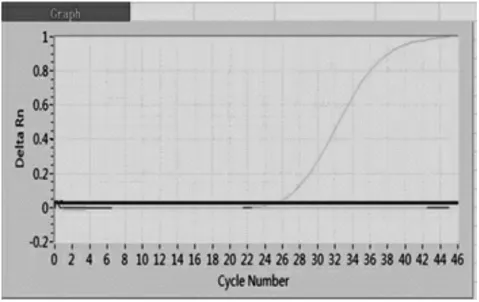
图4 CSFV 实时荧光PCR 检测结果
综 上 所 述,PRRSV、PRV 和CSFV 实 时 荧 光PCR/RT-PCR 检测结果表明,被检样本有PRRSV 野毒感染情况,而无PRV 和CSFV 感染情况。
3 讨 论
本试验采用ELISA 和实时荧光PCR/RT-PCR方法对猪场猪群健康状态开展检测分析, 通过检测分析充分掌握了该猪场PRRS、PR 和CSF 免疫抗体水平和野毒感染情况。 结果表明:该猪场PR 和CSF免疫抗体水平较高,阳性率高,说明疫苗免疫效果较好,建议该猪场今后继续加强疫苗免疫;但PR 免疫抗体水平监测表明,猪群于60 日龄时,抗体水平急剧下降,阳性率为0%,因此,有必要调整猪场的免疫程序, 于40~60 日龄时提早PR 疫苗加强免疫;PRRS 的野毒感染抗体检测结果显示, 该猪场存在PRRSV 野毒感染的风险,经实时荧光PCR/RT-PCR检测结果表明, 该猪场存在PRRSV 野毒感染的情况[8]。
PRRSV 是一种单股正链RNA 病毒, 其开放阅读框下GP5 蛋白是PRRSV 中最容易发生变异的蛋白质之一[9]。 因PRRSV 变异迅速,同时能造成猪场免疫抑制, 使得目前对于PRRS 的防控依旧较为困难。 高致病性毒株减毒活疫苗的无序使用造成减毒活疫苗病毒的大量传播, 使得PRRS 仍然是严重危害中国养猪业的重要疫病之一。据杨汉春等[10]报道,国内PRRS 抗体总阳性率为64.61%,各地区抗体平均阳性率介于20%~100%,2021 年PRRS 减毒活疫苗的使用量下降,VR-2332 活疫苗的使用量有所增长。
该猪场未选用市面上常见的PRRS 疫苗对猪群进行免疫,是出于一种疫病净化的策略。现阶段因猪场非洲猪瘟防控力度较大, 规模化猪场均搭建了系统性的生物安全防控体系。该体系的建立,不仅能够对非洲猪瘟进行防控, 对多种传染性疾病也有很好的防控效果。 由于该场目前PRRSV 感染情况较为严重,需要尽快开展PRRS 净化工作,包括淘汰阳性猪只、做好猪舍消毒、采用批次化养殖手段、切断病毒在猪舍间的间接传播途径,引进PRRS 阴性猪,对后备猪群进行替换, 定期使用检测手段检测抗原抗体水平,坚持对多项传染性疾病长期监测,以求达到CSF、PR 等疫病免疫净化及PRRS 非免疫净化的效果。
