EGFR突变的晚期非小细胞肺癌患者接受一代TKI靶向治疗的效果及预后预测因子分析
2022-08-08洪雅萍黄韵坚黄漳州陈胜佳钟巧凤曾洪福庄武
洪雅萍,黄韵坚,黄漳州,陈胜佳,钟巧凤,曾洪福,庄武
福建医科大学附属肿瘤医院,福建省肿瘤医院胸部肿瘤内科,福建 福州 350014
表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)治疗已成为EGFR突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的一线标准治疗[1],大部分携带EGFR敏感突变的NSCLC患者可以从EGFR-TKI治疗中获益,然而仍有10%~30%的EGFR敏感突变的NSCLC患者在接受TKI靶向治疗时出现原发性耐药[2]。因此,研究EGFR-TKI的临床疗效,寻找其预后预测因子对于携带EGFR敏感突变的晚期NSCLC患者的治疗具有重要的指导意义。本研究旨在分析接受一线埃克替尼靶向治疗患者的生存数据,并探索其预后预测因子。
1 资料和方法
1.1 临床资料
筛选2016年01月—2017年11月福建省肿瘤医院胸部肿瘤内科收治的258例既往未经过系统治疗的ⅢB~Ⅳ期NSCLC患者的EGFR表达状态,采用突变扩增系统(amplification refractory mutation system,ARMS)检测肿瘤组织样本,采用微滴式数字聚合酶链反应(micro-drop digital polymerase chain reaction,ddPCR)检测配对的外周血循环肿瘤DNA(circulating tumor DNA,ctDNA)的EGFR表达状态,共检测到EGFR阳性患者121例,121例患者中有86例患者外周血检测EGFR表达状态为阳性,3例患者因早期失访,不纳入本研究。
1.2 治疗方法
118例患者均接受埃克替尼单药靶向治疗作为一线治疗方案,埃克替尼125 mg口服,每天3次,空腹或与食物同服。如出现不能耐受的腹泻或皮肤不良反应时,可通过短期暂停治疗(最多14 d)解决,随后恢复125 mg每天3次的剂量。首次给药后按实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1每2个月进行1次复查评价,直至出现客观疾病进展(progressive disease,PD)、死亡或其他原因服药中断(包括不可耐受的不良反应或失访)。治疗过程中,若患者出现肿瘤症状明显加重,按照临床需要提前复查。患者PD后仍继续每3个月对患者的情况进行随访,获取患者后线治疗及生存情况。
1.3 统计学处理
以无进展生存期(progression-free survival,PFS)为主要研究终点,以总生存期(overall survival,OS)、客观缓解率(objective response rate,ORR)及疾病控制率(disease control rate,DCR)为次要研究终点。PFS定义为从开始接受埃克替尼靶向治疗开始至PD、死亡(任何原因)或末次随访的时间间隔;OS定义为从开始接受埃克替尼靶向治疗直至死亡(任何原因)或末次随访的时间间隔;ORR定义为经确认的完全缓解(complete remission,CR)或部分缓解(partial remission,PR)受试者比例;DCR定义为经确认的CR、PR或疾病稳定(stable disease,SD)的受试者所占比例。采用χ2检验比较EGFR19DEL、L858R及少见突变3组患者临床病理学特征及最佳疗效之间的差别。采用Kaplan-Meier生存曲线分析患者的PFS和OS,应用log-rank检验分析各种临床病理学特征(分类型变量)与PFS和OS的相关性,应用COX回归模型分析各种临床病理学特征(连续型变量)与PFS和OS的相关性。应用COX回归模型进行多因素分析。其中因本研究纳入单因素分析的变量较多,而导致目前达到结局事件的个数不足,为避免COX回归模型超载,进行COX回归分析时先采用后退法,再次对单因素分析时P<0.1的变量构建筛选,最终分别纳入8和7个变量构建模型分别进行PFS和OS的多因素分析。所有数据应用SPSS 25.0软件进行分析,所有检验均为双侧。P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床特征
本研究最终共纳入118例患者,均至少接受1个周期的埃克替尼靶向治疗,最长者已接受埃克替尼靶向治疗66.8个月。随访时间为1.0~68.8个月,中位随访时间25.8个月。其中男性45例,女性73例。年龄26~83岁,中位年龄60岁,其中61例年龄≥60岁,占51.7%,57例<60岁,占48.3%。吸烟者17例,占14.4%,不吸烟者101例,占85.6%;腺癌99例,非腺癌19例。ⅢB~ⅢC期6例,ⅣA期42例,ⅣB期70例。术后复发14例,非术后复发104例。肺内为最常见的转移部位,占51.7%,其次为骨转移,占42.4%,脑转移,占40.7%。组织EGFR19DEL突变为55例(46.6%),L858R突变为49例(41.5%),G719X突变为3例(2.5%),L861Q突变为2例(1.7%),复合突变(复合突变包括ALK、ROS1及19DEL和L858R共突变)为9例(7.4%),本研究将EGFRG719X、L861Q及复合突变计入少见突变类型。世界卫生组织(World Health Organization,WHO)体力状态评分0~2级。依据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版分期标准进行分期(表1)。

表1 患者的临床病理学特征Tab.1 Clinicopathological characteristics of patients
2.2 患者的临床疗效
118例患者中,最佳疗效:0例CR,74例(62.7%)PR,35例(29.7%)SD,9例(7.6%)PD。ORR为62.7%(95% CI:0.539~0.716),DCR为92.4%(95% CI:0.875~0.972)。截至末次随访时间,118例患者中,92例PD,中位PFS为11.3个月(95% CI:9.075~13.525个月),66例死亡,中位OS为32.0个月(95% CI:26.9~37.1个月)。
2.3 不同EGFR类型的临床病理学特征的差异
3组EGFR表达类型(EGFR19DEL,L858R和少见突变类型)患者的临床病理学类型特征差异无统计学意义(P>0.05),但3组患者的最佳疗效差异有统计学意义(P=0.040,表2)。

表2 不同EGFR类型临床病理学特征及疗效的比较Tab.2 Clinicopathological characteristics and efficacy of different types of EGFR mutations
2.4 患者临床病理学特征与PFS的相关性
单因素分析显示,术后复发、原发肿瘤病灶T分期、胸腔积液、骨转移、癌性淋巴管炎、最佳疗效、基线LDH表达水平、原发病灶长径、靶病灶长径及靶病灶面积与患者的PFS具有相关性。其中组织EGFR类型在纳入少见突变类型进行分析时差异无统计学意义,在剔除少见突变类型,仅纳入EGFR19DEL和L858R两组进行分析时,与患者的PFS具有相关性(表3、4)。19DEL突变组的中位PFS为11.5个月(95%CI:9.7~13.3个月),优于L858突变组的8.6个月(95% CI:6.4~10.7个月),差异有统计学意义(P=0.027)。基线LDH表达正常组的中位PFS为11.4个月(95% CI:8.4~14.3个月),优于升高组的4.9个月(95% CI:3.7~6.0个月),差异有统计学意义(P=0.000)。然而外周血EGFR阳性组的中位PFS为11.4个月(95% CI:9.3~13.5个月),阴性组为10.2个月(95% CI:7.2~13.2个月),差异无统计学意义(P=0.407,图1)。

表4 连续变量单因素COX分析Tab.4 Univariate COX analysis of continuous variables
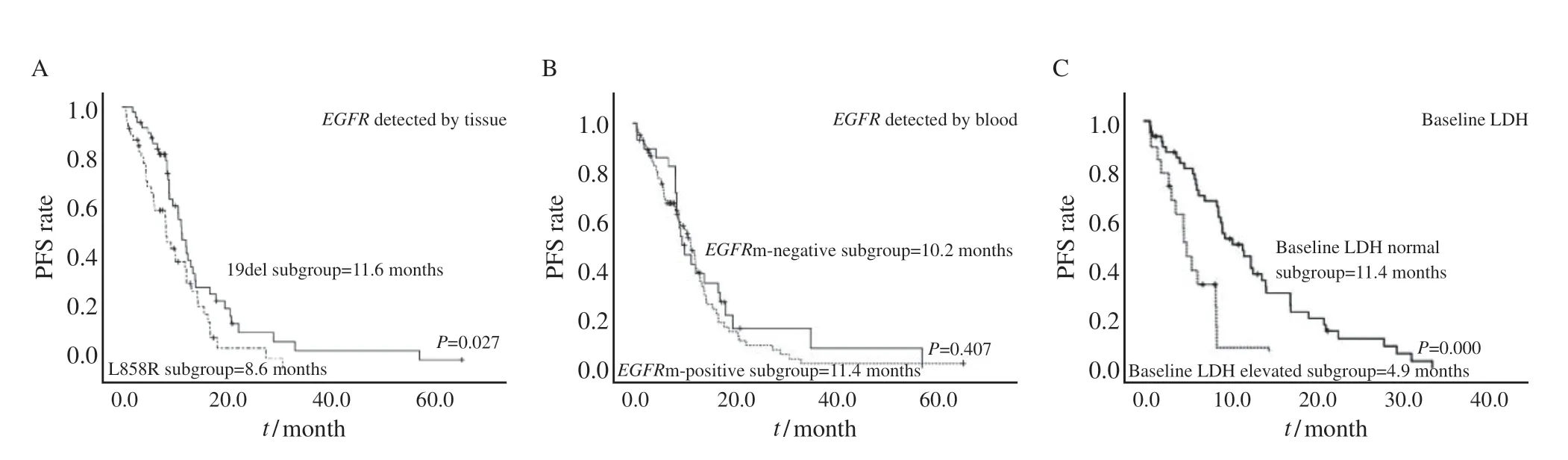
图1 不同变量分组患者的PFS生存曲线图Fig.1 PFS survival curves of patients in different variable groups
多因素分析显示,基线LDH表达水平、EGFR类型、胸腔积液及最佳疗效可能为PFS的独立预测因子(表5)。

表5 多因素分析EGFR突变晚期NSCLC患者临床病理学特征与PFS的相关性Tab.5 Multifactorial analysis of the correlation between clinicopathological characteristics and PFS in advanced NSCLC patients with EGFR mutation
2.5 患者的临床病理学特征与OS的相关性
单因素分析显示,T分期、N分期、骨转移、EGFR表达类型、最佳疗效、基线LDH表达水平、是否出现T790M突变、原发病灶长径及PFS与患者的OS具有相关性。组织EGFR19DEL组的中位OS为35.1个月(95% CI:30.1~40.1个月),优于L858R组的23.3个月(95% CI:13.5~33.1个月),差异有统计学意义(P=0.015,图2)。无骨转移组的中位OS为35.1个月(95% CI:29.6~40.6个月),优于有骨转移组的13.7个月(95% CI:2.8~22.5个月),差异有统计学意义(P=0.020,图2)。而外周血EGFR阳性组的中位OS为35.1个月(95% CI:27.7~42.5个月),阴性组为29.4个月(95% CI:24.8~33.9个月),差异无统计学意义(P=0.574,图2)。
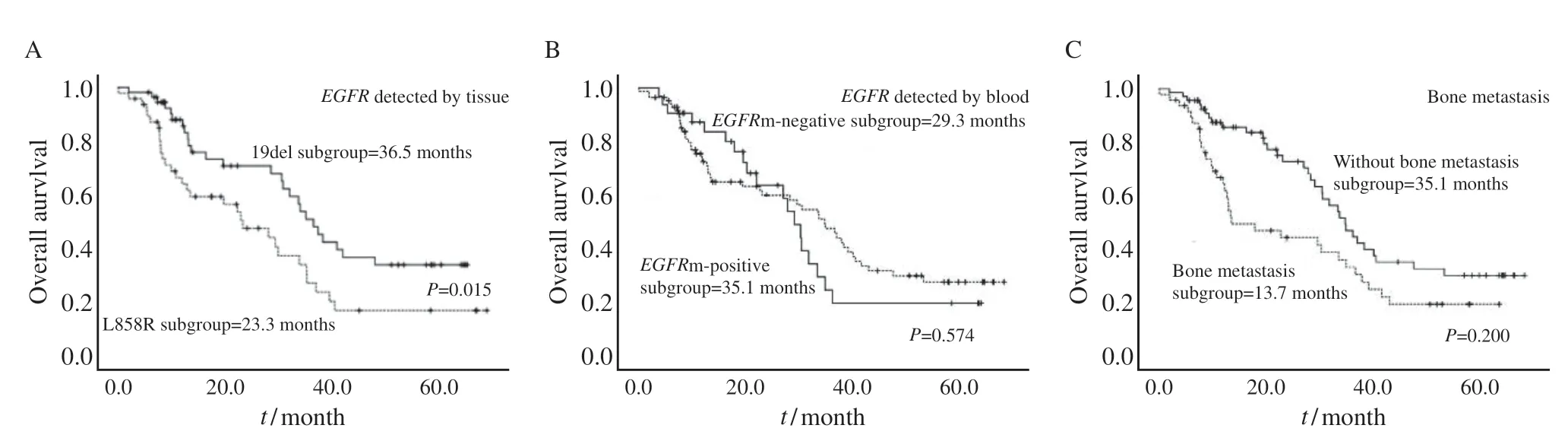
图2 不同变量分组患者的OS生存曲线图Fig.2 OS survival curves of patients in different variable groups
多因素分析显示,患者的N分期、骨转移、PFS时间及出现EGFRT790M突变可能为OS的独立预测因子(表6)。
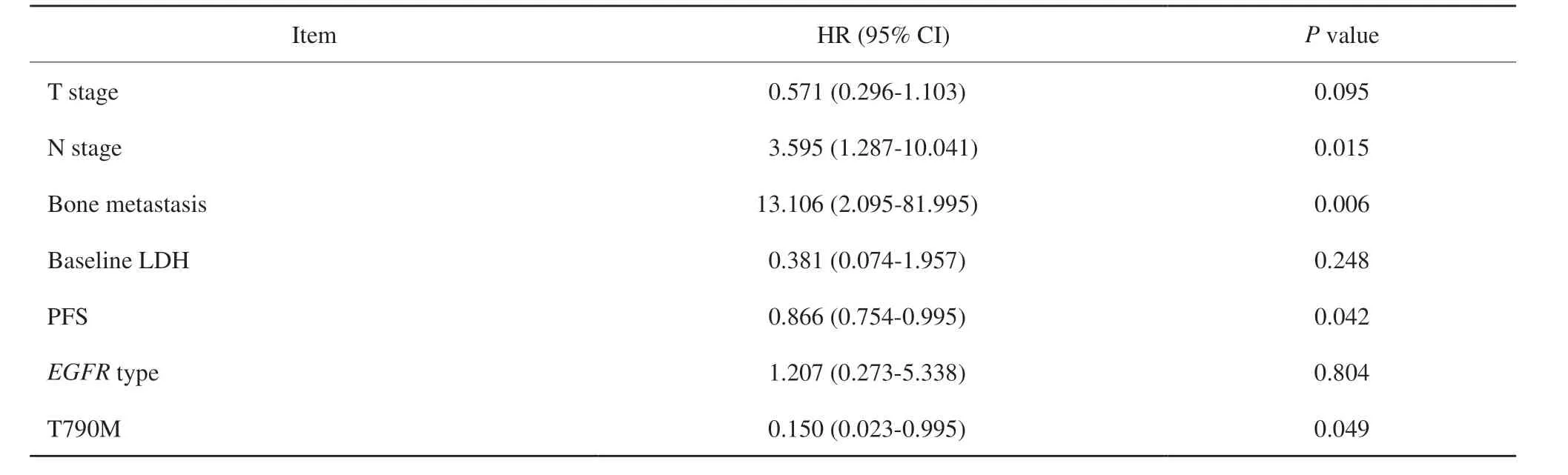
表6 多因素分析EGFR突变晚期NSCLC患者临床病理学特征与OS的相关性Tab.6 Multifactorial analysis of the correlation between clinicopathological characteristics and OS in advanced NSCLC patients with EGFR mutation
3 讨论
目前,肺癌是全世界仅次于乳腺癌的第二大恶性肿瘤,具有极高的患病率和致死率,其中NSCLC是肺癌的主要类型,占80%~85%,超过65%的NSCLC在确诊时已为晚期[3-4]。中国患者中EGFR突变率为35%~40%,女性不吸烟腺癌中突变率更是高达50%。EGFR-TKI治疗在携带EGFR敏感突变的晚期NSCLC患者中显示出较好的反应率,与化疗相比可显著改善PFS和ORR,是携带EGFR敏感突变的晚期NSCLC患者的一线标准治疗方案[5],然而仍有一部分患者存在原发性耐药,目前仍缺乏有效的手段可筛选出原发性耐药的患者[2]。因此,对接受EGFR-TKI靶向治疗的晚期NSCLC患者的临床疗效和生存预后进行分析,并寻找EGFR-TKI的预后预测因子对于携带EGFR敏感突变的NSCLC患者的治疗具有重要的指导意义。
既往研究[6-8]显示,一代EGFR-TKI的应答率为50%~80%,中位PFS为8~12个月,中位OS为19~35个月。IPASS研究[7]是第一个在晚期NSCLC患者中头对头比较一线化疗与EGFR-TKI临床疗效的研究,选择EGFR-TKI优势人群(女性、不吸烟或少吸烟的腺癌患者),结果显示,吉非替尼治疗组的中位PFS为9.8个月,中位OS为18.8个月。CONVINCE研究[8]共纳入296例EGFR突变阳性的晚期NSCLC腺癌患者,按1∶1随机分组接受埃克替尼或培美曲塞联合顺铂化疗,结果显示,接受埃克替尼治疗组的中位PFS为11.2个月,中位OS为30.5个月。本研究中患者一线接受埃克替尼治疗的ORR为62.7%,DCR为92.4%,中位PFS为11.3个月,中位OS为32.0个月,与既往的临床研究结果相似。目前国内真实世界研究报道中,接受EGFR-TKI治疗的效果分析有很多,但大多集中于ORR、DCR和PFS,而少有对OS数据进行研究。本研究对OS数据的研究报道,丰富了中国患者一线接受EGFR-TKI靶向治疗的生存数据,有利于与患者的交流及靶向药物的选择。
已有回顾性研究[9-10]显示,外周血ctDNA中的EGFR突变情况对接受EGFR-TKI治疗反应具有预测价值。O’Kane等[9]对72例存在组织EGFR突变的Ⅳ期NSCLC患者抽血检测外周血ctDNA中的EGFR突变情况,其中53例患者外周血检测出EGFR阳性,外周血EGFR阴性和阳性患者的中位PFS分别为10.0和2.1个月(HR=2.22,95%CI:0.89~5.54,P=0.08),提示外周血EGFR阳性可能与接受EGFR-TKI治疗中较短的PFS相关。FLAURA研究[10]发现,与外周血EGFR阳性患者相比,外周血EGFR阴性与延长PFS相关,研究者推测这可能与外周血EGFR阴性患者的肿瘤负荷较低有关。Tran等[11]对GEMINI数据库中的1971例晚期NSCLC患者的2224份血液样本进行ctDNA二代测序,27%患者至少检测出1种突变,其中73%为EGFR突变,进一步分析显示,接受一线EGFR-TKI治疗的患者外周血EGFR阳性和阴性患者的PFS分别为352和379 d,差异无统计学意义(P=0.41)。本研究中,外周血EGFR阳性组的中位PFS为11.4个月,阴性组为10.2个月,差异无统计学意义(P=0.407),EGFR阳性组的中位OS为35.1个月,阴性组为29.4个月,差异也无统计学意义(P=0.574)。因此,外周血EGFR阳性可否作为EGFR-TKI靶向治疗的疗效预测因子需要进一步的前瞻性大样本研究进行验证。
本研究按照AJCC第8版肺癌分期对患者重新进行TNM分期,并进一步分析T分期、N分期及M分期与患者PFS和OS的相关性。单因素分析显示,T分期与患者PFS具有相关性,但多因素分析T分期与PFS的相关性未获得阳性结果。而无论单因素或多因素分析均显示,T分期、N分期与患者的OS具有相关性,可以作为患者OS的独立预测因子,这或许是因为T分期、N分期提示的是肿瘤负荷大小,反映的是肺癌本身的临床预后特征,而不是肺癌对TKI的应答程度。本研究中T4期患者的中位OS优于T2、T3期患者,或许与肺内为肺癌最常见转移部位有关,本研究中50.4%患者存在肺内转移,T4期患者多因为肺内转移而诊断为T4期,而非肿瘤原发病灶大于7 cm或侵犯周围重要脏器而诊断T4期。
EGFR突变包含常见突变和少见突变,其中常见突变包含EGFR19DEL和L858R突变,两者分别占44.8%和39.8%。法国的一项研究[12]纳入17664例患者,共1837例EGFR突变患者,其中19DEL和L858突变分别为931例(51%)和702例(38%),其对应的中位PFS分别为12.9和10.1个月(P<0.001),中位OS分别为22.6和16.2个月(P<0.001)。IPASS研究[7]中接受吉非替尼靶向治疗的19DEL和L858R突变组的中位PFS分别11.0和9.2个月。LUX-lung3研究[13]的亚组分析显示,接受阿法替尼治疗的EGFR突变NSCLC患者中,19DEL突变患者的PFS和OS与化疗组相比显著延长,在L858突变患者中显示出延长的趋势,但差异无统计学意义。本研究中L858R和19DEL组的中位PFS分别为8.6和11.5个月,中位OS分别为23.3和35.1个月,与上述结果相似,但在纳入少见突变的EGFR类型分类变量中差异无统计学意义,考虑与少见突变、复合物突变类型有关。
多项研究[14-15]显示,与其他治疗相比,EGFR-TKI治疗可以提高骨转移患者的临床疗效。但关于骨转移是否为EGFR-TKI的疗效预测因子的相关研究较少。2021年的一项研究[16]纳入604例EGFR突变的晚期NSCLC患者,与无骨转移组相比,骨转移组的临床预后更差(中位PFS分别为11.7和14.0个月,P=0.0013;中位OS分别为32.8和46.1个月,P<0.001)。本研究结果亦显示,骨转移是EGFR突变晚期NSCLC接受埃克替尼一线治疗的生存预后的独立预测因子。目前骨转移对于肺癌预后的负性影响的原因仍不明确,有研究推测或许与骨转移患者的肿瘤负荷突变多有关,但仍有待进一步研究证实。
本研究存在一些不足之处:纳入的样本量较小,随访时间不足,一些亚组分析尚未获得中位OS,地域相对受限。
综上所述,真实世界中EGFR突变的晚期NSCLC患者接受一线埃克替尼靶向治疗同样具有良好的疗效,丰富了真实世界的生存数据,有利于与患者交流及靶向药物的选择。外周血EGFR突变情况与患者的临床疗效不具有相关性。骨转移与接受TKI靶向治疗患者的不良预后具有相关性。
利益冲突声明:所有作者均声明不存在利益冲突。
