一大型规模猪场附红细胞体和溶血性葡萄球菌混合感染的诊治
2022-08-06赵以恒崔颢月罗健雅黄紫贝陈诗涵刘金彪王海燕刘文博
赵以恒,崔颢月,郭 鑫,罗健雅,黄紫贝,陈诗涵,刘金彪,王海燕,刘文博,4
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009;3.江苏农牧科技职业学院,江苏泰州 225300;4.扬州大学动物疾病检测与技术服务中心,江苏扬州 225009)
猪附红细胞体病(eperythrozoonosis)是由猪附红细胞体(Eperythrozoon suis)引起的一种以贫血、黄疸、发热为特征的人兽共患病,1932 年被美国首次报道[1]。猪附红细胞体病发生后往往会大面积流行,严重时会造成大批仔猪死亡,商品猪生产性能下降,导致严重经济损失。研究证实:造成猪附红细胞体传播的主要因素是对猪进行手术时造成的肠胃道暴露以及群内争斗撕咬[2];附红细胞体还可以垂直传播[3]。溶血性葡萄球菌是一种球形的革兰氏阳性菌,无鞭毛和荚膜,不产生芽孢,在血平板上具有溶血性[3],可引起皮肤化脓性炎症,也可引起败血症、菌血症以及内脏器官的严重损伤[4]。生猪养殖过程中多种病原混合感染情况十分常见[5],如仔猪巴氏杆菌与大肠杆菌的混合感染[6]、猪附红细胞体与猪细小病毒的混合感染[7]、猪链球菌与多杀性巴氏杆菌的混合感染[8]等。混合感染病例的临床症状及病理变化复杂,难以确诊,无法及时采取针对性防控措施,对养殖业发展和疫病防控带来了不小的挑战。目前,猪附红细胞体与溶血性葡萄球菌混合感染病例尚未见报道。本研究对一大型猪场发生的附猪红细胞体和溶血性葡萄球菌混合感染疫情的诊治进行系统梳理,以期为类似猪病的诊疗提供参考。
1 疫情概况
2020 年8 月底开始,江苏省某大型猪4 个场区5 个栏舍的仔猪,在断尾阉割后2~3 d 出现精神沉郁、眼睛睁不开、后肢无力、触碰尖叫、皮肤脱皮等症状,随后出现急性死亡;死后鼻镜、阴户、腹部发紫,全身黄染。每批次(20 个栏舍)约有2个栏舍出现这种急性死亡。发病后使用“易速达”(头孢噻呋注射液)进行全群治疗,同时使用阿莫西林粉剂兑水供仔猪饮用,发病严重栏位注射“易速达”,后再次注射阿莫西林注射液,但效果并不明显。各场区猪群批次、发病栏舍及死亡仔猪数如表1 所示。
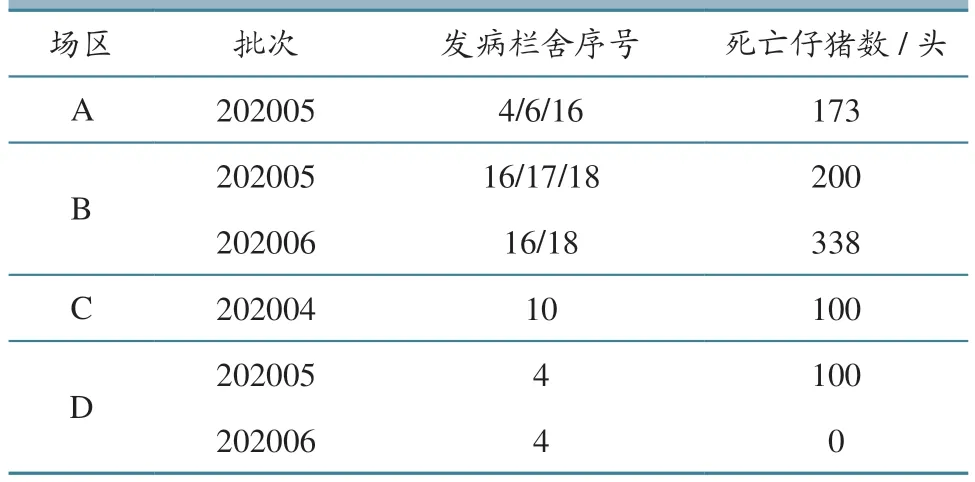
表1 各场区仔猪死亡情况
为确诊病因,2020 年9 月8 日,采集发病仔猪口、鼻、肛门拭子及内脏组织样品送第三方实验室,通过荧光定量PCR 方法进行相关病毒检测,包括猪瘟病毒(CSFV)、非洲猪瘟病毒(ASFV)、猪流行性腹泻病毒(PEDV)、猪流感病毒(SIV)、猪繁殖与呼吸综合征病毒(PRRSV)等,结果均为阴性,检出新型猪圆环病毒(PCV3),分离出副伤寒沙门氏菌、马链球菌。
继而采集A 场区有临床症状仔猪的心脏、肝脏、肾脏、脾脏、肺脏,以及结肠(包括结肠系膜)、回肠、大脑、小脑、脑干、肠系膜淋巴结、腹股沟淋巴结、扁桃体、胸段脊髓、腰段脊髓、大腿肌肉等进行病理组织学检测,结果见小肠绒毛轻微萎缩,其中一个肝脏呈局灶性坏死及炎症。仅根据病理组织学检测无法做出明确诊断。
通过与一线工作人员交流了解到,发病都是在断尾和阉割之后短时间内发生,因而推测可能是伤口感染或者疼痛激发应激并继发感染引起的。对临床样本通过测序检测出不同的细菌,但由于不是细菌分离后的全基因测序,很难通过高通量测序结果确定具体病因。但因检测出沙门氏菌片段,怀疑是沙门氏菌引起的全身性败血症,且其中一个肝脏呈局灶性炎症和坏死,这也符合副伤寒沙门氏菌感染产生的病变。虽然PCR 检测出PCV3,但在组织中未见到有心肌炎和血管炎等符合PCV3 感染的病变,所以也不确定是由PCV3 导致的死亡。与外籍顾问交流后,排除了上述病因,怀疑为马链球菌感染所致,于是采取了初步处理措施(表2),但未见明显效果。发病及死亡情况见图1。

表2 初步处理措施
2 剖检和临床检查
2020 年10 月底,对该场送检的4 头病死猪进行剖检发现,病死猪皮肤黏膜出现大量紫斑、黄染(图2-A),淋巴结肿大、出血(图2-B),脾脏梗死(图2-C),肺脏严重充血、淤血(图2-D),肺门淋巴结呈索状(图2-E),心冠脂肪黄染(图2-F),肝脏、心脏、脾脏等内脏器官均发生出血、淤血等。
3 实验室检测
3.1 主要材料
3.1.1 主要试剂 血琼脂培养基、绵羊血平板,均购自杭州微生物试剂有限公司;琼脂粉、氯化钠,均购自国药集团化学试剂有限公司;PCR 试验所需引物,购自上海生工生物工程有限公司;Diff-Quik 染色液,购自南京建成科技有限公司;TIANamp Genomic DNA Kit 试剂盒,购自天根生化科技(北京)有限公司;16S rDNA Bacterial Identification PCR Kit 试剂盒,购自宝生物工程(大连)有限公司。
3.1.2 主要仪器 SW-CJ-IL 超净工作台,苏州净化工作台设备有限公司产品;PCR 仪,美国应用生物系统公司产品;电热恒温鼓风干燥箱、GNP9080 电热恒温生化培养箱,上海精宏实验设备有限公司产品;DYCP-31DN 凝胶电泳仪,北京六一生物科技有限公司产品;凝胶成像系统,美国Bio-Rad 公司产品;分光光度仪,德国 Eppendorf公司产品;CX21FS1C 奥林巴斯CX 系列生物显微镜,奥林巴斯(广州)工业有限公司产品;酶标仪(微孔板检测系统),美国 Bio Tek 公司产品。
3.2 检测方法
3.2.1 心血涂片染色镜检 无菌采集患病仔猪心血,按常规方法制作血涂片,Diff-Quik 染色后观察。具体步骤:将血涂片静置等待自然风干;将干燥后的血涂片浸入固定液a,10~15 s,用吸水纸吸去多余溶液;将涂片浸入染液1,染色10 s,用吸水纸吸去多余染液;将涂片浸入染液2,染色5 s,用吸水纸吸去多余染液;将涂片浸入流动蒸馏水中,清洗10~15 次,洗去多余染液,将玻片垂直竖立,使其自然风干;染色后的血涂片完全干燥后,放入显微镜下观察并拍照。
3.2.2 脏器触片染色镜检 采集病死猪的肝脏、脾脏制作触片,染色后观察。Diff-Quik 染色镜检步骤同3.2.1。
3.2.3 细菌分离培养 将采集的病死仔猪心脏、肝脏、脾脏、肺脏、肾脏和淋巴结等病料进行编号后,严格按照无菌操作要求划线接种于血琼脂平板上,倒置于厌氧培养罐中,37 ℃条件下在恒温箱中培养24 h,查看菌株生长情况及菌落形态特征,挑取优势单个菌落继续传代,在血琼脂平板中进行纯培养,用于种类鉴定。
3.2.4 病原鉴定 将采集的心血样本及传代得到的病原菌,按照TIANamp Genomic DNA Kit 试剂盒说明书步骤提取基因组DNA。按照宝生物工程(大连)有限公司所提供的16S rDNA Bacterial Identification PCR Kit 的方法进行PCR 扩增。将扩增得到的16S rRNA 基因片段,经1%琼脂糖凝胶电泳鉴定。用于序列扩增的反应体系:模板DNA 50~100 ng,PCR预混剂25.0μL,上游引物0.5μL,下游引物0.5μL,用16S-free H2O 补至50.0 μL;阳性对照取1.0 μL 的Positive Control DNA 作为模板。扩增条件:94 ℃预变性5 min;94 ℃变性1 min,50~55 ℃退火1 min,72 ℃延伸1.5 min,30 个循环;最后72 ℃延伸5 min。将获得的阳性样本PCR 扩增产物使用切胶回收试剂盒(Code No.9762)回收后,送至南京金斯瑞生物科技公司进行DNA 测序(上游引物:5'-GAGCGGATAACAATTTCACACAGG-3';下游引物:5'-CGCCAGGGTTTTCCCAGTCACGAC-3')。将所测DNA 序列与GenBank 中的已知序列进行同源性比较,以判定检测细菌种类。
3.2.5 猪附红细胞体PCR 检测 参照标准DB31/T 600—2012 中的PCR 检测方法,对样品进行附红细胞体核酸检测,使用KingFisher™ Flex 全自动核酸提取仪及爱森磁珠法总核酸提取试剂盒,提取送检样品DNA 后进行PCR 扩增。
4 结果
4.1 心血涂片染色镜检
病猪1:可见多数红细胞发生变形,呈星芒状、锯齿状、菜花状等,部分红细胞破裂溶解(图3-A)。
病猪2:与病猪1 相比更加严重,可见红细胞几乎全部溶解破裂,严重变形,失去其原有双凹形状,边缘不整齐,呈刺球状、锯齿状等不规则形状;红细胞表面附有大量形状不规则的蓝紫色颗粒,经鉴定为附红细胞体(图3-B)。
4.2 脏器触片染色镜检
病猪2 脾脏触片(图4-A)与肝脏触片(图4-B)Diff-Quik 染色后镜检结果显示:视野中可见大量球形与圆形蓝紫色的细菌,无荚膜,无鞭毛。
4.3 分离培养与形态观察
在37 ℃条件下厌氧培养24 h 后,脑、肝脏、淋巴结中均分离到细菌,血平板出现表面隆起、湿润光滑的淡黄或柠檬黄葡萄串状圆形小菌落,在血琼脂培养基上呈β 溶血(图5-A)。挑取优势单个菌落至血琼脂培养基,继续传代厌氧培养,仍可见大量光滑、湿润的淡黄色葡萄串状溶血性菌落(图5-B)。
4.4 细菌16S rRNA 基因序列鉴定
将分离纯化细菌PCR 扩增得到的16S rRNA测序结果在NCBI 里进行BLAST 分析。结果显示,本试验病料中分离细菌的16S rRNA 扩增产物核苷酸序列与GenBank 中公布的溶血葡萄球菌同源性约为99.9%,证明该分离菌为溶血葡萄球菌,GenBank 登录号为MZ778798。
4.5 猪附红细胞体PCR 检测
参照标准DB31/T 600—2012[9]中 的PCR 检测方法,对样品进行附红细胞体核酸检测,使用KingFisher™ Flex 全自动核酸提取仪及爱森磁珠法总核酸提取试剂盒提取送检样品DNA,结果如图6 所示,阴阳性对照成立,送检样品出现396 bp 特征条带,判为阳性。将测序结果与NCBI 数据库进行比对,确认送检血样中的致病菌为猪附红细胞体。
5 治疗和防控
该猪场在疫情未被确诊时,全群仔猪断尾阉割时肌注“倍扶欣”;发病后,发病单元全群肌注“易速达”,同时使用阿莫西林粉剂兑水,但效果不明显。更换阿莫西林注射液后,效果也不明显;更换磺胺、青霉素治疗,仔猪酸化剂饮水,效果仍不明显。在确诊为猪附红细胞体及溶血性葡萄球菌混合感染后,选择针对附红细胞体和葡萄球菌的强力霉素或磺胺六甲氧拌料,猪群注射“血虫净”,进行全群给药治疗,并建议猪场采取加强消毒,及时隔离并淘汰病猪死猪等措施。在采取措施5 d 后,从养殖企业得到反馈,病情得到有效控制,并计划用金霉素对下一批次仔猪进行保健,断尾阉割时再注射土霉素。
6 讨论
近年来,我国养猪业发展越来越迅速。集约化养殖方式极大提高了生产效率,但环境和群体中病原体的大量存在易造成混合感染,导致疫病暴发。一旦发病,疾病的诊断就显得尤为重要。而常规措施的效果常不理想,因此在确诊前应严格遵守传染病防控原则,切断传播途径,并且尽快找出传染源,对症下药。此次江苏省某猪场疫病暴发,通过病毒学和细菌学检测未能得到及时有效的诊断,而血液涂片染色镜检法对血液性疾病的诊断起到了重要作用[10],由此可见,经典检测方法在动物疫病防控中仍然有着很大作用。猪场长期在饲料中添加抗生素或发病时滥用广谱抗生素等使得病原菌产生了耐药性[11]。在临床病例治疗中,应根据病原细菌鉴定结果进行药敏试验,再根据药敏试验结果给药,采取联合用药或交替使用敏感药物,以达到理想的治疗效果。
该次疫情的诊断为类似混合感染的诊疗提供了很好的借鉴,以下几个方面的诊疗总结,可参考应用于动物疫病防控中。
(1)病猪隔离与淘汰。猪群中出现发病个体时,要及时对同猪群进行隔离,对病死仔猪尸体必须进行深埋或焚烧等无害化处理,对未发病猪体表喷洒1%敌百虫液或其他杀虫剂,及时杀灭蚊虫等节肢动物传播媒介[12-13]。
(2)加强场舍消毒。消灭散播在外界环境中的病原体意义重大。平时应加强消毒,每周1~2 次,选用广谱类消毒药[14],有发病个体的猪舍应使用2%氢氧化钠进行严格消毒。同时,在每次引种进入棚舍之前,都需要进行全面彻底的清扫消毒,对于消毒死角,可用清水冲洗后再喷洒2%氢氧化钠。在场舍条件允许的情况下,应在场内实施熏蒸消毒,充分杀灭环境中的病原微生物。
(3)减少病原传播途径。养殖场应严格采用全进全出的饲养方式,防止不同日龄、不同批次猪群发生交叉感染[11]。同时采用封闭式管理,防止猪群接触到病原体。
(4)加强饲养管理,提高个体抵抗力。相关工作人员上岗前进行严格培训,打耳号、采样等操作过程中应尽量避免出血情况[15]。饲喂时选择全价配方饲料,同时对饲料进行定期检查,防止因环境潮湿等造成饲料发霉;定期消毒猪舍提供的饮水,及时清除场舍内的粪便与垃圾。场舍应保持良好通风,注意气温变化。最后,控制好猪群饲养密度,有效防止疫病扩散。
