磁性松塔/松针基活性炭的制备及对Pb2+吸附性能研究
2022-08-05袁帅赵雪松王丽李奇
袁帅,赵雪松,王丽,李奇
(1.内蒙古农业大学 材料科学与艺术设计学院,内蒙古 呼和浩特 010018;2.内蒙古自治区沙生灌木资源纤维化和能源化开发利用重点实验室,内蒙古 呼和浩特 010018;3.内蒙古农业大学 机电工程学院,内蒙古 呼和浩特 010018)
活性炭是最早应用于污水净化的吸附材料,在废水处理领域中是应用最为广泛的吸附剂[1-2]。松塔和松针是良好的可再生资源,其来源广泛、成本低廉,由于其本身结构,且本身含有比较丰富的氮氧元素,经化学改性后可制备成为高性能活性炭[3]。面对当今资源匮乏的现状,对废弃的松塔和松针进行合理利用和再开发,具有现实意义。以松塔和松针为原料,经交联和赋磁后制备为高吸附性能的活性炭未有报道。因此本文通过高温炭化制得该活性炭,研究制备条件和吸附条件对其吸附Pb2+性能的影响,通过多种表征手段分析其吸附机理。
1 实验部分
1.1 试剂与仪器
松塔、松针均采自内蒙古农业大学校园;氢氧化钾、1-烯丙基-3-甲基咪唑氯盐、二甲酚橙、邻非罗啉、六次甲基四胺、硝酸铅、盐酸、硝酸、戊二醛、无水FeCl3均为分析纯。
WK-800A型多功能粉碎机;DZF-6020型电热恒温鼓风干燥箱;SHA-C型水浴恒温振荡器;H2050R型离心机;TU-1901型双光束紫外-可见分光光度计;6701F型扫描电子显微镜;Tensor 27 Fourier 红外光谱仪;Bruke2000型X射线衍射仪。
1.2 活性炭的制备
以松塔和松针为原料,经多次水洗后去除尘土,干燥粉碎并筛分成80~100目粉料。将一定质量比的松塔和松针混合粉料与固体KOH按一定质量比放入三口烧瓶中加蒸馏水浸泡,加水量以浸没固体为宜,再加入一定量戊二醛和无水FeCl3,烧瓶置于60 ℃的恒温水浴锅中,使用机械搅拌器搅拌12 h。最后通过漏斗过滤,用蒸馏水多次洗涤至中性后干燥,研成粉末后置于坩埚内放入马弗炉中,抽出马弗炉内空气后充入氮气,以5 ℃/min的升温速率从室温升温至300 ℃,活化一定时间后以5 ℃/min的升温速率升至一定温度进行炭化,炭化一定时间后冷却至室温,取出样品研磨后放入干燥器备用。
1.3 吸附实验
移取50 mL一定浓度的Pb2+溶液至100 mL锥形瓶中,用适量的NaOH和HCl调节溶液pH值,加入一定质量的吸附剂并放入恒温水浴振荡器中,振荡一定时间后将溶液转移至离心管中,以6 000 r/min 的速度离心10 min;移取5 mL离心后的上清液至50 mL容量瓶中,加入已配制好的六次甲基四胺缓冲液1.5 mL、二甲酚橙溶液1.0 mL和邻菲罗啉溶液4.0 mL,最后用蒸馏水定容。静置15 min 后用紫外分光光度计测量Pb2+溶液的吸光度。通过改变吸附条件确定最大吸附量,吸附量根据公式(1)计算。
Qe=(ρ0-ρe)v1/m1
(1)
式中Qe——炭材料的吸附量,mg/g;
ρ0——Pb2+溶液的初始浓度,mg/L;
ρe——吸附后溶液中剩余Pb2+的浓度,mg/L;
v1——Pb2+溶液的体积,L;
m1——炭材料的质量,g。
2 结果与讨论
2.1 制备条件对MACp吸附Pb2+性能影响
2.1.1 FeCl3加入量 FeCl3赋磁具体反应式见式(2)~式(7)[4]:

(2)

(3)
(4)

(5)

(6)

(7)
由上述公式和图1可知,FeCl3可以在高温下生成Fe3O4和γ-Fe2O3,使MACp产生一定的磁性[5]。但是添加的FeCl3会降低MACp中炭材料的质量,生成磁性物质会消耗大量的C,使微孔结构产生崩塌,同时FeCl3和炭化后生成的Fe3O4会堵塞或者破坏原有的孔洞,吸附量有所下降。因此,选择FeCl3的加入量为1 g。
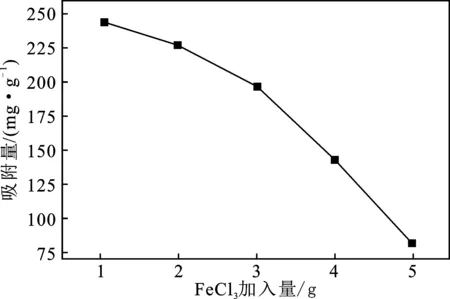
图1 FeCl3加入量对MACp吸附Pb2+性能的影响Fig.1 Effect of add the amount of FeCl3 on adsorption capacity of Pb2+ by MACp
2.1.2 炭化温度 炭化温度对MACp吸附Pb2+吸附量的影响见图2。
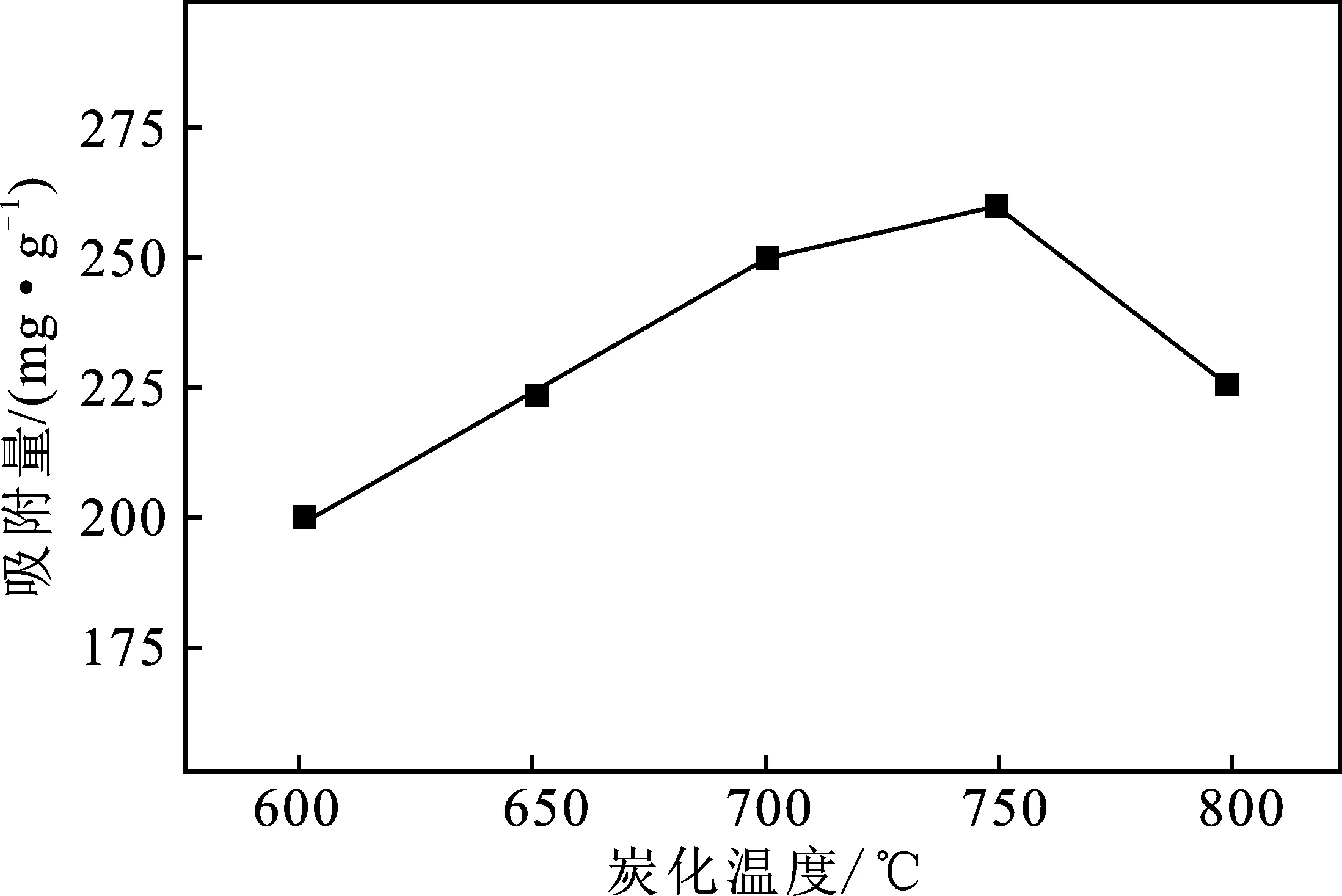
图2 炭化温度对MACp吸附Pb2+吸附量的影响Fig.2 Effect of carbonization temperature on adsorption capacity of Pb2+ by MACp
由图2可知,当炭化温度为750 ℃时,MACp对Pb2+吸附量最高,为259.36 mg/g。铁的氧化物的存在形态主要有4种,其中具有磁性的只有Fe3O4和γ-Fe2O3,在炭化温度较低时Fe3+会初步热解成不同无定型铁的氧化物,当炭化温度达到500 ℃时无定型铁的氧化物转变成Fe2O3;随着温度的进一步升高至700 ℃后,Fe2O3会被炭化过程中产生的还原性气体如CO和材料中的C还原成Fe3O4;但是当炭化温度达到800 ℃以上,Fe3O4会随着温度的提高而转化为Fe3C和Fe,使磁性大幅降低[6]。所以选择最佳炭化温度为750 ℃。
2.1.3 炭化时间 炭化时间对MACp吸附Pb2+吸附量的影响见图3。

图3 炭化时间对MACp吸附Pb2+吸附量的影响Fig.3 Effect of carbonization time on adsorption capacity of Pb2+ by MACp
由图3可知,当炭化时间为120 min时吸附量最大,为259.36 mg/g。吸附量先增大是因为活化时间过短原料还未被完全炭化,FeCl3未能完全转化为磁性物质;炭化时间超过120 min后,MACp的吸附性能下降,这是因为Fe3O4在高温下不太稳定,一小部分Fe3O4还原,材料的磁性降低;同时KOH对炭材料的孔道结构刻蚀时间过长,导致原有的孔壁腐蚀、坍塌[7],使吸附性能下降。因此,选择120 min为最佳炭化时间。
2.2 吸附条件对MACp吸附Pb2+性能影响
2.2.1 Pb2+溶液初始浓度 由图4可知,当Pb2+溶液浓度较低时,Pb2+数量相对较少,不足以填满活性炭上的吸附点位,吸附量较低;随着浓度继续升高,Pb2+数量增加可以为克服液相和固相传质阻力提供重要动力[8],从而使吸附量逐渐增加;当吸附位点被占据饱和时,MACp的吸附趋于平衡。因此,选择300 mg/L的Pb2+溶液为最佳初始浓度。

图4 Pb2+初始浓度对MACp吸附Pb2+吸附量影响Fig.4 Effect of initial concentration of Pb2+ on adsorption capacity of Pb2+ by MACp
2.2.2 吸附温度 吸附温度变化时,MACp吸附Pb2+吸附量的变化趋势见图5。
由图5可知,在温度逐渐升高时,由于布朗运动较为剧烈,MACp与Pb2+之间的接触几率增加,固-液分子间的斥力减小,同时MACp吸附Pb2+是吸热反应,升高温度促进了吸附反应的进行;但是温度升高会降低MACp的磁性[9],同时已吸附的Pb2+由于热运动的加剧而脱附。综合考虑,选择50 ℃为最佳吸附温度,此时吸附量最大,为270.18 mg/g。
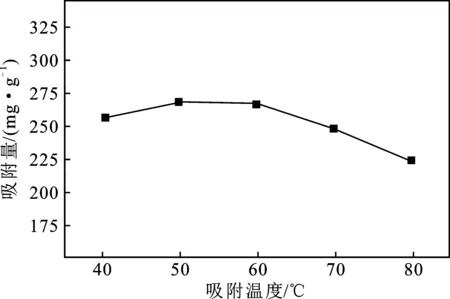
图5 吸附温度对MACp吸附Pb2+吸附量的影响Fig.5 Effect of adsorption temperature on adsorption capacity of Pb2+ by MACp
2.2.3 溶液pH值 溶液pH值变化时,MACp吸附Pb2+吸附量的变化趋势见图6。

图6 溶液pH值对MACp吸附Pb2+吸附量的影响Fig.6 Effect of pH value of solution on adsorption capacity of Pb2+ by MACp
由图6可知,在低pH值条件下,活性炭的酸性官能团无法解离,如羧基主要以—COOH存在,且溶液中含量较多的H3O+和H+会与溶液中的Pb2+争夺吸附位点[10],使MACp上的吸附位点减少;随着pH值的升高,酸性官能团会被去质子化,MACp对Pb2+的吸引力增加,从而提高了吸附量;但继续增大pH值,会增加溶液中的OH-,容易使Pb2+沉淀,影响MACp对Pb2+的吸附。所以选择最佳pH值为6。
2.3 吸附动力学
吸附动力学可以解释吸附剂在溶液中的吸附机理。常用的模型有以下两种[11-12]:
准一级动力学模型:假定吸附剂和吸附质之间为物理吸附作用,吸附位点与吸附速率成正比。该方程经处理为公式(8):
log(Qe-Qt)=logQe-k1t
(8)
准二级动力学模型:假定吸附剂和吸附质之间存在化学吸附作用,吸附速率与吸附质的浓度的平方成正比。该方程经处理为公式(9):
(9)
式中Qt——t时刻吸附量,mg/g;
Qe——平衡吸附量,mg/g;
k1——准一级吸附速率常数,min-1;
k2——准二级吸附速率常数,g/(mg·min)。
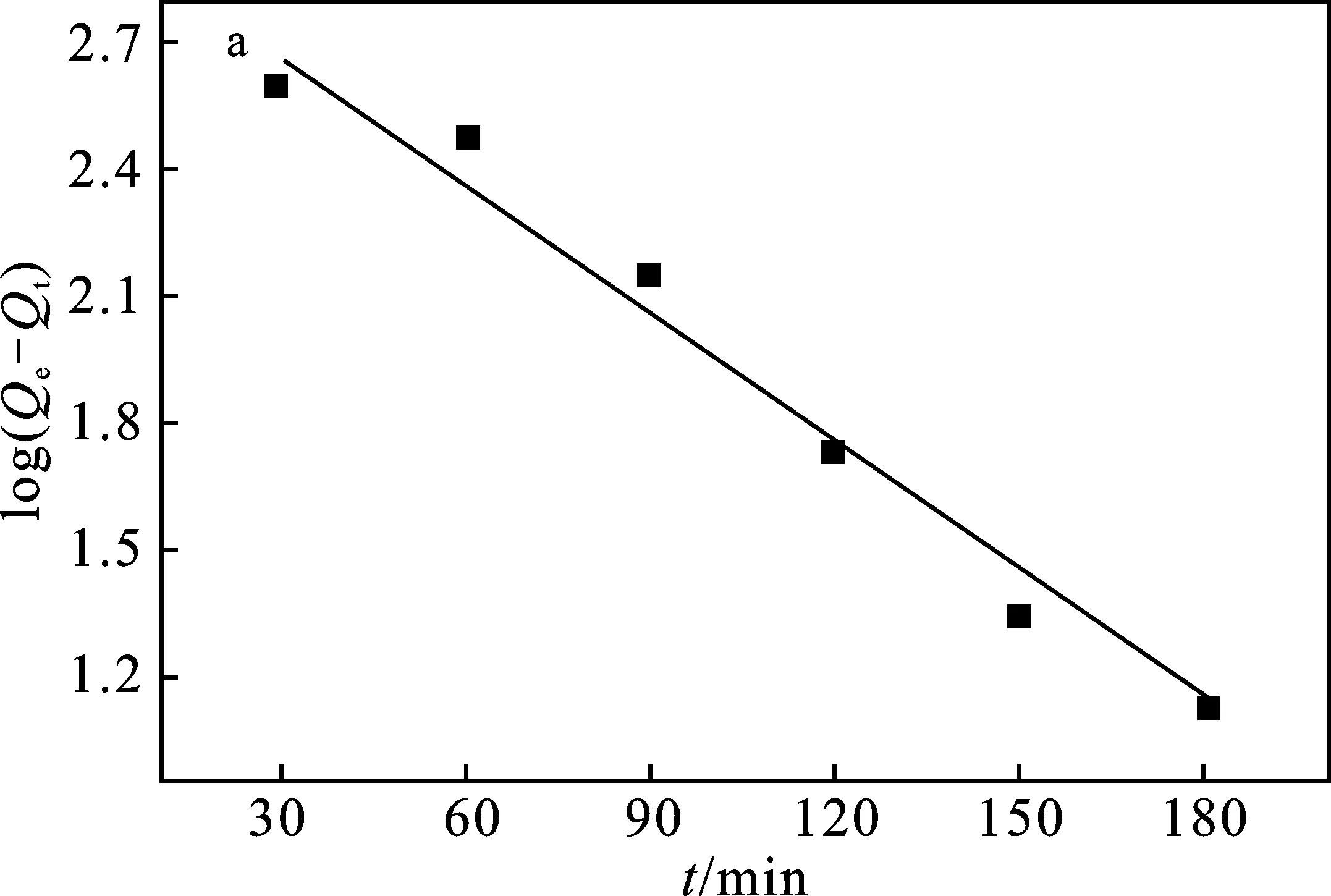
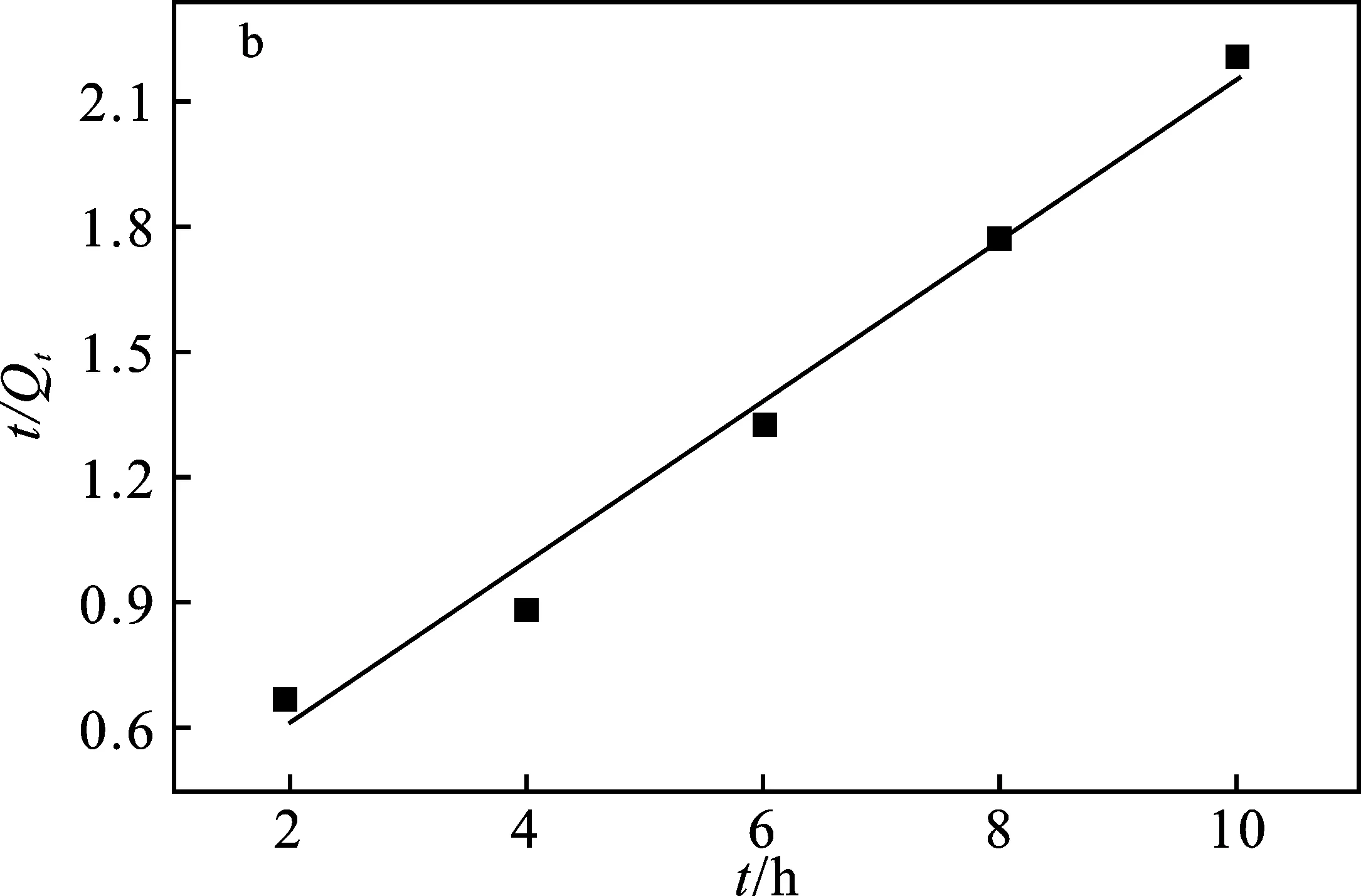
图7 MACp吸附Pb2+的准一级(a)和准二级(b)动力学模型Fig.7 Quasi-first-order(a) and quasi-second-order(b) kinetic models of MACp for Pb2+
由图7可知,MACp对Pb2+的吸附过程与准二级动力学方程拟合度更高(R2=0.997 2),且理论吸附量Qe为272.151 mg/g,与实验测得的最大吸附量272.24 mg/g比较接近,说明该吸附过程是发生在不均匀表面上的化学吸附过程。
2.4 吸附等温线
吸附等温线用于描述一定温度下溶质和吸附剂之间相互作用的行为。实验数据采用Langmuir和Freundlich吸附等温模型[13-14]进行拟合吸附等温方程分别见式(10)和式(11):
Ce/Qe=Ce/Qmax+1/(KlQmax)
(10)
lnQe=lnKf+(1/n)lnCe
(11)
式中Ce——平衡吸附浓度,mg/L;
Qe——平衡吸附量,mg/g;
Qmax——饱和吸附量,mg/g;
Kl、Kf——Langmuir和Freundlich吸附-解吸平衡常数;
n——常数。
由图8可知,MACp吸附Pb2+的Freundlich等温线模型的相关系数更高,Freundlich等温线模型能够更好地描述活性炭吸附Pb2+时吸附量随浓度变化的关系;1/n的数值<1,说明吸附剂MACp与Pb2+分子间的相互作用力较强,Pb2+很容易吸附到MACp上。
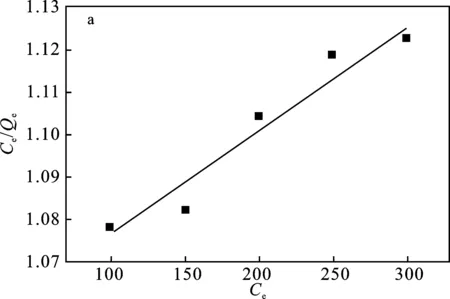
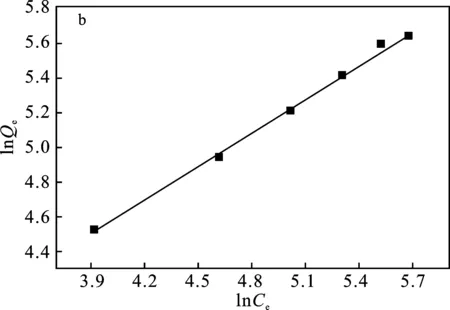
图8 MACp吸附Pb2+的Langmuir(a)和Freundlich(b)吸附等温线模型Fig.8 Langmuir(a) and Freundlich(b) adsorption isotherm models of Pb2+ adsorption on MACp
2.5 表征分析
2.5.1 FTIR分析 由图9可知,在MACp吸附Pb2+前,3 449 cm-1处出现—OH的强吸收峰,1 675 cm-1为N—H弯曲振动吸收峰[15],一系列的特征吸收峰表明MACp有多种官能团,有利于吸附溶液中Pb2+;吸附Pb2+后,MACp的FTIR谱图中含氮含氧官能基团的吸收强度都有所降低,表明MACp上的官能团成功吸附Pb2+。
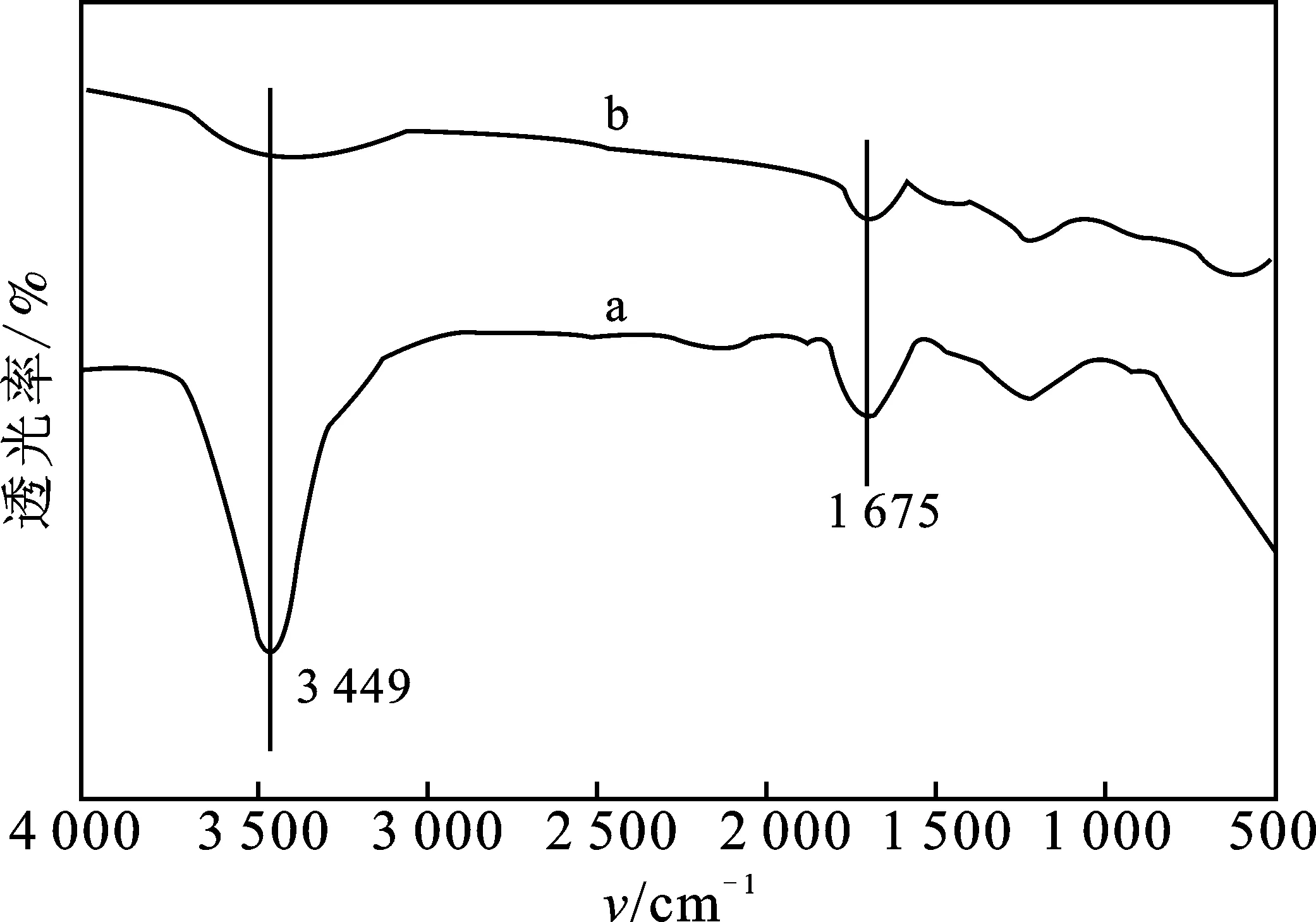
图9 MACp吸附Pb2+前(a)、后(b)的FTIR谱图Fig.9 FTIR spectra of MACp before(a) and after(b) adsorption of Pb2+
2.5.2 SEM分析 由图10a可知,MACp吸附Pb2+前的表面粗糙,具有大量的褶皱,在内部形成了大量排列整齐的孔隙结构,可以提供大量的吸附位点,提高其吸附能力;MACp表面也存在部分孔道塌陷的现象,是因为FeCl3转化为Fe3O4时消耗了一定的C,孔道结构稳定性降低产生塌陷;由图10b可知,MACp吸附Pb2+后,表面的孔隙被填充并变得光滑,说明Pb2+已被成功吸附。


图10 MACp吸附Pb2+前(a)、后(b)的SEM照片Fig.10 SEM images of MACp before(a) and after(b) adsorption of Pb2+
2.5.3 XRD分析 图11为MACp的X射线衍射图。

图11 MACp的XRD谱图Fig.11 XRD pattern of MACp
由图11可知,在衍射角2θ=25.5°和2θ=28.5°附近出现了衍射峰,它代表的是典型碳峰,2θ=43°处的衍射峰表明MACp含有石墨微晶结构;在2θ=35.3°处有一个最强衍射尖峰,这是Fe3O4的特征衍射峰,同时2θ=53.2°,2θ=56.7°和2θ=62.3°处的衍射峰也可以说明MACp上存在Fe3O4[16]。因此可以确定,FeCl3可以被松塔和松针中的C以及炭化产生的还原性气体还原成Fe3O4,在活性炭中起到一定的赋磁作用。
2.5.4 EDS分析 图12为MACp的EDS谱图。
由图12可知,MACp的EDS谱图中,在6.4,7.2 keV处有铁元素的吸收峰,说明MACp已经成功赋磁;由表1可知,铁元素的相对含量达到了12.11%,这说明Fe3O4相对含量较多,具有较强的磁性,提高MACp的吸附性能和适用性。
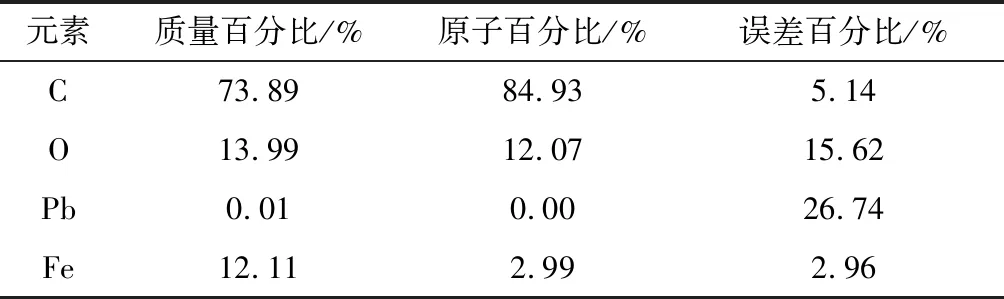
表1 MACp的eZAF定量结果
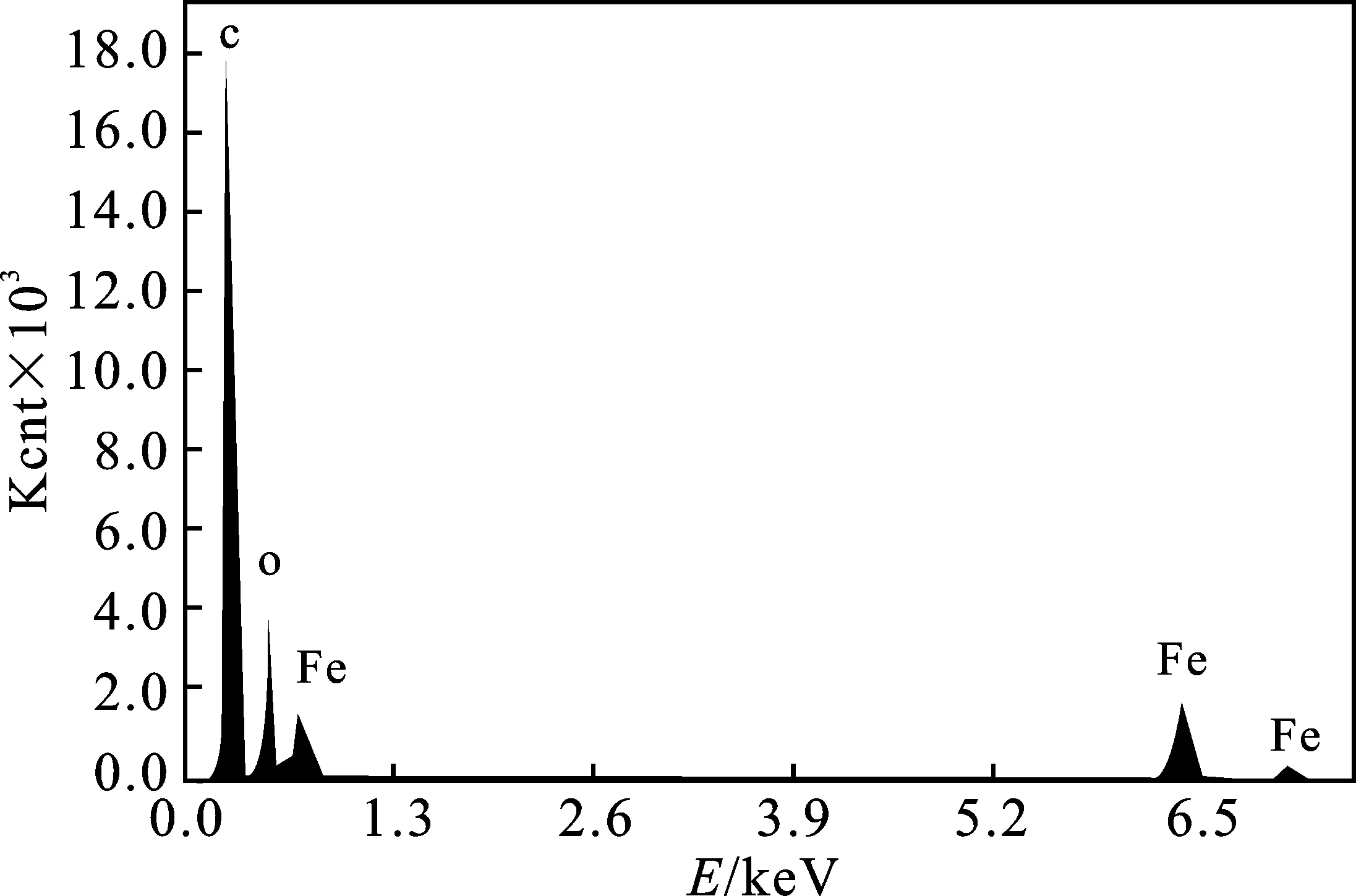
图12 MACp的EDS谱图Fig.12 EDS spectra of MACp
3 结论
以松塔和松针为原料,无水FeCl3为磁化剂制备活性炭,在最佳制备条件和吸附条件下,该活性炭对Pb2+最大吸附量为272.24 mg/g,吸附过程符合准二级动力学模型和Freundlich吸附等温线模型,Freundlich方程中的1/n为0.697 2,吸附过程容易进行;表征结果可知,MACp具有发达的孔隙结构、丰富含氮含氧官能基团和较低的稳定性和有序性,已经成功赋磁且磁性较高,有利于提高活性炭的吸附性能和重复利用性,并可以确定MACp已成功吸附Pb2+。表明该活性炭在含Pb2+废水的处理方面具有良好的应用前景。
