RIPK2上调MGMT调节结肠癌细胞伊立替康耐药的机制探讨
2022-08-05徐建立孙艳华孟小晶曹学彬
徐建立,孙艳华,李 明,董 路,孟小晶,曹学彬
0 引言
结肠癌是常见的消化系统恶性肿瘤,常发病于直肠与乙状结肠交界处[1]。近年来,免疫治疗和靶向治疗逐渐应用于临床,在一定程度上延长了患者的生存期[2]。但结肠癌患者经过一段时间治疗后,往往会出现获得性耐药,最终导致治疗失败[3]。
伊立替康为晚期结肠癌治疗的一线药物,其代谢产物SN38能引起DNA单链断裂,阻止DNA复制及抑制RNA合成,将癌细胞阻滞于细胞周期的S期,从而抑制肿瘤生长[4-5]。受体相互作用丝氨酸苏氨酸激酶2(Receptor-interacting serine threonine kinase 2,RIPK2)属于RIP家族成员,在多种组织中均有分布[6]。RIP2可与多种蛋白相互作用,参与多途径信号转导,从而发挥相应生理功能,被认为是固有免疫、适应性免疫及炎症的重要衔接分子[6]。研究显示,RIPK2能通过调节NF-κB/MGMT 信号通路参与神经胶质瘤细胞替莫唑胺耐药[7]。但RIPK2是否在结肠癌细胞耐药中发挥作用还不清楚,有待于进一步研究。本研究采用HCT116细胞构建伊立替康耐药细胞HCT116/DR,观察RIPK2与伊立替康耐药之间的关系并对其机制进行探讨,为防治结肠癌耐药提供理论依据。
1 材料
1.1 细胞和药物 人结肠癌HCT116细胞购自北纳生物/河南省工业微生物菌种工程技术研究中心。伊立替康购自美国MedChemExpress公司。
1.2 试剂 噻唑蓝(MTT)、结晶紫染色液、二甲基亚砜(DMSO)及多聚甲醛购自北京索莱宝公司。RIPK2抗体(4142S)、MGMT抗体(86039S)、GAPDH抗体(5174S)购自美国Cell Signaling Technology公司。抗兔IgG-HRP二抗购自上海爱必信公司。RIPK2过表达慢病毒转染试剂盒购自上海基尔顿生物科技有限公司。
1.3 实验仪器 Multiskan SkyHigh 全波长酶标仪(美国Thermo Scientific公司产品);Tanon 3500全自动数码凝胶图像分析系统(上海天能公司产品);CKX53倒置显微镜(日本奥林巴斯公司产品)。
2 方法
2.1 细胞培养和伊立替康耐药结肠癌细胞的建立 人结肠癌HCT116细胞以含10% FBS和1%青-链霉素的DMEM高糖培养基培养,细胞培养环境为37℃、5% CO2、95% 空气的细胞培养箱中。采用逐渐增加伊立替康药物浓度梯度诱导的方法,经4.5个月构建1株耐药细胞HCT116/DR,细胞最终能在13 μM伊立替康中稳定生长。
2.2 MTT法检测细胞增殖能力 将所需细胞培养至对数期后,以8 000个/孔接种于96孔板中。以1、5、10、50、100 μM 伊立替康处理细胞24 h,同时设立对照孔和调零孔,每孔均设3个复孔。处理结束后,每孔加入20 μl MTT溶液(5 mg/ml)培养4 h。取出细胞,弃去培养液,加入150 μl DMSO,用酶标仪于490 nm处测量各孔的吸光度值,计算增殖抑制率。
2.3 蛋白印记实验检测RIPK2和MGMT蛋白表达水平 将所需细胞取出,PBS洗3次,最后一次保留PBS,细胞刮刀刮下细胞并收集于5 ml离心管中,1 000 r/min离心5 min,弃去废液,以RIPA裂解液提取总蛋白。总蛋白用BCA蛋白定量试剂盒进行定量,随后制备蛋白样品。用PAGE凝胶电泳对总蛋白进行分离,将蛋白转印至PVDF膜上,5%脱脂牛奶封闭2 h。以RIPK2(1∶2 000)和MGMT(1∶2 000)抗体于4 ℃孵育PVDF膜过夜。洗去二抗,孵育抗兔IgG-HRP二抗1 h。洗去二抗,PVDF膜用ECL发光液于凝胶成像仪下成像。
2.4 慢病毒转染法外源性过表达RIPK2蛋白 将细胞以2×104个/孔接种于12孔板中,次日取出转染试剂盒,将慢病毒液置于冰上融化,将空载慢病毒液和RIPK2过表达慢病毒液稀释5倍备用。将细胞取出弃去旧培养基,PBS清洗后加入含10%空载慢病毒液和RIPK2过表达慢病毒液稀释液的全培养基,分别设置为空载体组(Vector)和RIPK2过表达组(RIPK2 OV),同时以未转染的细胞作为对照组(Control)置于培养箱培养过夜。次日更换全培养基,待细胞生长至90%汇合度时进行传代,并以嘌呤霉素进行筛选。蛋白印记实验验证RIPK2蛋白表达情况。
2.5 结晶紫染色检测细胞增殖能力变化 将所需细胞以2×105个/孔接种于6孔板中,伊立替康(10 μM)处理24 h。将细胞以PBS清洗,4%多聚甲醛固定10 min,0.1%结晶紫染色液染色10 min,自来水清洗后于倒置显微镜下观察拍照并计算增殖抑制率。

3 结果
3.1 伊立替康耐药结肠癌细胞HCT116/DR验证 采用逐渐增加伊立替康药物浓度,梯度诱导的方法构建1株耐药细胞HCT116/DR。MTT结果显示,HCT116/DR细胞对伊立替康的敏感性降低,耐药指数为4.93,见图1。

图1 伊立替康对HCT116/DR细胞的增殖抑制作用
3.2 RIPK2和MGMT在HCT116/DR细胞中表达升高 如图2结果所示,与HCT116细胞相比,RIPK2和MGMT蛋白表达在HCT116/DR细胞中表达明显升高(P<0.01)。

图2 HCT116/DR细胞RIPK2和MGMT蛋白表达水平注:RIPK2和MGMT蛋白用GAPDH为内参进行表达量归一化处理。HCT116细胞各蛋白相对表达量转换为100%,计算HCT116/DR细胞各蛋白表达。**与HCT116细胞相比,P<0.01
3.3 RIPK2过表达诱导结肠癌细胞MGMT表达升高 如图3结果所示,与Vector组相比,RIPK2 OV组HCT116细胞RIPK2蛋白表达显著上调(P<0.01)。与Vector组相比,RIPK2 OV组HCT116细胞MGMT蛋白表达明显上调(P<0.01)。

图3 RIPK2过表达对HCT116细胞MGMT蛋白表达的影响注:RIPK2和MGMT蛋白用GAPDH为内参进行表达量归一化处理。Control组细胞各蛋白相对表达量转换为100%,计算Vector和RIPK2 OV组细胞各蛋白表达。**与Vector组相比,P<0.01
3.4 RIPK2过表达抵抗伊立替康诱导的细胞毒作用 如图4结晶紫染色结果所示,伊立替康处理后,Control组、Vector组和RIPK2 OV组贴壁细胞存活率分别为100%、95.8%±8.6%及187.6%±15.2%。与Vector组相比,RIPK2 OV组HCT116细胞贴壁存活率显著上升(P<0.01)。
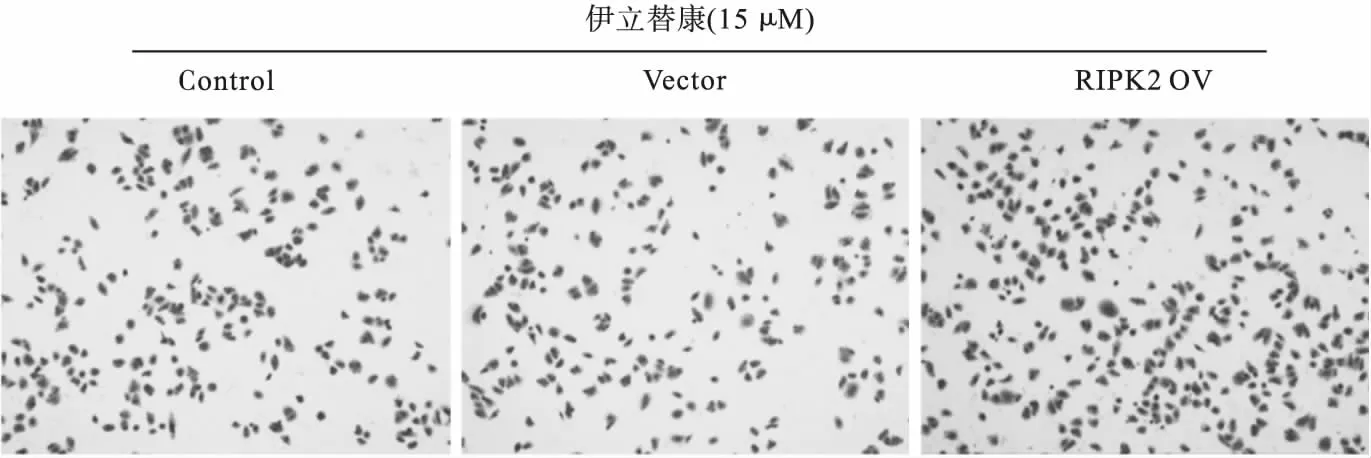
图4 伊立替康处理后各组HCT116细胞贴壁存活状态
3.5 RIPK2过表达抵抗伊立替康诱导的细胞增殖抑制 如图5所示,RIPK2 OV组HCT116细胞对伊立替康的敏感性明显降低,耐药指数为4.57。

图5 RIPK2过表达后HCT116细胞对伊立替康的敏感性变化
4 讨论
获得性耐药的出现是多数恶性肿瘤患者治疗失败的主要原因之一,在肿瘤细胞内获得性耐药的机制复杂而多样,现有研究还不够完善。结肠癌是最为常见的消化系统肿瘤,多数化疗敏感性肿瘤在早期治疗效果明显,随着获得性耐药的出现,肿瘤对药物的敏感性逐渐降低甚至消失,最终导致药物治疗失败。因此,对耐药机制进行探索可能为临床预防或治疗结肠癌耐药提供一定的理论支持。
本研究采用逐渐增加伊立替康药物浓度,梯度诱导的方法构建耐药细胞HCT116/DR。发现HCT116/DR细胞对伊立替康的敏感性降低,耐药指数为4.93,提示伊立替康耐药细胞HCT116/DR构建成功。进一步研究发现,RIPK2和MGMT蛋白表达在HCT116/DR细胞中表达明显升高。RIPK2已被证实在多种恶性肿瘤中参与耐药。研究显示,RIPK2能通过激活NF-κB通路抵抗紫杉醇和神经酰胺诱导的三阴乳腺癌细胞凋亡[8]。还有研究显示,RIPK2能与配对框蛋白5相互作用,促进 B 淋巴细胞增殖性疾病中的 NF-κB 活化和耐药性[9]。在神经胶质瘤细胞中,RIPK2被证实与替莫唑胺耐药有关,RIPK2通过激活NF-κB通路上调MGMT从而参与耐药[7]。MGMT(O6-methylguanine-DNAmethyltransferase)是NF-κB参与恶性肿瘤细胞耐药的重要下游信号分子,其能与DNA鸟嘌呤6位氧上的烷基化合物结合,将烷基转移到MGMT的第145号半胱胺酸活性位点上,使DNA上烷基化的鸟嘌呤被还原,最终避免子链DNA缺口出现,导致耐药性[10-12]。MGMT已被证实参与多种恶性肿瘤的化疗耐药,研究显示,微小RNA-1197通过与MGMT的3′-UTR相结合抑制MGMT表达,从而促进胶质瘤对替莫唑胺的敏感性[13]。在口腔鳞癌干细胞中,TET1 的低表达可能会刺激 MGMT 启动子甲基化,同时抑制 MGMT mRNA 表达,最终增强了口腔鳞癌干细胞对化疗药物的敏感性[14]。还有研究显示,Trps1通过调节MGMT表达与肺癌细胞的多药耐药相关[15]。目前已知MGMT是唯一能将O6鸟嘌呤复合物从DNA上移除的蛋白,因此细胞内源性MGMT表达或活性水平可能直接影响细胞对药物的抵抗[16]。这些均提示RIPK2-MGMT可能在结肠癌细胞伊立替康耐药中发挥作用。为了进一步验证RIPK2-MGMT在HCT116细胞伊立替康耐药中的作用,本研究通过外源性过表达RIPK2蛋白观察MGMT蛋白表达和耐药性的变化。结果显示,RIPK2过表达可上调MGMT蛋白表达,同时还可诱导HCT116细胞对伊立替康耐药。
综上所述,RIPK2可能通过上调MGMT蛋白表达参与结肠癌细胞伊立替康耐药。针对RIPK2进行研究,可为临床治疗结肠癌耐药提供理论支持。
