AECOPD和急性稳定期COPD患者呼出气一氧化氮水平与炎症及肺功能相关性研究
2022-08-04黄叶蒋华蒋忠
黄叶 蒋华 蒋忠
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)作为一种常见、多发的具有极高的致残率、病死率的慢性支气管炎和(或)肺气肿,其特征主要为气流受限,病因与有害气体、有害颗粒吸入及所引起的异常病变有关,多发人群主要集中在40岁以上人群,较常见的有慢性阻塞性肺疾病急性加重期(AECOPD)、急性稳定期慢性阻塞性肺疾病(ASCOPD)两种[1]。截至目前,全球范围内的COPD发病率已高达9%~10%[2]。作为常用的判定气道炎症生物标志物,呼出气一氧化氮(FeNO)的产生渠道主要是气道上皮细胞,其浓度与验证细胞数目息息相关,因为炎性因子与药物通过与诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)作用时,会影响FeNO浓度,二者呈正相关关系(即iNOS作用越大,FeNO浓度越高),多集中在炎症变化而改变,故在AECOPD、ASCOPD诊治全过程中将FeNO作为重要监控对象与判定依据[3]。而AECOPD、ASCOPD患者的肺功能和临床症状不能直接反映其气道炎症程度,因此必须借助于其他媒介(如FeNO浓度、iNOS、FEV1)才能判定[4]。本文探讨AECOPD、ASCOPD患者的炎症指标、肺功能指标与FeNO之间的关系,为临床诊治提供依据,报道如下。
1 资料与方法
1.1 一般资料 选取2018至2020年本院呼吸内科收治的经病理学诊断确诊的AECOPD(n=62)、ASCOPD(n=61)作为研究对象,AECOPD组中,男43例,女19例;年龄45~75岁,平均年龄(64.23±5.87)岁;临床表现以加重型咳嗽、咳痰、呼吸困难等为主,间或伴有黄痰等,必要时可改变既往药物治疗方案。ASCOPD组中,男42例,女19例;年龄45~75岁,平均年龄(65.50±4.65)岁;临床表现以近8周内病情轻微为主,即喘气稳定,咳嗽、咳痰症状均处于轻微状态,病情均恢复至AECOPD前。对照组65名志愿者中,男42例,女23例;年龄45~75岁,平均年龄(64.50±5.76)岁;均健康,无任何肺部疾病史者,且FEV1/FVC≥83%。3组常规资料比较差异无统计学意义(P>0.05)。本课题均符合《赫尔辛基宣言》(世界医学会)中的医学研究伦理原则。
1.2 纳入与排除标准[5]
1.2.1 纳入标准:①FEV1/用力肺活量(forced vital capacity,FVC)<70%者;②入组前30 d内无激素使用史及COPD相关药物治疗史者;③积极配合肺功能指标及FeNO指标相关检测者;④签署《知情同意书》和临床资料完整者;⑤年龄18~75岁。
1.2.2 排除标准:①合并哮喘、过敏性鼻炎等影响FeNO水平的相关疾病者;②入组前30 d内有激素使用史及COPD相关药物治疗史者;③年龄<18岁或>75岁者;④未签署《知情同意书》和临床资料不完整者。
1.3 治疗方法 ASCOPD组患者保持既往抗感染、解痉平喘治疗不变,AECOPD组患者在ASCOPD组治疗基础上结合肺功能(GOLD)分级标准(3~4级及以上)予以糖皮质激素(名称:甲强龙;生产厂家:PfizerManufacturingBelgiumNV;批准文号:进口药品注册证号:H201303011;规格:40 mg,用法用量:静脉注射,1次/d,持续治疗1周)治疗。见表1。
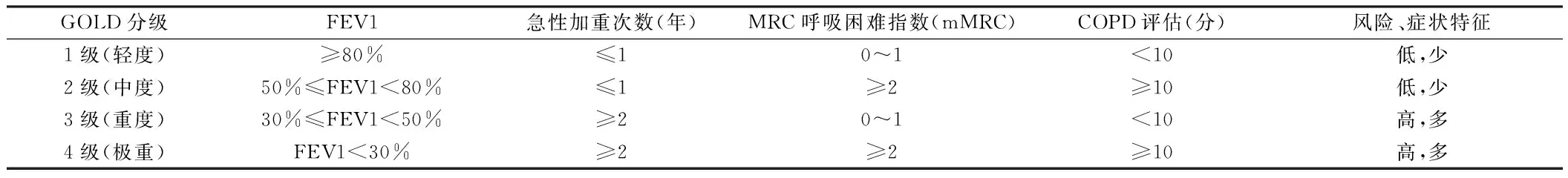
表1 COPD不同组别患者对的肺功能综合评估表
1.4 观察指标 均采集AECOPD、ASCOPD组及对照组实验前、后外周周静脉血2~3 ml并及时进行离心处理(离心速率3 000 r/min,离心时间3 min),然后利用全自动血细胞分析仪(生产厂家:美国贝克曼库尔特有限公司,型号:BACKMAN COULTER LH755)分别检测嗜酸性粒细胞(eosinophilia,Eos)、中性粒细胞(neutrophil,N)、CD+淋巴细胞表达水平;FeNO检测:采用FeNO测定系统(生产厂家:Aerocrine AB公司,产品型号:NIOX VERO)测定,检测方法均根据据美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸学会(European Respiratory Society,ERS)相关标准执行[6]。FVC、FEV1及FEV1等肺功能指标则采用肺功能检测仪(生产厂家:日本美能公司,型号:AS-507,ISO900:ISO 13485国际认证)测定。
2 结果
2.1 治疗前3组肺功能指标及FeNO表达水平比较 治疗前AECOPD组的Eos、N、FeNO表达水平均显著高于ASCOPD及对照组,而ASCOPD组高于对照组,差异均有统计学意义(P<0.05);治疗前AECOPD组的FEV1、FEV1/FVC与对照组比较差异有统计学意义(P<0.05),与ASCOPD组比较差异无统计学意义(P>0.05)。见表2。

表2 治疗前AECOPD、ASCOPD及对照组肺功能及FeNO表达水平比较
2.2 不同GOLD分级下的AECOPD、ASCOPD组Eos、N、FeNO表达水平比较 AECOPD组中的GOLD亚组(1~2级)Eos表达显著高于3~4级组,N、FeNO表达显著地低于3~4级组(P<0.05);而ASCOPD组Eos、N、FeNO表达的GOLD亚组分类比较差异无统计学意义(P>0.05)。见表3。

表3 不同GOLD分级的AECOPD、ASCOPD组Eos、N、FeNO表达水平比较
2.3 AECOPD组治疗前后Eos、N、FeNO、FEV1水平与ASCOPD及对照组比较 AECOPD组治疗后1周的Eos、N、FeNO、FEV1表达水平显著低于治疗前(P<0.05),同时也显著高于对照组(P<0.05),而治疗后1周与ASCOPD组比较差异无统计学意义(P>0.05)。见表4。

表4 AECOPD组治疗前后Eos、N、FeNO、FEV1%水平与ASCOPD组及对照组比较
2.4 AECOPD组治疗前后CRP、TNF-α水平与对照组及ASCOPD组比较 治疗后AECOPD组CRP、TNF-α、IL-6、PCT水平均显著降低(P<0.05),与ASCOPD组比较差异无统计学意义(P>0.05)。见表5。

表5 AECOPD组治疗前后CRP、TNF-α表达水平与ASCOPD组及对照组比较
2.5 各炎性因子与肺功能指标(FEV1、FEV1/FVC、FEV1)相关性分析 经Pearson相关性分析发现,AECOPD、ASDOPD患者的CRP、TNF-α、IL-6、PCT等炎性因子与FEV1、FEV1/FVC、FEV1等肺功能指标呈负相关(P<0.05),CRP、TNF-α、IL-6、PCT等炎性因子与FeNO呈正相关(P<0.05)。见表6。

表6 各炎性因子与肺功能指标(FEV1、FEV1/FVC、FEV1%)相关性
3 讨论
包括AECOPD、ASDOPD在内的COPD的临床诊治时,单一的肺功能指标依然无法满足临床诊治需求,原因在于其无法代表该病的全貌[7]。GOLD加入了改变的综合评估、个性化治疗及对相关合并症的处理及预防,这不仅提升了AECOPD、ASDOPD等的综合评估质量,也使其诊断、治疗等的可操作性更强[8]。而从近年来的相关研究实际来看,这在一定程度上缓解了AECOPD、ASDOPD的致残率、病死率,尤其是前者。但需注意的是,由于COPD的确切病因至今未明,在其发生发展、转归等过程中存在多种验证细胞、炎性介质及相关细胞因子的参与或(和)相互作用,因此探索这些诱发因素与COPD患者气道炎症变化的相关性对提升该病病情的整体判断能力,指导临床治疗等具有举足轻重的临床价值[9]。
氧气能进入人体循环系统,与呼吸系统息息相关。需要注意的是,由于人类呼吸过程种所吸入的外界空气种类较多,但不一定全部的空气都有利于生命活动,呼吸道则扮演了加温、湿润、过滤等保护功能。经呼吸道“加工”后的空气不仅可以被送至肺部的最远端,还可防止大气污染物的侵袭和保护肺部免受病原体侵害的目的[10]。NO参与了多种生理与病理环节,是机体重要的生物调节因子,主要由精氨酸与一氧化氮合酶(nitric oxide synthase,NOS)作用产生,而FeNO作为气道炎性生物标志物,其浓度大小与验证细胞数据高度息息相关,对它的研究,目前多集中在支气管哮喘及COPD等领域中[11]。FeNO与Eos浸润之间的关系式密不可分的,但对于COPD而言,由于其效应细胞主要是中性粒细胞(N),因此目前学术界对ASDOPD患者FeNO的水平变化仍存在争议。而结合本文研究结果来看,ASCOPD组治疗1周后的FeNO表达水平与治疗前比较差异无统计学意义(P>0.05),但Pearson相关性分析发现,ASDOPD患者的CRP、TNF-ɑ、IL-6、PCT等炎性因子与FeNO却呈负相关(P<0.05),提示上述炎性因子的出现可致使iNOS表达增加,迫使气道上皮细胞或其他细胞合成、释放过量的NO,继而引起FeNO升高。当ASCOPD感染得以有效控后,NO合成、释放也随之降低,因此相较于AECOPD患者而言,ASCOPD患者的FeNO显著偏低[12]。
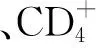
综上所述,AECOPD、ASDOPD患者的肺功能指标、FeNO水平与血清炎性因子呈异常升高密切相关,但相对而言,ASDOPD患者的血清炎性因子呈异常升高较AECOPD患者不显著,故可将FeNO作为AECOPD患者的病情监测参考指标之一。
