硫化氢通过调节Nrf2/HO-1通路对大鼠肾缺血再灌注损伤的影响
2022-08-04张文文董毅玲覃志成
闫 琰,张文文,董毅玲,覃志成
(1山西医科大学第五临床医学院肾内科,太原 030012;2山西省肾脏病重点实验室;*通讯作者,E-mail:taiyuantzc@163.com)
急性肾损伤(acute kidney injury,AKI)是由多种病因引起的肾功能快速下降,导致氮代谢(尿素和肌酐)和/或尿量减少而出现的临床综合征[1],是慢性肾脏病(CKD)和终末期肾病(ESRD)发展的危险因素[2]。缺血再灌注损伤(ischemia reperfusion injury,IRI)是临床上导致急性肾损伤的主要原因之一[3],也是肾移植过程中不可避免的事件,可导致重要的肾实质丧失[2]。而氧化应激是缺血再灌注期间肾组织损伤的重要病理生理机制[4]。核因子红细胞2相关因子2(Nrf2)是调节抗氧化防御系统以应对氧化应激的关键转录因子[5],Nrf2/HO-1通路的激活可减轻大鼠缺血再灌注损伤[6]。硫化氢(H2S)在肾脏中扮演重要的生理和病理角色,硫氢化钠(NaHS)是H2S的外源性供体。我们前期研究表明,H2S可通过抑制氧化应激减轻肾脏缺血再灌注损伤[7]。本研究通过建立肾缺血再灌注损伤模型,以NaHS作为预处理药物,观察H2S是否可通过Nrf2/HO-1通路减轻肾缺血再灌注损伤。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级SD大鼠24只,购自山西省人民医院实验动物中心(动物许可证号:SYXK(晋)2019-0003),6~8周龄,常规条件下饲养,自由进食和饮水,实验前禁食12 h,自由饮水。
1.1.2 试剂 NaHS购于美国Sigma公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malonic dialdehyde,MDA)试剂盒、尿素氮(BUN)及血肌酐(Scr)试剂盒均购于南京建成科技有限公司;活性氧(reactive oxygen species,ROS)荧光探针二氢乙啶(dihydroethidium,DHE)试剂盒购于北京威格拉斯生物技术有限公司;兔抗大鼠Nrf2一抗(AF7006)、抗HO-1一抗(10701-1-AP)、山羊抗兔IgG二抗(GB23303)购自武汉赛维尔生物科技有限公司;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒购于武汉赛维尔生物科技有限公司。
1.2 研究方法
1.2.1 动物建模及分组 选取24只雄性SD大鼠,随机分为假手术组(sham组)、肾脏缺血再灌注(ischemia/reperfusion,I/R)组、I/R+NaHS组,每组8只。预处理:通过腹腔注射10%水合氯醛(0.3 ml/100 g)进行麻醉,分离肾蒂周围组织,暴露左肾动脉,结扎右肾蒂,切除右肾。左肾动脉插管,将硫化氢供体NaHS以300 nmol/min速度连续给药10 min,I/R组和sham组左肾动脉注射同体积生理盐水。I/R组及I/R+NaHS组用微动脉夹夹闭左肾蒂45 min后解除,建立缺血性急性肾损伤模型,sham组不给予夹闭。24 h后通过心脏穿刺采集血样,检测血液中Scr及BUN;采集左肾并分为两份,一份浸泡于4%多聚甲醛常温固定,经石蜡包埋处理后存放,待肾组织标本病理染色、TUNEL染色;另一份保存于-80 ℃冰箱,待肾组织标本进行Western blotting检测、ROS检测、SOD及MDA检测。
1.2.2 Western blot检测Nrf2、HO-1蛋白表达 每组取适量存于-80 ℃冰箱的肾组织,加入适量预冷的蛋白裂解液匀浆,放置冰上裂解液30 min,用BCA试剂盒提取总蛋白并测定蛋白浓度。SDS-PAGE凝胶电泳法分离并转移至PVDF膜,在4 ℃条件下加入兔抗大鼠Nrf2一抗(1 ∶1 000)及兔抗大鼠HO-1一抗(1 ∶1 000)孵育过夜,TBST洗膜,在4 ℃下加入辣根过氧化物酶(HRP)标记的山羊抗兔二抗(1 ∶3 000),孵育2 h,ECL化学发光法曝光。以GAPDH为内参照,通过计算目标蛋白与GAPDH的灰度值比值进行半定量分析。
1.2.3 氧化应激指标检测 取肾组织块约50 mg,制作10%组织匀浆液,根据试剂盒说明书,比色法检测肾组织SOD活性及MDA含量;肾组织冷冻,制作5 μm厚冰冻切片,按试剂盒说明书行DHE(dihydroethidium,二氢乙锭)染色,荧光显微镜观察红色荧光。
1.2.4 肾组织细胞凋亡检测 为检测缺血再灌注损伤凋亡情况,对不同处理组大鼠肾组织做切片后进行TUNEL染色和镜下凋亡细胞统计。肾组织固定包埋,切片4 μm厚,根据TUNEL染色试剂盒说明书操作。4,6-二脒基-2-苯基吲哚二盐酸盐(2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride staining,DAPI)所染细胞核在紫外激发波下呈蓝色(即为视野所见所有肾小管上皮细胞),阳性凋亡细胞核为绿色。使用Eclipse Ci-L荧光拍照显微镜选取切片的目的区域进行200倍成像。成像完成后使用Image-Pro Plus 6.0分析软件,分别测量每张切片5个视野中阳性细胞数以及对应的总细胞数,并计算出阳性率(%)=阳性细胞数/总细胞数×100%。
1.2.5 肾功能检测 收集各组大鼠血液,分离血清后用根据试剂盒说明书,采用比色法,用全自动生化分析仪检测肌酐及尿素氮水平。
1.2.6 肾组织病理学检测 取各组大鼠肾组织10%甲醛固定48 h后石蜡包埋制作切片,切片5 μm厚,行HE染色,在200倍荧光显微镜下观察肾组织损伤情况,半定量评估肾小管间质损伤程度。肾小管的损伤程度评分:0分,正常;1分,微创伤,外髓质和皮质破坏<5%;2分,轻度破坏,外髓质和皮质破坏5%~25%;3分,中度破坏,外髓质和皮质破坏25%~75%;4分,严重破坏,外髓质和皮质破坏>75%。
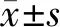
2 结果
2.1 Nrf2及HO-1蛋白表达水平
与sham组相比,I/R组Nrf2和HO-1蛋白表达水平明显升高(P<0.05);与I/R组比较,I/R+NaHS组Nrf2和HO-1蛋白表达水平也明显增高(P<0.05,见图1)。
与sham组比较,*P<0.05;与I/R组比较,#P<0.05图1 Western印迹法检测各组大鼠肾组织HO-1、Nrf2蛋白的表达 (n=8)Figure 1 Expression of HO-1 and Nrf2 proteins in kidney tissues of rats in different groups by Western blot (n=8)
2.2 肾组织MDA及SOD表达
与sham组相比,I/R组肾组织SOD活性明显降低(P<0.01),MDA含量明显增加(P<0.01);与I/R组相比,NaHS处理后SOD活性明显升高(P<0.01),MDA含量减少(P<0.01,见表1)。

表1 各组大鼠肾组织SOD活性和MDA含量变化 (n=8,
2.3 肾组织ROS表达
与sham组比较,I/R组肾组织细胞内有明显的红色荧光;与I/R组比较,I/R+NaHS组红色荧光减弱(见图2)。
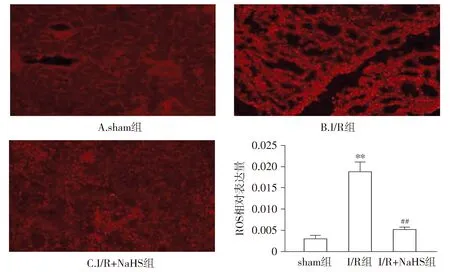
与sham组比较,**P<0.01;与I/R组比较,##P<0.01图2 各组大鼠肾组织ROS表达 (DHE染色,×200,n=8)Figure 2 ROS expression in rat kidney tissues in all groups (DHE staining,×200,n=8)
2.4 大鼠肾组织细胞凋亡情况
结果显示:与sham组相比,I/R组可见凋亡细胞明显增多(P<0.05);与I/R组相比,I/R+NaHS组未见明显凋亡特征(P<0.05,见图3)。

与sham组比较,*P<0.05;与I/R组比较,#P<0.05;箭头所指为凋亡细胞图3 各组大鼠肾组织凋亡细胞比较 (TUNEL染色,×200,n=8)Figure 3 Comparison of apoptotic cells in rat kidney tissue between groups (TUNEL staining,×200,n=8)
2.5 各组大鼠血肌酐及尿素氮水平
与sham组相比,I/R组Scr、BUN均明显升高(均P<0.05);与I/R组相比,I/R+NaHS组Scr、BUN均明显下降(均P<0.05,见表2)。

表2 各组大鼠血清Scr、BUN水平比较
2.6 各组大鼠肾脏病理改变
sham组大鼠肾小球、肾小管未见明显异常改变。与sham组相比,I/R组大鼠肾脏结构明显受到破坏,肾小管上皮细胞坏死,管型形成,肾小管扩张可见核碎裂或溶解(黑色箭头)及部分钙化(红色箭头),可见炎细胞浸润(蓝色箭头)(P<0.01);与I/R组相比,I/R+NaHS组肾小管间质病理改变减轻,仅有少量空泡变性和管型,其间质充血水肿减轻,仅有少量炎性细胞浸润(P<0.01,见图4)。

与sham组比较,**P<0.01;与I/R组比较,##P<0.01图4 各组大鼠肾组织病理学改变 (HE染色,×200,n=8)Figure 4 Histopathological changes of the kidney of rats in all groups (HE staining,×200,n=8)
3 讨论
急性肾损伤是住院患者常见的并发症之一,是终末期肾病的常见危险因素,常发展为慢性肾脏病[8]。肾缺血再灌注损伤是AKI的常见原因,其病理生理学包括氧化应激、炎症反应、线粒体功能障碍、钙超载、细胞自噬和凋亡以及内皮细胞功能障碍等[9]。缺血再灌注损伤是肾移植过程不可避免的事件,可导致植物功能延迟、重要的肾实质丧失,进而启动免疫排斥反应,最终导致植物功能丧失[2]。此外,血栓性疾病、脓毒症、严重创伤、失血性休克、心搏骤停及体外循环手术等均可导致不可逆肾损伤及高病死率,已成为全球性公共卫生问题。因此,预防和治疗肾脏缺血再灌注损伤是临床上迫切需要解决的问题。
H2S是一种无色、易燃、可溶于水的气体,具有典型臭鸡蛋味[10]。生化研究表明,肾脏是H2S的丰富来源,参与调节肾小球滤过率(GFR)、钠吸收、肾素释放和肾脏系统氧感应等;胱硫醚γ-裂解酶(CSE)、胱硫醚β-合成酶(CBS)和3-巯基丙酮酸硫转移酶(3-MST)是肾脏中产生H2S的主要酶[11]。H2S对肾缺血再灌注损伤的有益作用主要是通过抗氧化、抗凋亡和抗炎作用实现[10],且已被证明可以改善接受双侧肾切除术并随后进行肾移植的大鼠的同种异体移植物存活率和肾功能[11],表明其可能有助于在诸如肾移植、肾切除等情况下治疗肾缺血再灌注损伤,保护肾功能[4]。除此之外,H2S可通过多种信号通路改善化疗药物所致急性肾损伤,并在泌尿系统肿瘤的治疗有提示性作用[12-14]。
氧化应激是肾脏疾病发生、发展的重要恶化因素,缺血再灌注损伤诱导ROS生成是通过氧化应激介导的肾脏损伤,这是导致AKI的主要原因。在本实验中,我们从肾功能角度证实,缺血再灌注处理情况下I/R组SD大鼠肾功能明显受损,血肌酐及尿素氮含量高于sham组及NaHS组,表明大鼠缺血再灌注模型建立成功,缺血再灌注导致肾组织损伤和肾功能紊乱。而NaHS处理后SD大鼠血肌酐、尿素氮含量较I/R组降低,表明H2S对大鼠肾缺血再灌注后肾功能有保护作用。SOD是氧化应激的重要酶,MDA是脂质过氧化的终产物。故本实验检测大鼠肾组织SOD活性与MDA含量,观察到肾缺血再灌注后SOD活性明显降低,MDA含量明显增加,同时ROS明显增加,伴肾脏病理、肾功能损伤以及肾脏组织细胞凋亡增加,表明氧化应激参与肾缺血再灌注损伤。而NaHS组SD大鼠MDA含量较I/R组降低,SOD活性增加,ROS明显减少,大鼠肾脏病变情况和组织细胞凋亡情况改善,表明H2S可减轻肾脏氧化应激损伤。
Nrf2/HO-1信号通路在机体的调控网络中占据关键位置,是抗氧化还原相关的重要通路,在缺血再灌注损伤中发挥重要的保护作用[6]。在此过程中,Nrf2与Kelch样表氯醇相关蛋白1分离并转移到细胞核,与抗氧化反应元件相互作用,通过上调抗氧化酶基因如HO-1的转录和表达,减轻氧化应激导致的缺血再灌注损伤[15,16]。本研究检测了Nrf2和HO-1蛋白水平的表达及下游氧化应激指标ROS、SOD、MDA的表达,发现Nrf2/HO-1信号通路在缺血再灌注过程中被激活,并可减轻氧化应激损伤,与相关研究一致[5]。本实验中,我们通过Western blot分析了三组大鼠肾组织Nrf2和HO-1蛋白水平的表达,发现与sham组比较,I/R组缺血再灌注大鼠肾组织中Nrf2和HO-1表达有所增高,表明Nrf2/HO-1信号通路可能参与肾缺血再灌注损伤。而NaHS预处理的大鼠Nrf2和HO-1蛋白表达水平较缺血再灌注组升高,SOD活性增加,MDA含量、ROS表达减少,伴肾功能、肾脏病理损伤好转,肾组织凋亡降低,提示H2S可能是通过激活Nrf2/HO-1信号通路在大鼠肾缺血再灌注损伤中抑制氧化应激,进而抑制下游的炎症反应与细胞凋亡,减轻缺血再灌注后的肾损伤。
综上,本实验通过建立大鼠肾缺血再灌注模型,发现H2S可通过上调Nrf2/HO-1信号通路,抑制氧化应激,对缺血性急性肾损伤起到保护作用,为急性肾损伤的治疗提供新思路。
