miR-206通过靶向GREM1调节鼻咽癌细胞的增殖、迁移能力
2022-08-04邵倩倩王晓敏王梦君马士崟
邵倩倩,王晓敏,李 慧,苏 凯,王梦君,马士崟*
(1蚌埠医学院基础医学院人体解剖学教研室,蚌埠 233000;2蚌埠医学院第一附属医院耳鼻咽喉头颈外科;*通讯作者,E-mail:mashiyinent@163.com)
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种起源于鼻咽上皮的恶性头颈部肿瘤,其发病率明显具有区域性,在东南亚和北非居高不下[1,2]。根据国际癌症研究机构2018年的报告,全球每年有129 079例新发NPC病例和72 987例死亡[3]。大约10%的患者在原发部位有残留或复发,15%~30%的NPC患者在根治后有远处转移。遗传易感性、环境致癌物和爱泼斯坦-巴尔病毒(EBV)感染被认为是导致这种恶性肿瘤的重要因素。由于缺乏症状表现,大多数鼻咽癌患者被诊断为晚期,复发转移已成为鼻咽癌治疗失败的主要原因[4-6]。
microRNA(miRNA)是一组丰富的22个核苷酸的内源性非编码单链RNA,通过抑制目标mRNA的翻译或降解在转录后水平上调节基因的表达[7,8]。研究表明,miRNA的表达与多种癌症有关,在肿瘤进展中起着至关重要的作用[9,10]。因此,研究异常表达的miRNA以识别NPC治疗的新的靶点是非常有必要的。miR-206在宫颈癌、神经母细胞瘤和肝癌等多种癌症进程中扮演重要角色[11-13]。到目前为止,miR-206在鼻咽癌发展进程中的作用及机制在很大程度上仍未可知。因此,本研究检测miR-206在鼻咽癌细胞中的表达水平,探讨miR-206对鼻咽癌细胞增殖与迁移的影响及相关机制,为鼻咽癌的临床研究与治疗提供一定的实验依据。
1 材料与方法
1.1 材料
人鼻咽癌细胞株NP69、CNE2、HNE1、6-10B及5-8F均购自中南大学湘雅医学院,冻存、培养于蚌埠医学院生化药理实验室。RPMI1640培养基、胎牛血清(fetal bovine serum,FBS)及Opti-MEM培养基均购于美国Gibco公司。噻唑蓝(methyl thiazolyl tetrazolium,MTT)购于美国Sigma公司。脂质体Lipofectamine2000、Trizol试剂均购于美国Invitrogen公司;miR-206类似物(miR-206 mimics)和阴性对照(negative control,NC)购于上海吉玛制药技术有限公司;SYBR Green PCR Master Mix购自日本TaKaRa公司;RevertAid TM First Strand cDNA Synthesis Kit购自美国Thermo Scientific。GREM1、N-catenin及Vimentin一抗抗体购自美国CST公司。
1.2 方法
1.2.1 细胞培养 鼻咽癌细胞系NP69、CNE2、HNE1、6-10B、5-8F均使用RPMI-1640培养基培养,其中加入10%胎牛血清(FBS)。细胞在温度为37 ℃、饱和湿度的含有5%CO2培养箱中培养。
1.2.2 生物信息学方法分析miR-206在鼻咽癌组织中的表达 采用ENCORI数据库分析miR-206在鼻咽癌组织和癌旁组织中的表达水平。
1.2.3 qRT-PCR检测mRNA的表达 Trizol法提取细胞总RNA,使用Prime ScriptTM第一链cDNA合成试剂盒将总RNA逆转为cDNA。逆转录产物cDNA保存于-80 ℃。miR-206以U6为内参,GREM1以GAPDH为内参,参照试剂盒说明确定qRT-PCR反应体系及条件。每组设置3个复孔,得到每孔Ct值后,计算3个复孔的平均值,按照2-ΔΔCt法相对定量计算公式计算miR-206和GREM1相对表达量。引物序列如下:miR-206的上游引物为5′-CAGATCCGATTGGAATGTAAGG-3′,下游引物为5′-TATGCTTGTTCTCGTCTCTGTGTC-3;GREM1的上游引物为5′-AAGTGACAGAATGAATCGCA-3′,下游引物为5′-CCGCTTTGACTTAATCCAAG-3′;GAPDH的上游引物为5′-AATGAAGGGGTCATTGATGG-3′,下游引物为5′-AAGGTGAAGGTCGGAGTCAA-3′。
1.2.4 细胞转染和分组 将鼻咽癌细胞HNE1和CNE2以每孔1×105的密度接种到6孔板中。按照制造商的说明书,使用Lipofectamine2000与opti-MEM转染鼻咽癌HNE1和CNE2细胞,转染的效果通过qRT-PCR确定。根据转染miR-206 mimics或NC将鼻咽癌细胞株HNE1(或CNE2)分为两组,即miR-206 mimics组或NC组,进行后续研究。
1.2.5 MTT法检测HNE1和CNE2细胞增殖 取转染miR-206 mimics或NC后的HNE1或CNE2细胞以1×104/ml密度接种于96孔板中,100 μl/孔,培养48 h细胞贴壁后,加入10 μl MTT溶液,并于37 ℃下孵育4 h。吸去每孔中的上清液,加入100 μl DMSO继续孵育于37 ℃孵育箱中30 min。使用酶标仪,检测波长490 nm处的吸光度(OD值)并计算细胞存活率。每组实验重复3次,取平均值。
1.2.6 集落形成实验检测细胞增殖 将转染miR-206 mimics或NC后的HNE1或CNE2细胞以每孔5×103细胞密度接种在6孔板中。在含5%CO2的37 ℃培养箱中培养7 d,观察到集落形成后吸去培养基。使用磷酸盐缓冲盐水(PBS)洗涤6孔板两次后,加入4%甲醛固定10 min后吸去甲醛,加入5%结晶紫染色10 min。吸去结晶紫,使用PBS冲洗后进行集落计数。
1.2.7 划痕实验检测细胞迁移 将转染miR-206 mimics或NC后的HNE1或CNE2细胞种植于6孔板中,等细胞融合后,使用高压灭菌枪头(200 μl)在孔内轻划1~3道划痕,分别在划痕后和24 h后于显微镜下观察细胞划痕修复情况,并记录划痕的宽度。
1.2.8 蛋白质印迹分析检测蛋白表达 使用裂解缓冲液提取转染miR-206 mimics或NC后的HNE1或CNE2细胞蛋白。采用BCA蛋白检测试剂盒检测不同分组蛋白样品的浓度。将40 μg总蛋白采用8%~15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转移至聚偏二氟乙烯(PVDF)膜。PVDF膜浸于5%脱脂牛奶中密封1 h,后孵于一抗中4 ℃过夜。孵育过夜后使用TBST清洗3次后将膜浸于在二抗中1 h。使用TBST清洗后加入ECL化学发光试剂显色、定影。采图像处理软件对各条带进行灰度值分析。
1.2.9 生物信息学方法分析GREM1在鼻咽癌组织中的表达 使用公共数据库GEPIA分析GREM1在鼻咽癌组织及癌旁组织中的mRNA表达水平。
1.2.10 Transwell Boyden小室检测细胞迁移 在鼻咽癌HNE1(或CNE2)细胞中,分别转染mimics NC+vector、miR-206 mimics+vector和miR-206 mimics+GREM,分别命名为mimics NC+vector组、miR-206 mimics+vector组和miR-206 mimics+GREM组。将转染后的HNE1(或CNE2)细胞重悬于无血清培养基中,调整细胞悬液中细胞密度,以8×104个细胞/室密度加入上室,底部室加入含有10% FBS的培养基。在5% CO2加湿培养箱中37 ℃下培养24 h后,去除上室中细胞,4%甲醛固定迁移细胞30 min后使用5%结晶紫染色10 min,并在光镜下计数。
1.2.11 生物信息学预测miR-206的靶基因 采用靶基因预测网站CoGeMiR、MicroRNAdb预测miR-206可能结合的靶基因。

2 结果
2.1 miR-206在鼻咽癌组织和不同鼻咽癌细胞系中表达
使用ENCORI数据库分析发现miR-206在鼻咽癌组织中低表达(见图1A)。采用qRT-PCR检测miR-206在不同鼻咽癌细胞株中的表达发现,与NP69细胞相比,鼻咽癌细胞株CNE2、HNE1、6-10B及5-8F细胞中miR-206的表达水平均较低(P<0.05),细胞株CNE2、HNE1及6-10B中miR-206的表达差异不具有统计学意义(P>0.05,见图1),因此本研究选择其中两株细胞CNE2和HNE1进行后续实验。

A. ENCORI数据库分析miR-206在鼻咽癌组织中表达与NP69细胞比较,*P<0.05B. 鼻咽癌细胞株中miR-206的表达水平图1 miR-206在鼻咽癌组织和细胞中表达Figure 1 Expression of miR-206 in nasopharyngeal carcinoma tissues and cells
2.2 验证miR-206 mimics转染效率
在HNE1、CNE2细胞中转染miR-206 mimics并验证转染效果。结果显示,转染miR-206 mimics后,HNE1、CNE2细胞中miR-206的表达水平显著上调(P<0.05,见图2)。

与NC组相比,*P<0.05图2 转染miR-206 mimics后miR-206的表达Figure 2 Expression of miR-206 after transfection with miR-206 mimics
2.3 转染miR-206 mimics对鼻咽癌细胞增殖的影响
在HNE1、CNE2细胞中转染miR-206 mimics 24,48,72 h后,与NC组相比,miR-206 mimics组的鼻咽癌细胞增殖能力显著降低(P<0.05,见图3)。细胞集落克隆形成实验结果显示,在HNE1及CNE2细胞中,miR-206 mimics组与NC组相比,形成的克隆细胞集落明显减少(P<0.05,见图4)。

与NC组相比,*P<0.05图3 转染miR-206 mimics对鼻咽癌细胞增殖的影响Figure 3 Effects of transfection with miR-206 mimics on proliferation of nasopharyngeal carcinoma cells

与NC组相比,*P<0.05图4 过表达miR-206 mimics对鼻咽癌细胞克隆能力的影响Figure 4 Effects of miR-206 mimics on the clonality of nasopharyngeal carcinoma cells
2.4 转染miR-206 mimics后对鼻咽癌细胞迁移的影响
在HNE1细胞中,miR-206 mimics组与NC组相比,细胞划痕愈合能力减弱(P<0.05)。同样,在CNE2细胞中,miR-206 mimics组与NC组相比,细胞愈合能力也表现减弱,差异有统计学意义(P<0.05,见图5)。

与NC组相比,*P<0.05图5 转染miR-206 mimics后鼻咽癌细胞迁移能力受到抑制 (×100)Figure 5 Migration ability of nasopharyngeal carcinoma cells after transfection of miR-206 mimics (×100)
2.5 转染miR-206 mimics对GREM1及N-catenin、Vimentin蛋白表达的影响
采用蛋白质印迹实验结果显示,转染miR-206 mimics能显著下调GREM1、N-catenin及Vimentin蛋白的表达水平(P<0.05,见图6)。

图6 转染miR-206mimics对鼻咽癌细胞中GREM1及EMT相关蛋白的影响Figure 6 Expression of GREM1 and EMT-related proteins in nasopharyngeal carcinoma cells after transfection of miR-206 mimics
2.6 miR-206靶向调控GREM1的表达
使用公共数据库GEPIA分析得出,GREM1的mRNA在519个鼻咽癌组织中的表达水平显著高于其在44个癌旁组织中表达(P<0.05,见图7)。并且,在HNE1、CNE2细胞中转染miR-206 mimics后,GREM1的mRNA表达水平显著降低(P<0.05,见图8)。CoGeMiR、MicroRNAdb生物信息学网站预测结果显示,miR-206与GREM1 mRNA存在结合位点,两者之间可能互补结合(见图9)。以上结果表明,在鼻咽癌细胞HNE1和CNE2中,miR-206可能对GREM1具有一定的调控作用。

图7 使用公共数据库GEPIA分析GREM1 mRNA的表达Figure 7 Analysis of GREM1 mRNA expression using the public database GEPIA
2.7 miR-206靶向GREM1影响鼻咽癌细胞迁移能力
Transwell Boyden小室实验结果显示,miR-206 mimics+GREM1组的细胞迁移数量高于miR-206mimics+vector组。在CNE2细胞中进行相同实验,结果显示,miR-206 mimics+GREM1组的细胞迁移数量同样高于miR-206 mimics+vector组(P<0.05,见图10)。

与NC组相比,*P<0.05图8 转染miR-206 mimics后GREM1 mRNA的表达Figure 8 Expression of GREM1 mRNA after transfection of miR-206 mimics
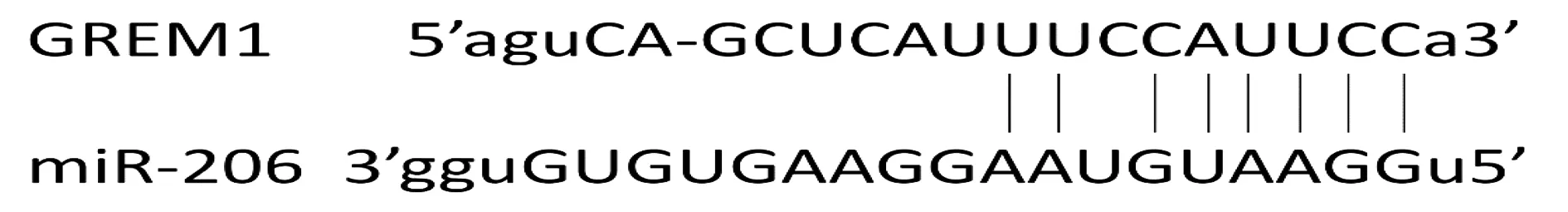
图9 GREM1和miR-206之间的互补结合区域Figure 9 The complementary binding region between GREM1 and miR-206

与mimic NC+vector比较,*P<0.05;与miR-206 mimics+vector比较,#P<0.05图10 miR-206靶向GREM1对鼻咽癌细胞迁移能力的影响Figure 10 Effect of miR-206 targeting GREM1 on the migration ability of nasopharyngeal carcinoma cells
3 讨论
肿瘤细胞和正常细胞之间的miRNA表达存在差异,miRNA的功能障碍可能导致多种人类疾病,如癌症、免疫功能障碍和代谢紊乱等,在其细胞分化、增殖、迁移和凋亡中发挥着重要的调节作用[14]。迄今为止,多项研究已经观察到miRNA在鼻咽癌细胞增殖与转移中发挥重要调控作用。如miR-18a过表达可以增强鼻咽癌细胞的放疗敏感性,其机制与其抑制ATM表达,去除G1/S和G2/M期阻滞,诱导细胞自噬和凋亡有关[15];miR-135b-5p靶向SIRT1抑制c-JUN去乙酰化,增加MMP7表达,实现促进鼻咽癌细胞迁移和侵袭[16]。
本研究发现,与正常组织和细胞相比,NPC细胞系中miR-206的表达水平降低,表明miR-206在鼻咽癌中可能发挥抑癌作用。一个miRNA可以调控人类基因组中的多个基因[17]。以前的研究已经确定了miR-206的几个靶点,如在增殖性血管瘤中下调miR-206的表达可靶向调节DNMT3A的表达,抑制肿瘤的恶性进展;在鼻咽癌组织和细胞中,G6PD被鉴定为miR-206的直接靶基因,miR-206通过直接靶向鼻咽癌细胞中G6PD mRNA的3′-UTR来调节细胞的迁移、侵袭能力和上皮间充质化[18,19]。本次研究中,我们基于生物信息学技术分析发现,与正常组织相比,鼻咽癌组织中miR-206低表达,GREM1高表达。通过上调miR-206的表达可以显著降低GREM1的表达水平。因此我们推测,GREM1可能是miR-206的潜在下游靶点。
GREM1已被证实在大肠癌、乳腺癌、胶质瘤等多种癌症中扮演重要角色,与肿瘤细胞的增殖、迁移和侵袭能力密切相关[20-22]。本次研究发现,GREM1可与miR-206共同作用于鼻咽癌细胞的增殖、迁移及上皮细胞-间充质转化。EMT是一种动态且可逆的细胞过程,其特征在于细胞极性和细胞内连接的丧失以及间充质特征的获得,这有助于肿瘤的发展和转移[23,24]。本次研究中,上调GREM1的表达后,鼻咽癌HNE1和CNE2细胞的迁移能力显著增强。而上调miR-206表达可以下调细胞中上皮标志物N-钙黏蛋白N-catenin和间充质标志物波形蛋白Vimentin的表达,并能显著抑制细胞的迁移能力。miR-206表达的上调能抑制鼻咽癌细胞的增殖、迁移,并在一定程度上逆转鼻咽癌细胞的EMT。
综上所述,上调miR-206的表达水平可以负调控GREM1的表达从而实现抑制NPC细胞的增殖、迁移及EMT进程。miR-206和GREM1可能是未来临床诊治鼻咽癌的一个潜在的靶点。
