贺兰山东坡不同海拔典型植被带土壤微生物磷酸脂肪酸分析
2022-08-03马进鹏庞丹波万红云陈高路李学斌
马进鹏,庞丹波,陈 林,万红云,陈高路,李学斌,*
1 宁夏大学西北退化生态系统恢复与重建教育部重点实验室,银川 750021 2 宁夏大学西北土地退化与生态恢复国家重点实验室培育基地,银川 750021 3 宁夏大学农学院,银川 750021 4 宁夏大学生态环境学院,银川 750021
土壤微生物作为土壤生态系统的重要组成成分,在土壤形成、发育和土壤养分转化等方面发挥重要作用[1],此外,土壤微生物也被认为是评价土壤质量的重要指标[2]。森林生态系统作为陆地生态系统的重要组分,其功能很大程度上依赖于植物与土壤生物之间的相互关系,其中土壤微生物的数量多、生物量大、多样性高[3],在陆地生态系统的生物地球化学循环中具有不可替代的作用[4]。植物-微生物相互作用是土壤养分循环、能量流动等生态系统过程的重要驱动力,植物群落特征及多样性对土壤微生物群落组成存在很大影响[5]。
在山地森林生态系统中,海拔变化很大程度上改变了土壤微环境,是影响土壤微生物组成和多样性的重要因素[6],近年来受到越来越多的学者关注。王颖等[7]研究青藏高原高寒草甸海拔4300—5100m土壤微生物群落结构,发现在中部海拔地区(4800m)土壤微生物多样性及微生物活性最高,表明土壤微生物多样性是多因素综合结果。孟苗婧等[8]采用PLFA法研究海拔的变化对凤阳山土壤微生物群落的影响,发现海拔变化引起土壤性质的改变,对土壤微生物相对丰度影响程度不同。进一步说明,不同的微生物类群在不同的海拔适应程度不同。冯晓川等[9]利用高通量测序技术分析庐山国家级自然保护区森林土壤细菌群落特征,发现细菌群落多样性沿海拔并未表现出差异。可见在不同研究区域土壤微生物特征有较大差异,一定区域土壤微生物的研究能很好的揭示该区域生态系统功能的稳定性。早期刘秉儒等[10—11]利用Biolog微平板法和磷酸脂肪酸甲酯法系统的研究了贺兰山不同海拔植被带微生物群落特征及分布规律,而对贺兰山自然保护区局部区域土壤微生物群落的定量分析研究较少。土壤微生物群落功能及多样性在维持生态系统功能和稳定、土壤质量检测、植被恢复等方面起着重要作用[12],由此可见,研究贺兰山自然保护区东坡土壤微生物群落特征及多样性具有十分重要的科学意义。
贺兰山是我国西北地区的一道生态屏障[13],是我国重要的气候和植被过渡带,山地植物群落垂直分异明显[14],随着海拔升高,依次有荒漠化草原、山地疏林草原、山地针叶林和亚高山灌丛草甸或高山草地等植被类型[10]。贺兰山自然保护区东坡植被面积差异较大、优势度高、植被景观连通性好[15]。本研究选取海拔1300—2500m之间5个典型植被带,采用PLFA法测定土壤微生物群落组成及多样性,旨在为贺兰山自然保护区东坡的管理提供科学依据。
1 材料与方法
1.1 研究区概况
贺兰山位于阿拉善高原和银川平原之间(地处北纬38°27′—39°30′,东经105°41′—106°41′之间),山体孤立,主峰海拔3556m。由于地处典型大陆性气候范围,具有明显山地气候特征,年均气温-0.8℃,年均降水量420mm,年均蒸发量2000mm,降水量具有明显垂直分异现象,平均每上升100m,降水量增加13.2mm,降水量主要集中6—8月份,占全年降水量的60%—80%。贺兰山东坡植被有明显垂直分布规律,从上至下依次为高山草甸、山地针叶林、山地疏林草原和荒漠化草原[16—17]。
1.2 样品采集
于2020年7月中旬在贺兰山东坡海拔1300—2500m之间,沿海拔选取以短花针茅为建群种的荒漠草原(HM),以蒙古扁桃为建群种的山地旱生灌丛(MG),以油松为建群种的温性针叶林(YS),以油松、杜松、山杨为优势种的针阔混交林(HJ),以青海云杉为建群种的寒温针叶林(QH)等5种典型植被带,每个植被带内选取海拔1380、1650、2139、2249、2438m,按等高线设置3个取样点(样地基本情况见参考文献[18]),每个取样点去除地表枯落物和腐殖质或剥离表土后用直径4cm的土壤取样器按五点取样法取0—10cm土壤样品5个,混合后作为该样点土壤样品并用自封袋密封后装入冰盒带回实验室。去除土壤样品中的植物根系和石块,过2mm筛后分成2份,1份放入-80℃冰箱进行土壤微生物测定,另1份自然风干进行土壤理化性质测定。
1.3 测定方法1.3.1 土壤理化性质测定
采用pH计测定土壤pH;采用烘干法测定土壤容重(BD);采用环刀法测定土壤含水量(WC);采用重铬酸钾外加热法测定土壤有机碳(SOC);采用凯氏定氮法测定土壤全氮(TN);采用HClO4-浓H2SO4外加热消煮法、分光光度法测定土壤全磷(TP)[19]。
1.3.2土壤微生物群落结构测定
采用磷酸脂肪酸(PLFA)法[20]测定土壤微生物群落组成,用修正的Bligh-Dyer法进行脂类提取和磷脂脂肪酸分析;土样用体积比为1∶2∶0.8的氯仿∶甲醇∶柠檬酸缓冲液振荡提取总脂类,然后经SPE硅胶柱分离得到磷脂脂肪酸,将得到的磷脂脂肪酸进行碱性甲醇化,用Agilent 6890N气相色谱仪分析PLFA的成分,内标为正十九烷酸甲酯(19∶0)[21],含量用nmol/g表示。
1.3.3磷酸脂肪酸的命名
脂肪酸链长以碳原子总数计算,从羧基开始,冒号后数字代表双键数目,ω后数字代表双键的位置(从羧基端算起)。c表示顺式双键,t表示反式双键,i表示顺式支链,a表示反式支链,br表示不确定支链位置,Me表示甲基位置,cy表示环丙基。由于不同菌群的PLFA特征图谱不同,在高度专一性基础上具有多样性,因此可以作为微生物群落中不同群体的标记物[22]。磷脂的不同可以说明土壤样品中微生物群落结构的不同,进一步对微生物进行识别和定量描述,为进一步研究提供信息。脂肪酸12:0,13:0,14:0,15:0,16:0,22:0,24:0等表示细菌;i13:0,a13:0,i14:0,a14:0,i15:0,a15:0,i17:1ω9c,i15:1ω6c等表示革兰氏阳性细菌(G+);14:1ω5c,16:1ω7cDMA,17:1ω8c,17:0cyclo ω7c,19:0cyclo ω7c,10:0 2OH,16:0 2OH等表示革兰氏阴性细菌(G-);18:1ω9c,21:0,23:0,18:2w6c等表示真菌;10Me 17:0,10Me 18:1ω7c,10Me 19:1ω7c,10Me 17:1ω7c,10Me 18:0等表示放线菌;20:4ω6c,20:3ω6c,20:5ω3c,19:3ω6c等表示原生动物[23—29]。
1.4 数据处理
用Excel进行数据处理,用SPSS进行方差分析(ANOVA)(P<0.05)(选择最小差异性显著(LSD)检验),用Origin 2018进行聚类分析(cluster analysis)(选择欧氏距离-最小距离法系统聚类)、相关性分析和绘制热图,用Canoco5进行主成分分析(PCA)。
微生物多样性分析采用Shannon-Wiener(H)、Brillouin多样性指数(B)和Pielou均匀度指数(J)、Simpson优势度指数(D)、Mcintosh多样性指数(M)等方法。
(1)Shannon-Wiener多样性指数(H),计算公式为:
H=-∑PilnPi
(1)
式中,Pi=Ni/N,Ni为处理i的特征脂肪酸个数,N为实验中总特征脂肪酸个数。
(2)Brillouin多样性指数(B),计算公式为:
(2)
式中,n1为第1个PLFAs生物标记的个体数量,n2为第2个PLFAs生物标记的个体数量,ni为第i个PLFAs生物标记的个体数量,N为所有处理中PLFAs生物标记出现的个体总和。
(3)Pielou均匀度指数(J),计算公式为:
J=-∑PilnPi/lnS
(3)
式中,S为群落中PLFA总数。
(4)Simpson优势度指数(D), 计算公式为:
D=1-∑Pi2
(4)
式中,Pi为i种特征PLFA占该试验中总的特征脂肪酸个数比例。
(5)Mcintosh多样性指数(M),计算公式为:
(5)
式中,N为特征PLFA总数。
2 结果分析
2.1 不同海拔植被带土壤基本性质的比较
分析不同海拔土壤因子(图1),可以得出土壤有机碳(SOC)、土壤全氮(TN)、土壤全磷(TP)、pH、土壤容重(BD)、土壤含水量(WC)在不同海拔植被带之间差异性显著(P<0.001),其中SOC、TN、WC均随海拔升高而增大,pH、BD随海拔升高而降低。
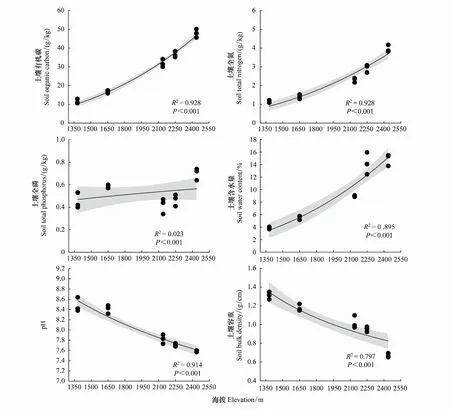
图1 不同海拔植被带土壤理化性质Fig.1 Physical and chemical properties of soil in typical vegetation types at different altitudes
2.2 不同海拔植被带土壤微生物PLFA含量比较
从不同海拔植被带土壤中共检测到59种PLFA生物标记(表1)。其中HM土壤中PLFA生物标记有50种,总含量为(57.99±5.31)nmol/g,MG土壤中PLFA生物标记有56种,总含量为(84.58±28.73)nmol/g,YS土壤中PLFA生物标记有55种,总含量为(96.64±16.78)nmol/g,HJ土壤中PLFA生物标记有54种,总含量为(83.97±38.52)nmol/g,QH土壤中PLFA生物标记有57种,总量为(86.02±21.75)nmol/g。不同海拔植被带土壤微生物的PLFA种类差别不大,而不同类型微生物的PLFA含量有明显差异,YS土壤中PLFA生物标记总含量最高,QH土壤中PLFA生物标记种类最多,每种类型土壤中均有不同的生物标记,代表着不同类型的微生物。在5种植被带土壤中完全分布的PLFA生物标记有49种,而有些PLFA生物标记只在某种植被带土壤中有分布,属于不完全分布,此类PLFA生物标记有10种,如生物标记13:0,21:0,10Me 19:1ω7c仅在HM土壤中未出现,i19:0仅出现在MG和QH土壤中,15:1ω6c仅出现在YS和HJ土壤中,17:0 DMA仅出现在QH土壤中,10:0 2OH,16:0 2OH仅在HM和HJ土壤中未出现,10:0 3OH仅出现在HJ和QH土壤中,18:2 DMA仅出现在HM和MG土壤中。
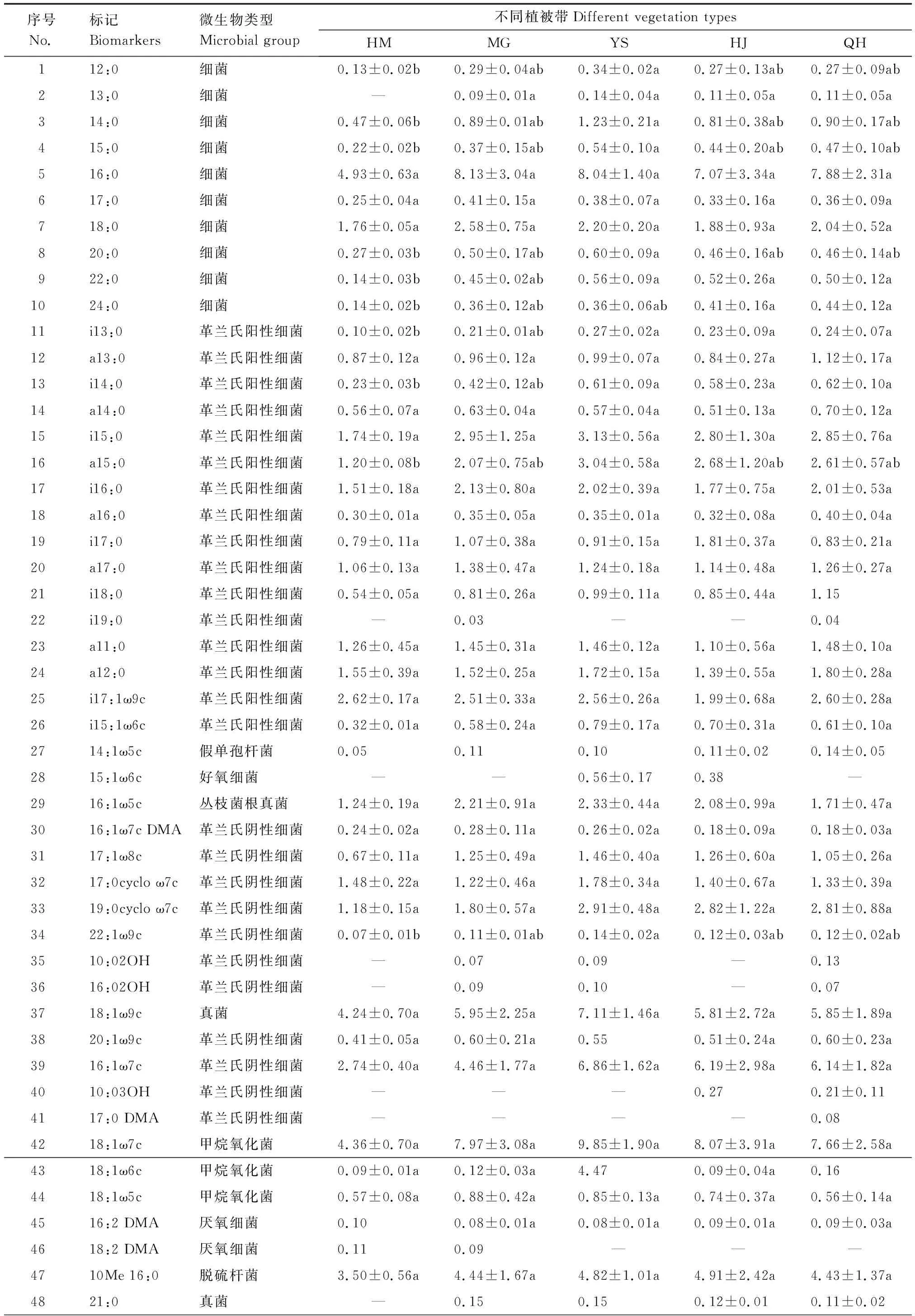
表1 不同海拔植被带土壤微生物的PLFA类型及含量/(nmol/g)Table 1 Types and contents of PLFA in soils with different vegetation
5种植被带土壤微生物中PLFA生物标记含量较高的是16:0,18:0(细菌),i15:0,i16:0,a15:0,a17:0,a11:0,a12:0,i17:1ω9c(G+),16:1ω5c(丛枝菌根真菌),17:0cyclo ω7c,19:0cyclo ω7c,16:1ω7c(G-),18:1ω9c(真菌),18:1ω7c(甲烷氧化菌),10Me 16:0(脱硫杆菌/放线菌),18:2ω6c(腐生真菌),10Me 18:0(放线菌),在土壤PLFA生物标记总量中占有一定优势,所占百分比依次为80.29%,78.27%,75.40%,79.17%,78.61%,说明其在土壤中起主要作用。由此可见在不同的海拔植被带土壤中微生物的种类和含量存在差异,表明不同的土壤环境中微生物起着不同的作用。
2.3 不同海拔植被带土壤特征微生物类群PLFA含量比较
不同海拔植被带土壤特征微生物PLFA含量存在差异,总含量及其相互之间比值(图2)。可见土壤微生物中细菌的种类最多且含量最高,其次是真菌和放线菌,而原生动物的含量相对较少。细菌、真菌之间,革兰氏阳性细菌、革兰氏阴性细菌之间PLFA含量有明显差异,相互之间比值较大。YS土壤中真菌、细菌、原生动物、放线菌PLFA含量最多,而HM土壤中含量最低,革兰氏阳性细菌PLFA含量表现为YS>MG>QH>HJ>HM,革兰氏阴性细菌表现为YS>HJ>QH>MG>HM。真菌/细菌表现为YS>HJ>QH>MG>HM,革兰氏阳性细菌/革兰氏阴性细菌表现为HM>MG>QH>YS>HJ。
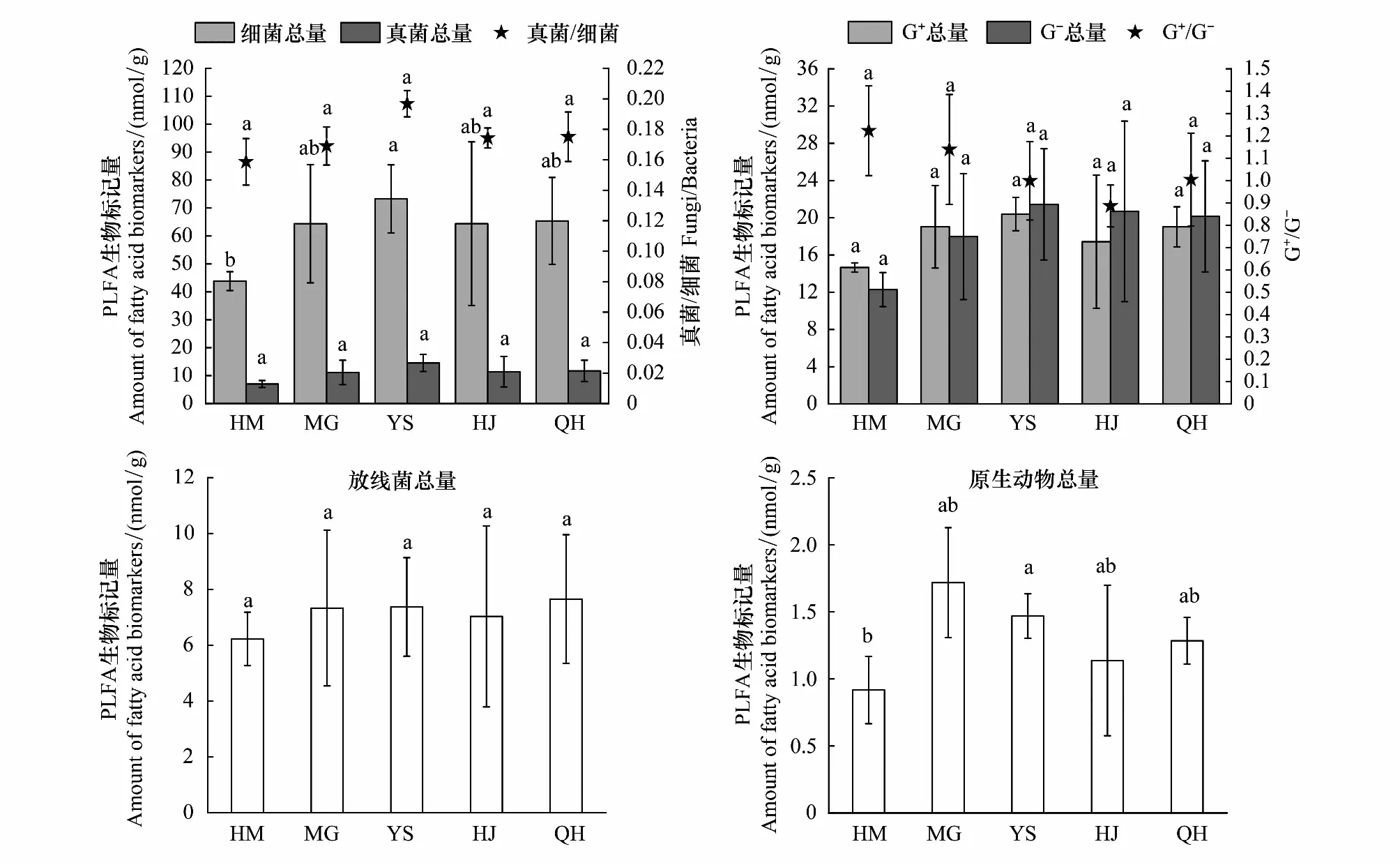
图2 不同海拔植被带土壤中的特征微生物类群PLFA总量(nmol/g)及比值Fig.2 Contents and ratio of Microbial groups PLFA in soils with different vegetationHM:荒漠草原 Desert steppe;MG:蒙古扁桃 Amygdalus mongolica (maxim) ricker;YS:油松林 Pinus tabulaeformis forest;HJ:混交林 Mixed forest;QH:青海云杉林 Picea crassifolia Kom forest
2.4 不同海拔植被带土壤微生物群落结构比较
以不同海拔植被带土壤中PLFA标记的生物量为指标构建矩阵,以欧式距离为尺度,用最小距离法进行系统聚类分析(图3)。不同植被带的土壤PLFA生物标记可分成不同的类群。如表征甲烷氧化菌的18:1ω7c和18:1ω6c,表征非特异性细菌的16:0,表征脱硫杆菌的10Me 16:0,表征革兰氏阴性细菌的16:1ω7c,表针真菌的18:1ω9c和腐生真菌的18:2ω6c,其特征表现为完全分布且含量高,剩余的生物标记则表现为分布不完全且含量低。可以看出在不同的海拔植被带下有的微生物类群组成和含量并不会随环境变化而发生变化,而有的微生物类群可能更适合在某种特定的环境条件下生存。
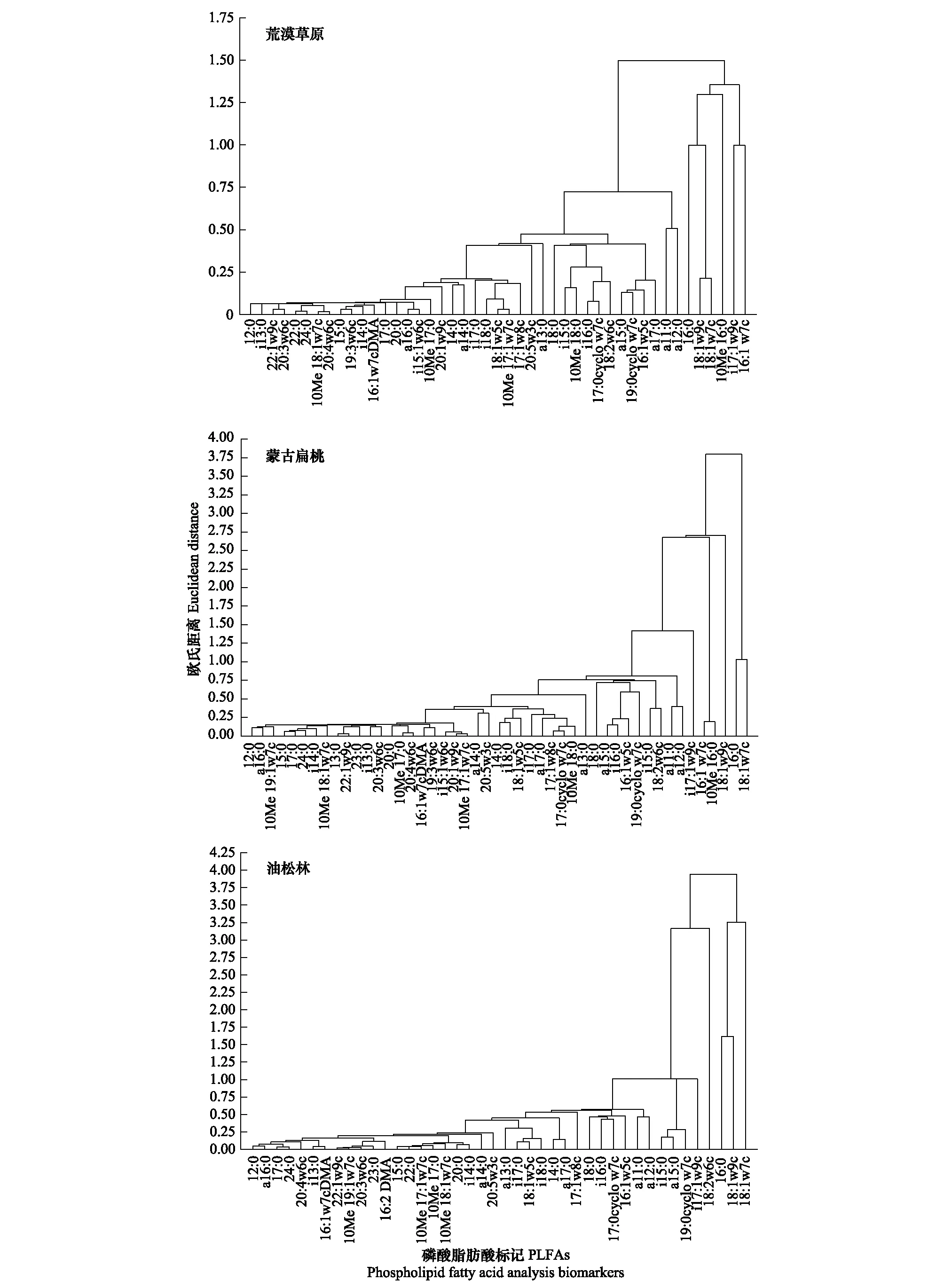
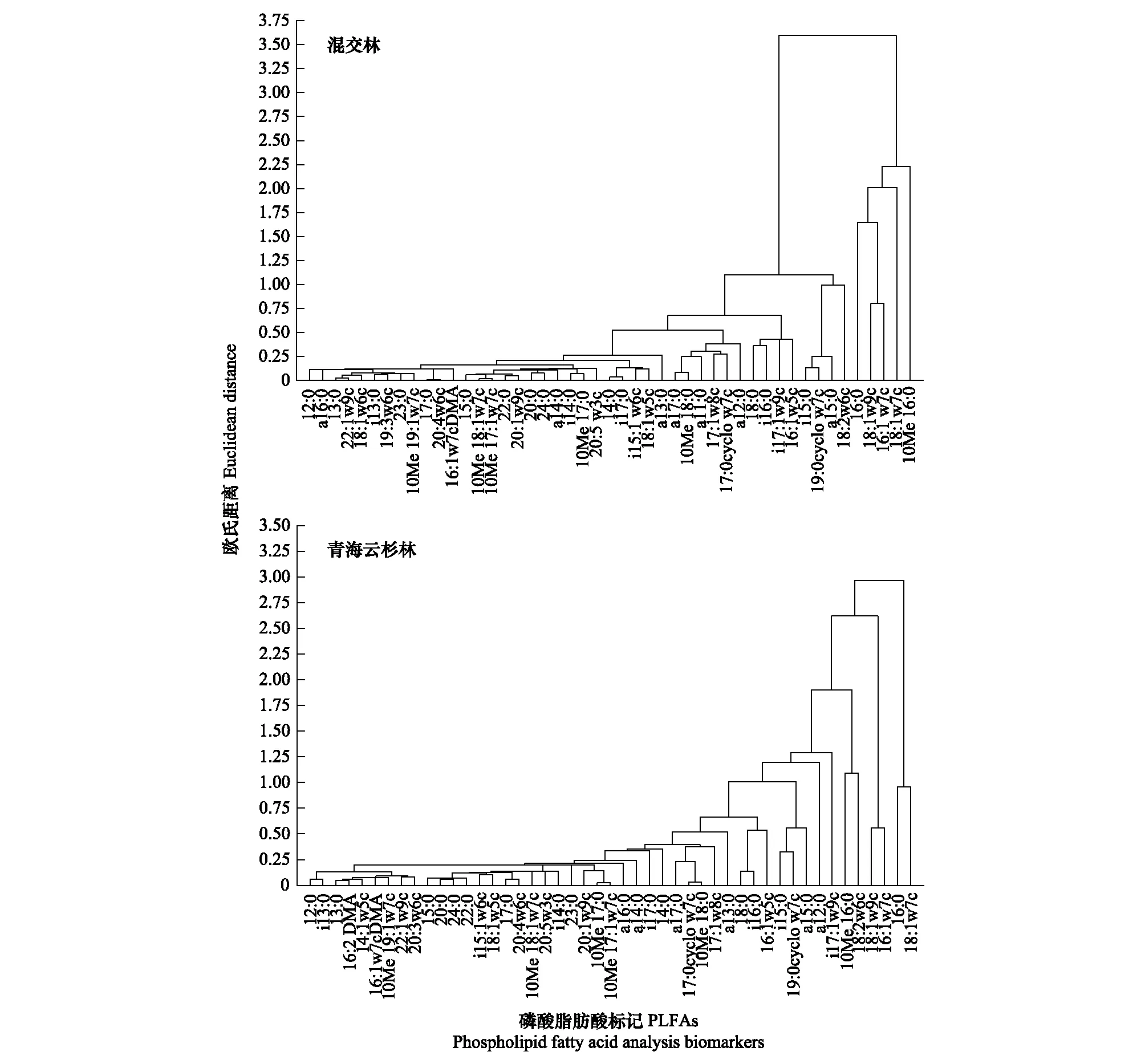
图3 不同海拔植被带土壤微生物群落PLFAs生物标记的聚类分析Fig.3 Cluster analysis of PLFAs biomass of microbial community in soils with different vegetation
选取不同海拔植被带共有的PLFA生物标记含量绘制热图(图4),由图可知不同的PLFA生物标记在不同的海拔植被带分布不同,有的PLFA生物标记在某一植被带的含量明显高于其他植被带,可见其表征的微生物在该区域有着更好的生境条件,整体可以看出在YS土壤中PLFA生物标记含量要高于其他植被带。
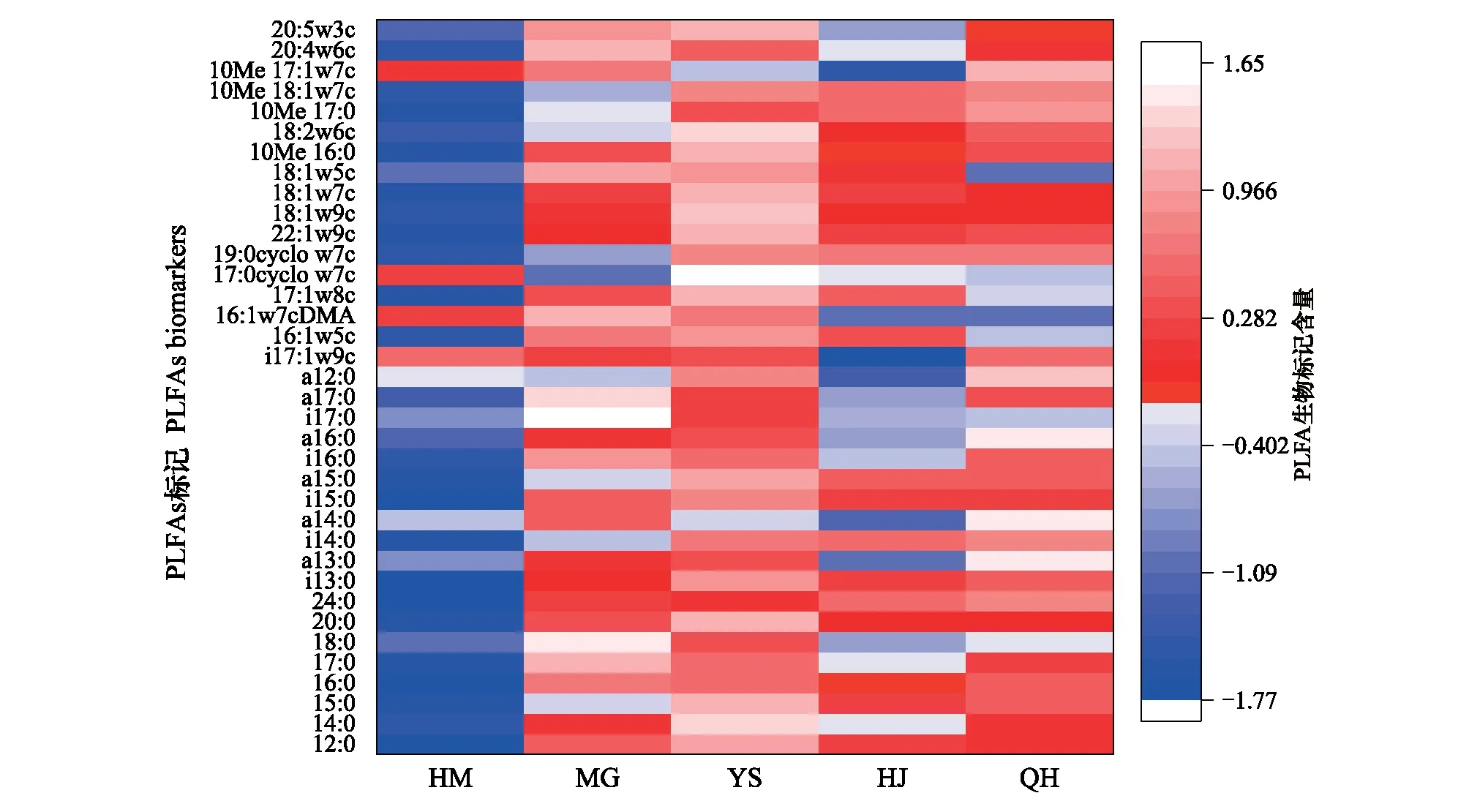
图4 不同海拔植被带土壤微生物群落PLFAs生物标记热图Fig.4 Heatmap of PLFAs biomass of microbial community in soils with different vegetation
2.5 不同海拔植被带土壤微生物群落多样性指数
不同海拔植被带土壤微生物群落多样性指数(表2),在Shannon-Wiener多样性指数上HJ要高于其海拔植被带,在Brillouin多样性指数上QH和HJ要高于其他海拔植被带,从均匀度指数看HJ要高于其他海拔植被带,在Simpson多样性指数上HJ要高于其他海拔,在Mcintosh多样性指数上HJ高于其他海拔植被带。
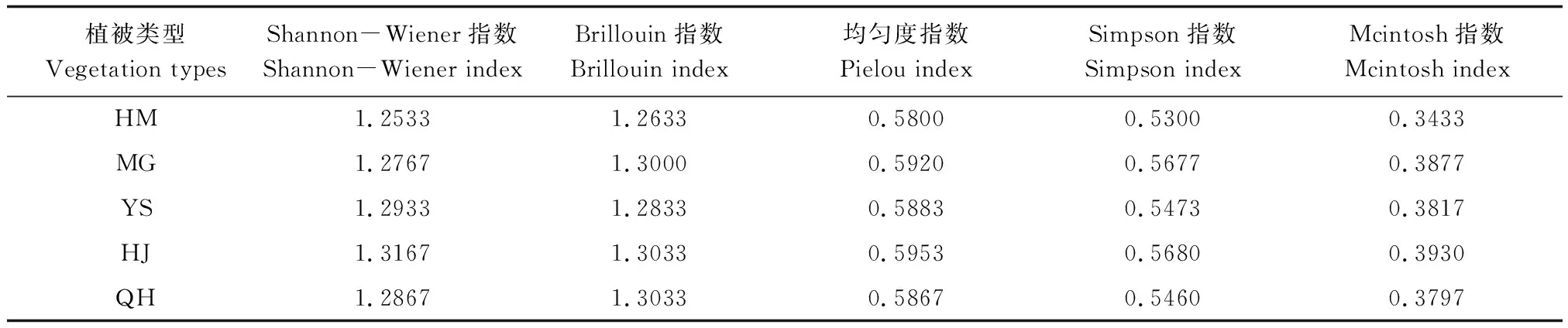
表2 不同海拔植被带土壤微生物类群多样性指数Table 2 Soil microbial communities′ diversity indices in soils with different vegetation
2.6 不同海拔植被带土壤PLFA种类、含量及多样性指数相关分析
对不同海拔植被带土壤PLFA种类、含量及多样性指数Pearson相关性分析(表3),PLFA种类与PLFA含量和Brillouin指数显著正相关;PLFA含量与Brillouin指数显著正相关;Shannon-Wiener指数与均匀度指数、Simpson指数和Mcintosh指数显著正相关;均匀度指数和Simpson指数均与Mcintosh指数显著正相关。
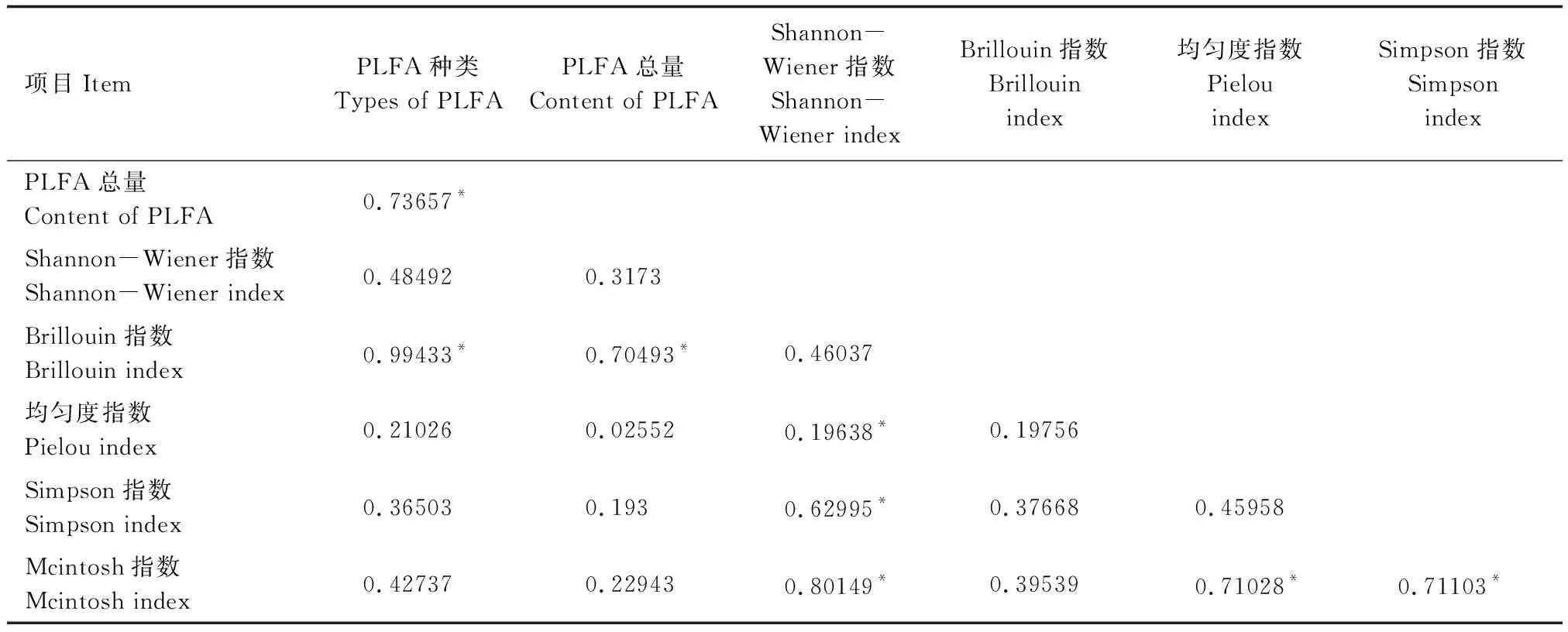
表3 土壤PLFA生物标记种类、含量及微生物多样性指数Pearson相关性分析Table 3 Pearson′s correlation analysis of soil PLFA biomarker species, content and microbial diversity index
2.7 不同海拔植被带土壤微生物类群分析
由不同海拔植被带特征土壤微生物类群主成分分析(图5)表明,与土壤微生物群落相关的2个主成分累计贡献率为86.81%,其中,第1主成分(PC1)和第2主成分(PC2)解释量为78.01%和8.80%,对第1主成分起主要作用的微生物类群有非特异性细菌、革兰氏阳性细菌、革兰氏阴性细菌、真菌、放线菌和原生动物等,对第2主成分起主要作用的微生物类群为厌氧细菌。不同海拔植被带土壤微生物类群分布在主成分坐标平面的不同位置,可见不同海拔植被带的土壤微生物群落存在差异。取样点距离的远近代表着取样点微生物群落结构的相似程度,距离越近则相似度越高,可见HM土壤微生物群落结构与MG、QH和YS土壤微生物群落结构相似度高,HJ土壤微生物群落结构与其他植被带土壤微生物群落结构相似度低。
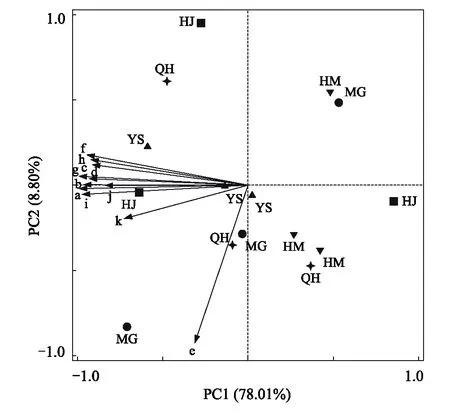
图5 不同海拔植被带土壤微生物群落主成分分析 Fig.5 Principal components analysis of different microbial group′s PLFA in soils with different vegetationa:非特异性细菌 Nonspecific bacteria;b:革兰氏阳性细菌 Gram-positive bacteria;c:革兰氏阴性细菌 Gram-negative bacteria;d:甲烷氧化菌 Methanotrophs bacteria;e:厌氧细菌 Anaerobic bacteria;f:脱硫杆菌 Thiobacillus;g:真菌 Fungi,h:腐生真菌 Saprophytic fungi;i:丛枝菌根真菌 Arbuscular mycorrhizal fungi;j:放线菌 Actinomycetes;k:原生动物 Protozoa
2.8 不同海拔植被带土壤微生物含量及多样性指数与土壤因子的关系
对不同海拔土壤性质与土壤微生物类群及多样性指数进行相关性分析(图6),发现海拔及各土壤因子对微生物类群及多样性指数影响并不显著,其中海拔与腐生真菌有显著正相关关系,海拔、SOC、TN与微生物类群及多样性指数正相关,pH、BD与微生物类群及多样性指数负相关。可见海拔的变化引起土壤微环境的改变,对土壤微生物的群落组成及多样性存在影响。
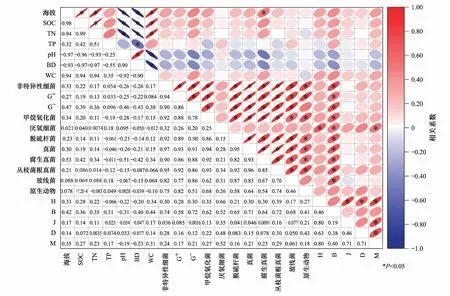
图6 不同海拔植被带土壤微生物含量及多样性指数与土壤因子的相关性分析Fig.6 Correlation analysis between soil microbial content, diversity index and soil factors with different altitude vegetationSOC: 土壤有机碳 Soil organic carbon; TN: 全氮 Total nitrogen; TP: 全磷 Total phosphorus; BD: 容重 Bulk density; WC: 土壤含水量 Water content; G+: 革兰氏阳性细菌 Gram-positive bacteria; G-: 革兰氏阴性细菌 Gram-negative bacteria;H: Shannon-Wiener指数 Shannon-Wiener index; B: Brillouin多样性指数 Brillouin index; J: Pielou均匀度指数 Pielou index; D: Simpson优势度指数 Simpson index; M: Mcintosh多样性指数 Mcintosh index
3 讨论
3.1 不同海拔植被带土壤微生物含量变化特征
土壤微生物群落组成及多样性既可以反映土壤的生物活性也可以反映土壤的生态胁迫机制[30]。本研究
运用PLFA法定量研究了贺兰山自然保护区东坡不同海拔植被带土壤微生物群落结构及多样性,从不同海拔植被带共检测出59种PLFA生物标记,发现QH土壤中PLFA生物标记的种类最大,YS土壤中PLFA生物标记的含量最大。赵银[31]研究了青藏高原高寒草甸土壤微生物群落共检测出70种PLFA生物标记;郑洁[24]研究闽江口红树林土壤微生物群落共检测出22种PLFA生物标记;吴则焰等[32]研究了武夷山不同海拔植被带土壤微生物群落多样性共检测出25种PLFA生物标记;可见贺兰山自然保护区东坡土壤中PLFA生物标记种类较多,间接反映出自然保护区微生物较为丰富,这与刘秉儒等[10]研究的贺兰山不同海拔典型植被带土壤微生物多样性所检测出28种PLFA生物标记的结果有所差异,微生物对环境的变化极为敏感,其差异原因可能与采样点的选择及测定方法存在不一有关。在不同海拔植被带土壤中,除了PLFA生物标记的种类和含量不同之外,研究发现特征微生物的含量也存在差异,细菌含量最大,其次是真菌、放线菌,原生动物含量最小。随着海拔的升高土壤微生物的含量先升高后降低,在YS土壤中微生物含量最高,可见随着海拔的升高,温度降低,湿度增加[15],在该植被带较好的水热生存条件是微生物含量高的主要原因。QH植被带有着较厚的凋落物层,凋落物作为微生物生存所需能量来源的主要提供者,较厚的凋落物层增加了土壤-微生物之间的协同作用,这可能是该植被带PLFA生物标记种类多的原因[33]。
3.2 不同海拔植被带土壤微生物结构及多样性特征
G+和G-是细菌群落的两大主要类群,G+/G-可以反映细菌群落的多样性特征,同时其还可以表征土壤肥力[34],研究发现HJ土壤中G+/G-最小说明该植被带营养胁迫小,这与该植被带丰富的物种多样性有很大关系,产生的丰富凋落物为微生物提供了更多资源条件[35]。真菌和细菌作为土壤微生物最主要的类群,真菌/细菌可以间接反应土壤微生物的生存环境[36],研究表明在YS土壤中中真菌和细菌含量高于其他植被带,同时真菌/细菌最大,这与刘秉儒等[10]研究结果发现贺兰山在海拔1900—2100m处真菌含量最高的结果一致,也有研究[17]发现贺兰山东坡YS土壤微生物熵最大,而微生物熵可以反映土壤有机质的输入量、微生物碳的转化速率及土壤质量好坏,这也进一步说明该海拔植被带环境条件更适合土壤微生物生存[37]。
目前应用较广的微生物多样性指数,如Shannon-Wiener多样性指数、均匀度指数和Mcintosh多样性指数等,基本可以表示土壤微生物多样性的特征[38]。研究发现贺兰山自然保护区东坡不同海拔植被带微生物多样性指数在HJ植被带中最大,HJ植被带中植物群落类型多样,而植物物种组成及多样性能够明显改变土壤微生物的群落结构及多样性,同时HJ植被带中丰富的凋落物层为土壤微生物提供生存所需的物质和能量,这是该海拔植被带微生物多样性高的主要原因[23,39]。研究发现某些表征微生物的PLFA生物标记在各植被带含量较高,说明其并不会因为环境改变而发生变化,表明其在植被带土壤中起主要作用[22]。而有的PLFA生物标记在某一植被带含量明显高于其他植被带,说明其表征的微生物在该植被带有独特的作用[32]。不同海拔植被带土壤微生物多样性及其变化能很好指示该区域森林生态环境和系统功能变化,进一步为自然保护区土壤微生物的研究提供依据。
3.3 不同海拔植被带土壤微生物群落及多样性与土壤因子的关系
山地森林生态系统中,海拔的变化会导致温度、降水等气候因子的急剧变化[8],而微生物对环境变化极为敏感,研究发现SOC、TN与微生物群落及多样性正相关,pH、BD与微生物群落及多样性负相关,这与谷晓楠等[35,37]研究结果相似,森林生态系统中土壤有机碳与土壤全氮关系密切,同时土壤C、N为微生物提供能源,促进植物对养分的吸收利用。Tan等[40]和Lauber等[41]研究发现土壤全磷含量的变化会影响土壤细菌及真菌群落的多样性。也有研究表明[42],植被类型、凋落物性质、土壤物理性质等对土壤微生物群落结构及多样性有显著影响。由此可见,一定区域土壤微生物群落结构及多样性受多因素综合影响[43]。
4 结论
采用磷酸脂肪酸(PLFA)法定量分析贺兰山自然保护区东坡不同海拔植被带土壤微生物PLFA的种类和含量。YS植被带土壤微生物PLFA的总量以及特征微生物的含量最大,表明贺兰山自然保护区东坡在YS植被带具有更适合微生物生存的环境,这也符合山地生态系统中中部区域生物多样性高的理论。
研究自然保护区东坡不同海拔植被带土壤微生物多样性发现不同植被带土壤PLFA生物标记聚类不同,16:0、18:1ω9c和18:1ω7c基本在每个植被带都会单独聚为一类,可知其在该植被带含量高且有独特作用。多样性指数显示HJ植被带土壤微生物多样性更高,说明植物多样性与土壤微生物多样性密切相关。可见不同海拔植被带土壤微生物群落结构及多样性存在差异,可为贺兰山东坡自然保护区的高质量管理提供理论依据。
