Nckα基因沉默对上皮性卵巢癌细胞恶性生物学行为的影响
2022-08-03周颖,高天
周 颖, 高 天
(1.海南省东方市东方医院, 海南 东方 572600 2.重庆医科大学附属第一医院, 重庆 400016)
卵巢癌在我国发病率高,死亡率也高居女性恶性肿瘤榜首。据临床数据统计显示,因卵巢结构及症状隐匿等特点,多数卵巢癌患者发病时已进展至中晚期,导致患者预后不良[1]。肿瘤复发或转移是威胁卵巢癌患者术后生存质量的首要问题[2]。肿瘤在发生转移时肿瘤细胞会随淋巴循环及血液循环游走至其他部位,产生新的肿瘤灶[3]。已有报道指出,在多种恶性肿瘤侵袭、迁移过程中有Nck的参与[4]。因此本次研究特对Nckα基因沉默时上皮性卵巢癌细胞侵袭、迁移能力及相关蛋白表达情况进行分析,为上皮性卵巢癌治疗提供新的参考思路。
1 资料与方法
1.1实验材料
1.1.1实验细胞:选择上皮性卵巢癌SKOV3细胞株、OVCAR-3细胞株以及正常卵巢上皮细胞IOSE-80细胞株,本次研究所用细胞均购于南京科佰生物科技有限公司。
1.1.2组织样本:取正常、良性病变、卵巢癌组织切片,本次研究所使用切片均来自本院接受卵巢疾病治疗患者组织样本,正常卵巢组织切片为良性疾病切除附件。
1.1.3实验动物:本次研究选用4~6周龄BALB/C雄性大鼠10只,所有动物均进行为期一周的适应性饲养,用于后期实体瘤实验。
1.1.4实验试剂:枸橼酸盐(美国BD),DAB显色液(上海赛默飞世尔科技),中性树胶(美国ATGene),兔抗Nckα多克隆抗体(美国Sigma),多聚甲醛(武汉博士德),蛋白提取试剂盒(美国ATGene),冰醋酸(上海碧云天),结晶紫(江苏凯基生物)等。
1.1.5实验仪器:移液枪(德国Eppendorf),电泳仪、发光图像分析仪(美国Bio-rad),显微镜(日本蔡司),孵育箱(海尔生物医疗),离心机(贝克曼中国分公司)等。
1.2方 法
1.2.1免疫组化:取组织样本进行免疫组化反检测,恒温烤片,经脱蜡水化处理,抗原修复滴加枸橼酸,滴加阻断剂,10min孵育,滴加山羊血清,15min,反应结束后弃上清,滴加一抗,以PBS作为阴性对照,过夜孵育,PBS冲洗,滴加二抗,15min孵育,冲洗后滴加工作液,15min,冲洗后滴加显色液,镜下观察染色情况,待细胞出现棕黄色着色后终止染色,加苏木素复染,自来水冲洗终止,碳酸锂返蓝,中性树胶封片,镜下观察染色情况。细胞内出现棕黄色染色为阳性。
1.2.2细胞培养:复苏冻存细胞进行培养,待贴壁后进行传代,弃原培养基,冲洗后常规消化,5% CO2,37℃环境内孵育3min,观察细胞消化情况,待完全消化后弃上清,加培养基重悬,1000r/min离心,5min后收集沉淀,再次加培养基重悬,继续培养,对细胞增殖情况进行观察,根据需求可对传代培养后细胞进行冻存,滴加冻存液,置于-80℃环境内存储。
1.2.3细胞分组及干预:空白组:SKOV3、OVCAR3正常培养。阴性对照组:SKOV3、OVCAR3均进行对照病毒转染。Nckα基因沉默组:SKOV3、OVCAR3均进行Nckα干扰病毒转染。Nckα高表达组:SKOV3、OVCAR3均进行Nckα过表达病毒转染
1.2.4免疫荧光:取对数生长期细胞,制细胞悬液,二氧化碳浓度5%,37℃培养,观察细胞融合率达80%时进行后续研究,弃培养基PBS冲洗,多聚甲醛固定,冲洗后滴加Triton,5min孵育,避光。弃残液,冲洗后滴加山羊血清,1h避光,滴加一抗,孵育过夜,次日弃上清后PBS冲洗,滴加标记过的二抗,1h避光,冲洗,滴加鬼笔环肽,1h孵育,封片,于镜下对荧光反应情况进行观察。
1.2.5Transwell细胞侵袭、迁移实验:细胞侵袭:提前备好Matrigel基质胶,配置上下室培养液,试验前需对食管癌细胞进行12h饥饿培养,取24孔板,加入含FBS的培养基,将重悬后的待测细胞接种于Transwell小室中,每个小室选择相同细胞数目,培养48h后观察细胞侵袭情况,PBS冲洗小室,苏木素染色,冲洗残液后封片,镜下随机选取5个视野进行观察,采用相关软件计数,判断细胞侵袭能力。细胞迁移:试验前细胞需饥饿培养24h,取24孔板,加入含FBS的培养基,注意避免气泡,选取各组对数期细胞进行常规消化,离心处理,滴加含FBS的培养基进行重悬,并将其接种于Transwell小室中,每个小室细胞数目相同,将各小室放入24孔板中继续培养24h,取出小室进行PBS冲洗,多聚甲醛固定,再次冲洗,苏木素染色,洗净残余染液,裁下聚碳酸酯膜,滴加中性树胶封片,高倍镜下观察细胞情况,并通过相关软件进行数目统计。
1.2.6细胞增殖:采用CCK-8实验进行,胰酶消化待测细胞,取96孔板设置5000个/孔,另设空白对照,滴加培养基进行培养,贴壁后滴加CKK-8试剂,4h孵育,置入酶标仪,对波长450nm处吸光度值进行读取,剩余4个96孔板分别在培养24h、48h、72h以及96h时滴加CCK-8试剂,对450nm波长处吸光度值进行测量。
1.2.7构建皮下移植瘤动物模型:将待测细胞制成悬液,胰酶消化对数期细胞,取沉淀PBS重悬,调整细胞密度,取雌性裸鼠,将细胞悬液与腹股沟处皮下对大鼠进行注射,每只大鼠均一侧注射阴性对照组细胞,一侧注射Nckα沉默组细胞,完成注射后对裸鼠一般情况进行观察,并定期对皮下移植瘤直径进行测量。于接种4周后对所有裸鼠进行处死,分离取出移植瘤,福尔马林固定后制成石蜡切片用于后续研究。
1.2.8皮下移植瘤HE染色:取皮下移植瘤组织切片进行HE染色,烤片,脱蜡水化处理,10min苏木素染色,冲洗残液,滴加盐酸乙醇,碳酸锂返蓝,再次流水冲洗,伊红复染,脱水处理,中性树胶封片,镜下观察染色情况。
1.2.9Western blot检测:取皮下移植瘤组织进行裂解,操作全程于冰上进行,充分裂解后进行12000r/mL高速离心处理,5min,取上清,BCA法测定蛋白浓度,蛋白浓度调节,按比例上样,蛋白加热至变性,进行凝胶、电泳处理。配置浓缩胶,进行电泳、电转处理,取出PVDF膜,采用TBST冲洗,滴加封闭液,滴加一抗4℃过夜孵育,次日滴加二抗,室温孵育1h,采用ECL法进行显影。

2 结 果
2.1免疫组化法分析卵巢组织Nckα表达情况:Nckα主要定位于细胞膜和细胞质,在正常卵巢组织、良性病变卵巢组织、卵巢癌组织中均存在Nckα表达,卵巢癌组织中Nckα阳性细胞更多,具体见图1。
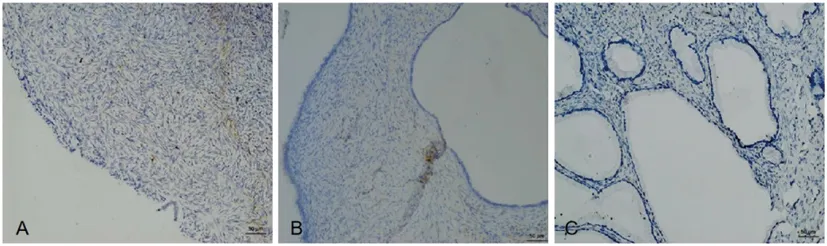
图1 不同卵巢组织免疫组化染色
2.2Nckα基因沉默对卵巢癌SK0V3细胞伪足形成的影响:Nckα基因沉默(SKOV3-shRNA3)时SKOV3细胞形态变钝、变圆,丝状伪足和片状伪足数量明显降低,具体见图2。

图2 卵巢癌SK0V3细胞伪足的免疫荧光染色
2.3Nckα基因沉默对卵巢癌细胞迁移、侵袭能力的影响:通过Transwell小室侵袭实验得出,Nckα沉默卵巢癌SKOV3细胞、OVCAR3细胞穿过包被Matrigel胶细胞数量减少,Nckα过表达卵巢癌SKOV3细胞、OVCAR3细胞穿过包被Matrigel胶细胞侵袭数量增多,见图3。通过Transwell小室迁移实验得出,Nckα沉默卵巢癌SKOV3细胞、OVCAR3细胞穿过聚碳酸酯膜细胞数量减少,Nckα过表达卵巢癌SKOV3细胞、OVCAR3细胞穿过聚碳酸酯膜细胞侵袭数量增多,见图4。

图3 卵巢癌细胞侵袭能力

图4 卵巢癌细胞迁移能力
2.4Nckα基因沉默对卵巢癌细胞增殖能力的影响:通过CCK-8实验得出,在培养48h后三组细胞吸光度差异明显,Nckα沉默卵巢癌SKOV3细胞、OVCAR3细胞吸光度值明显低于对照组,Nckα过表达卵巢癌SKOV3细胞、OVCAR3细胞吸光度值明显高于对照组(P<0.05),见图5。

图5 Nckα基因沉默对卵巢癌细胞增殖能力的影响
2.5Nckα基因沉默作用机制分析:Nckα沉默卵巢癌SKOV3细胞、OVCAR3细胞PI3K p110α、p70S6K、AKT、P-AKT蛋白表达明显低于对照组,Nckα过表达卵巢癌SKOV3细胞、OVCAR3细胞PI3K p110α、p70S6K、AKT、P-AKT蛋白表达明显高于对照组(P<0.05),见图6。

图6 卵巢癌SKOV3及OVCAR3细胞相关蛋白表达水平与NC组相比,*P<0.05
3 讨 论
卵巢癌属于高发女性恶性肿瘤,严重威胁女性健康,在我国卵巢癌的发病率呈现明显升高趋势。目前临床对于卵巢癌的治疗主要是手术治疗并辅以化疗,但是仍有一部分患者会发生复发或转移,甚至会因为化疗耐药而死亡[5]。因此急需寻找更加敏感有效的卵巢癌治疗靶点。目前现有的卵巢癌治疗靶点稳定性差,具有较高的突变频率,导致治疗效果降低,因此在卵巢癌治疗中亟待寻找更加稳定、有效的治疗靶点[6]。肿瘤发生转移的关键因素就包含癌细胞与癌细胞之间粘附性降低,导致癌细胞脱离原发病灶,随淋巴或血液游走至其它器官或组织,形成转移肿瘤[5]。癌细胞定向迁移运动的能力是肿瘤转移的重要因素。曾有学者指出,肌动蛋白的聚合所可谓肿瘤细胞伪足向某一方向延伸提供动力[7]。Nck作为一种在哺乳动物体内广泛表达的衔接蛋白,可以激活下游多种磷酸化蛋白,可参与络氨酸激酶信号传代,属于重要的结合蛋白,参与局部肌动蛋白的聚合,与肿瘤细胞伪足形成之间存在密切联系[8]。本次研究对正常卵巢组织、良性病变卵巢组织以及卵巢癌组织Nckα表达情况进行分析,结果显示,Nckα在卵巢癌组织中呈现高表达状态,提示Nckα可能参与上皮性卵巢癌病变。因此本次研究选择Hckα基因作为研究重点,分析其对相关肿瘤标志物水平的影响,探究其对于肿瘤增殖、迁移的作用机制。
本次研究在对卵巢癌细胞进行免疫组化分析时发现,Nckα基因沉默后卵巢癌细胞伪足数目降低,且细胞形态变钝、变圆,提示Nckα基因沉默可通过干预卵巢癌细胞伪足形成的方式调控癌细胞迁移能力。癌细胞获得运动能力主要是依靠癌细胞伪足向某一方向延伸的动力,从而脱离原发病灶形成转移瘤[9]。为进一步了解Nckα基因沉默对于上皮性卵巢癌细胞侵袭、迁移能力的影响,特展开Transwell小室实验。研究结果显示Nckα基因沉默可对上皮细胞卵巢癌侵袭、迁移产生抑制作用。恶性肿瘤侵袭、迁移的前提是细胞获得无限增殖能力[10]。本次研究通过CKK-8实验对Nckα基因沉默状态下上皮性卵巢癌增殖情况进行分析,结果显示Nckα基因沉默可抑制上皮性卵巢癌细胞体外增殖能力。
为进一步分析Nckα基因在肿瘤增殖、侵袭中的作用机制,本次研究采用多因子固相抗体芯片技术对45中磷酸化激酶变化情况进行检测,共获得11种差异蛋白,其中AKT、p70S6K变化最为明显。有研究指出,AKT、P70S6K是构成PI3K/AKT通路的重要组成部分,而该通路可参与多种恶性肿瘤的发生[11]。在癌症发生发展过程中IA类PI3K均有参与,其中p85可对p100α产生抑制作用,当PI3K参与恶性肿瘤过程时,p110α发挥重要作用[12]。mTOR属于AKT信号下游受体,曾有学者在研究中指出,多种疾病发生过程中有TOR/S6K通路的参与,如糖尿病、癌症等[13]。结合以往研究结论,本次研究对PI3K p110α、p70S6K、AKT、P-AKT蛋白表达情况进行分析,结果显示当存在Nckα基因沉默时,上皮细胞卵巢癌SKOV3细胞、OVCAR3细胞PI3K p110α、p70S6K、AKT、P-AKT蛋白表达明显降低,而在Nckα过表达时各类蛋白均呈现升高趋势,提示Nckα基因沉默可能是通过调节PI3K p110α、p70S6K、AKT、P-AKT蛋白表达的方式调控上皮性卵巢癌细胞迁移、侵袭。
有报道指出,Nckα过表达可逆转由马兜铃酸导致的肾小管周围毛细血管减少,认为Nckα可能参与新生血管生成。为进一步证实Nckα基因对于肿瘤增殖、迁移的影响,本次特开展动物研究,通过制作皮下移植瘤动物模型,对动物模型皮下肿瘤生长情况进行分析,结果显示,移植Nckα基因沉默卵巢癌细胞的裸鼠皮下瘤体生长速度明显低于Nckα表达正常组,提示Nckα基因沉默可抑制实体瘤生长,可能是通过干预新生血管形成方式进行调节。
综上所述,Nckα基因沉默可导致上皮性卵巢癌细胞增殖、迁移能力降低,延缓皮下移植瘤生长速度,可能与Nckα基因沉默调控PI3K p110α、p70S6K、AKT、P-AKT蛋白表达有关。
