腹膜后孤立性纤维肿瘤的临床分析:附7例报告
2022-08-03景旗王星傑王子君石小强廉洁魏光兵李徐奇王曙逢
景旗,王星傑,王子君,石小强,廉洁,魏光兵,李徐奇,王曙逢
(西安交通大学第一附属医院1.普通外科2.病理科,陕西西安 710061)
孤立性纤维肿瘤(solitary fibrous tumor,SFT)是一种少见的间叶组织来源的软组织肿瘤,由Klemperer 等在1931年首次提出[1]。最常见于胸膜,也可起源于全身多处部位,但发生在腹盆部较为罕见[2]。相比于发生在胸膜等部位,腹膜后SFT 被认为有体积更大的趋势,且具有更高的恶性潜能[3]。由于腹膜后SFT 发生率低,数据大多来自小型回顾性分析和个案报告,这使得诊断和制定特定的治疗计划变得困难[4]。本文回顾性分析了7 例腹膜后SFT 患者的临床表现、影像资料、手术情况、组织学特征以及随访结果,结合文献进行分析总结,以期增强临床医生对该病的认识并引起重视。
1 资料与方法
1.1 一般资料
回顾性收集西安交通大学第一附属医院2014年3月—2021年9月7 例以腹膜后占位性病变收治并行穿刺活检或术后病理及免疫组织化学检查确诊为腹膜后SFT 患者的临床及病理资料。其中男4 例,女3 例;年龄30~68 岁, 平均年龄(53.3±13.2)岁。
1.2 纳入排除标准
纳入标准:⑴经手术或穿刺活检病理及免疫组织化学检查确诊为腹膜后SFT;⑵临床资料完整可查。排除标准:⑴术前已行新辅助放化疗;⑵合并严重的心、肺、脑、肾等重要脏器病变,不可耐受手术;⑶临床资料不全者。
1.3 治疗方法
7 例患者中,1 例肿瘤巨大,约20 cm×9 cm×18 cm,毗邻大血管,家属考虑手术风险大,拒绝手术。1 例行腹腔镜辅助腹膜后肿瘤切除术。其余5 例行开放性腹膜后肿瘤切除术,其中3 例行联合脏器切除(左侧附件切除1 例、直肠部分切除1 例、脾脏切除1 例)。另经多学科讨论,3 例患者术前栓塞肿瘤供血动脉。术后切除组织标本均送病理科检查,经10%中性甲醛缓冲液固定,常规石蜡包埋后,HE 染色及免疫组织化学检查。
1.4 随访情况
门诊复查与电话沟通随访相结合,随访截止时间为2021年10月。
1.5 统计学处理
采用描述性统计方法,计量资料用均数±标准差(xˉ±s) 表示,计数资料用例数(百分比)[n(%)]表示。
2 结 果
2.1 临床表现
7 例患者中,1 例无明显临床症状,系患者无意间发现,余6 例因肿瘤压迫周围组织器官出现不同程度的症状,其中腹胀、腹痛4 例,腰背部疼痛1 例,左臀部及左下肢疼痛伴麻木感1 例(表1)。既往均无肿瘤家族史及相关病史。5 例患者神经元特异性烯醇化酶(NSE)轻度升高,其余肿瘤标志物大致正常。
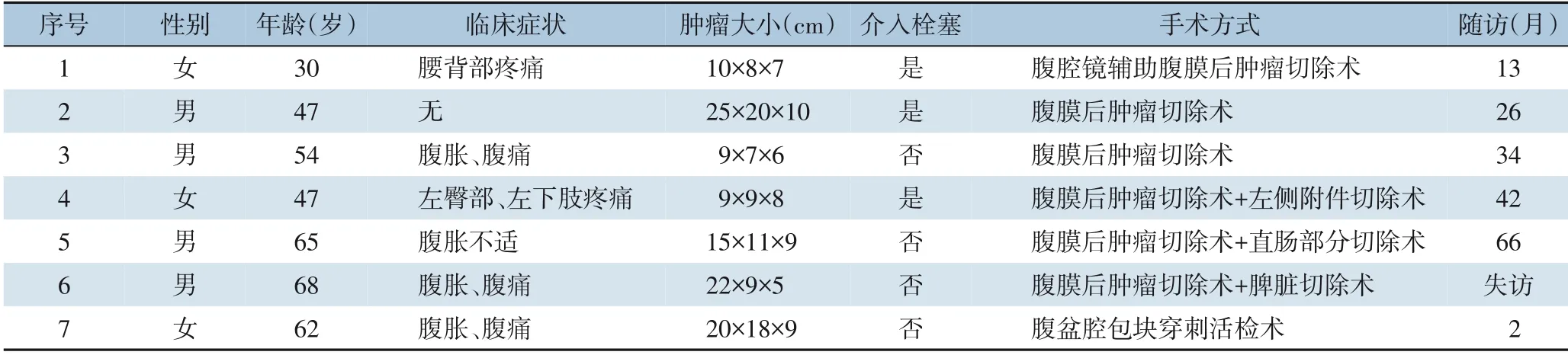
表1 7例腹膜后SFT患者的临床资料Table 1 The clinical data of the 7 patients with retroperitoneal SFT
2.2 影像学表现
B 超可见腹膜后占位性病变,一般为实性低回声或中低回声,内部回声不均,界清,形态尚规则,CDF1 多显示内可见血流信号。CT 平扫可见混杂密度肿块影,周围结构受压推移,少数病例局部可见斑块状稍高密度影。增强CT 呈渐进性不均匀强化,伴囊性病变者囊壁及分隔多发线条状强化。MRI 呈等T1 稍长T2 信号影,其内可见线状短T2 信号影。5 例患者行CTA 检查,部分患者进行三维重建,可见供血动脉增粗,走行迂曲紊乱,其中2 例供血动脉来自髂内动脉分支,1 例来自髂内动脉分支及腰动脉分支,1 例来自肠系膜下动脉远端分支,1 例来自脾动脉分支(图1)。
2.3 手术情况
经多学科诊疗团队术前讨论,3 例患者术前行肿瘤供血动脉介入栓塞术,1 例栓塞左侧腰动脉+左侧髂内动脉,2 例栓塞左侧髂内动脉(图2)。手术时间300~540 min,平均(372.5±91.3)min;出血量100~2 500 mL,平均(1 200.0±1 031.5)mL;平均住院时间(25.7±9.3)d。术前栓塞患者与未栓塞患者术后平均住院时间分别为(10.3±4.2)d和(11.7±2.3)d,术后第1 天平均引流量分别为(283.3±119.3) mL 和(385.0±262.5) mL。未栓塞患者中1 例发生肺部感染、1 例术后30 d 因腹膜后包裹性积液再次入院行超声引导下穿刺引流,栓塞患者未出现术后并发症。
2.4 组织病理学特征
手术切除标本多表面呈灰白色,被覆薄层包膜,表面光滑或呈结节状,切面灰白或灰红色,质中,局灶可见水肿样变,2 例局部可见囊腔形成,伴出血坏死灶。肿瘤最大25 cm×20 cm×10 cm,最小9 cm×7 cm×6 cm,最大径中位数15 cm。7 例患者均行病理检查,镜下肿瘤细胞呈梭形或卵圆形,呈现不同程度异型性,束状、条索状排列,疏密不均,偶可见薄壁“鹿角状”血管,间质常含有粗细不等、形状不一的胶原纤维(图3)。免疫组化阳性率CD34、Ki-67 均为100%(7/7),CD99、vimentin 均为100%(6/6),STAT6 为100% (5/5),Bcl-2 为50% (3/6),S-100 为14%(1/7)(表2)。

表2 7例SFT患者免疫组化检测结果Table 2 Immunohistochemical results of seven SFT patients
2.5 随访及预后
7 例患者中,1 例失访,失访率14.3%,其余6 例均获有效随访,随访时间2~66 个月,均未出现复发或转移征象。
3 讨 论
SFT 由梭形细胞和散布的胶原组成,通常发现于胸腔和胸膜,很少发现于纵隔、皮肤、脑膜、眼眶、上呼吸道、乳腺、甲状腺和腹膜[5]。2020年WHO 软组织与骨肿瘤分类中,SFT 被细分为SFT 良性[中间性(局部侵袭)]、SFT NOS[中间性(偶有转移)]和SFT 恶性[6]。中老年发病多见,无性别偏好。该病种病程较长,不易发现,患者多在肿瘤出现脏器压迫情况下就诊[7]。极少数患者伴发顽固性低血糖,称为Doege-Potter 综合征,目前研究认为其发生主要与肿瘤细胞产生的胰岛素样生长因子2(IGF-2)有关,肿瘤切除后症状消失[8]。本组患者均无此表现,且肿瘤体积较大,最大直径中位数15 cm,多因肿瘤压迫周围组织器官出现相应症状而就诊。
影像学检查是SFT 诊断的重要辅助检查手段,不具有特异性,但对手术团队采用正确的方法和策略在清晰的边缘进行根治性切除具有指导意义。何晓军等[9]总结,CT 和MRI 检查是决定腹膜后肿瘤手术方式及评估手术效果的可靠依据,能显示肿瘤部位、大小、形态及周围脏器受累情况,胃肠道镜检或钡餐及静脉肾盂造影等检查可排除消化道及泌尿系统梗阻,对是否需要联合切除脏器有重要意义。腹膜后SFT 地CT 平扫多表现为边界清楚的孤立性混杂密度肿块影,常见周围结构受压推移,少数病例局部可见斑块状稍高密度影。增强CT 呈渐进性不均匀强化,瘤内可见迂曲小血管影。刘华平等[10]报道14 例SFT 中13 例平扫呈不均匀,增强呈“地图样”强化,瘤周可见多发扭曲血管影,并认为这与肿瘤内部交替分布纤维、血管及肿瘤细胞等有关。因肿瘤细胞疏密、胶原纤维含量、出血、坏死、囊变等改变,MRI 信号表现也各不相同。SFT 在T1 加权图像上通常为等或等低信号,T2 加权图像呈稍高或高低混杂信号,线性短T2 信号影的存在与胶原蛋白含量有关。术前影像学结果需与神经源性肿瘤、胃肠道间质瘤等相鉴别。若CT 和MRI 发现边界清楚、密度或信号不均的孤立性肿块,增强扫描呈不均匀或“地图样”强化,且多发迂曲血管或流空信号时,应考虑SFT 可能[11]。随着医学影像技术的发展,三维重建和3D 打印技术被引入术前评估和术中导航体系。此外,混合现实技术的使用对原发性腹膜后肿瘤的精准化、微创化切除提供了参考依据[12]。
目前,手术治疗仍是SFT 的主要治疗方法,关于术前新辅助治疗的作用暂无定论。Hasa 等[13]研究表明若不进行手术,姑息性放疗对肿瘤局部控制和患者总生存期有一定积极作用。Stacchiotti等[14]研究发现靶向药物对SFT 的部分抗肿瘤疗效。一般来说,发生于腹膜后的肿瘤,毗邻大血管,且常有侧支血管供血,出血风险较高,同时肿瘤体积较大导致操作空间狭小,手术切除难度较大。张秋学等[15]报道了腹膜后肿瘤切除致下腔静脉撕裂3 例,左肾静脉撕裂1 例,其中1 例下腔静脉多处损伤而导致术中死亡。Wat 等[16]报道了因大量出血被迫中止手术的病例。Kim 等[17]报道了术后再次出血进行二次手术的病例。而术前栓塞肿瘤供血动脉已被证明可以进行安全、完整切除,特别是在胸、头颈部和脊柱等部位的SFT[18],Velayati 等[19]证实肝动脉栓塞对于转移性肝脏SFT 是一种相对安全的治疗选择。Zhuang 等[20]研究发现输注浓缩红细胞是术后并发症的独立危险因素,而术前选择性栓塞SFT 的供血动脉可以减少术中失血而无需输血,尤其对于影像学检查结果提示有大血管包绕或滋养的肿瘤,术前栓塞更具意义。本研究中,3 例患者肿瘤与左侧髂内动脉关系密切,故术前行肿瘤供血动脉介入栓塞术。相比于未经术前栓塞患者,手术平均时间并未缩短,这可能与腹腔镜的使用和部分患者联合脏器切除有关,术中出血量均在可控范围内,但术后平均住院时间缩短,术后第1 天平均引流量明显减少,且术后并发症发生减少。但也有文献[21]报道患者栓塞髂内动脉后臀部皮肤发生缺血坏死,本组患者尚未出现相关并发症。1 例患者行腹腔镜辅助腹膜后肿瘤切除术,腔镜的使用可提供出色的视野,有助于精细化游离、显露重要解剖结构,减少术中不良事件发生且术后恢复更快,该患者术后住院时间7 d,为全组最短。目前多学科讨论已被证实是现阶段肿瘤治疗的最佳模式之一,由于腹膜后肿瘤在生物学特性、病理学类型、发生部位、有效治疗手段缺乏等方面的特殊性,诊治过程中多学科协作的作用尤显重要[22]。腹膜后SFT 较为罕见,相关报道较少,缺乏既定的、普遍接受的治疗策略,通过多学科讨论制定个体化根治性手术治疗方案,可使患者获得肿瘤治疗效益的最大化。
SFT 最终确诊依赖病理检查及免疫组织化学结果。肿瘤切面灰白色,质坚硬,镜下瘤细胞呈梭形或卵圆形,核长,胞质嗜双色,肿瘤中可见不同程度的胶原化区,胶原束粗细不一[23]。细胞密集区可见薄壁血管,典型者呈“鹿角状”,细胞疏松区可见形状不一的胶原纤维与肿瘤细胞无固定模式混合排列。CD34 被视为SFT 常规阳性标志物[24],此外,vimentin、CD99 和Bcl-2 阳性率较高,S100、SMA、CD117 和Desmin 通常呈阴性表达,也为诊断诊断提供了支持依据[25]。随着分子病理学发展,神经生长因子诱导基因A 结合蛋白2(nerve growth factor induced gene A binding protein 2,NAB2)和信号转导和转录激活因子6(signal transducer and activator of transcription 6,STAT6)之间的基因融合产物成为SFT 的高敏感度和特异度的标志物,被认为是 SFT 的分子标志[4], 其中具有NAB2ex6-STAT6ex16/17 融合变异的肿瘤主要位于腹膜后或盆腔软组织的深部,表现出更频繁的侵袭性临床行为[26]。本组患者中CD34、vimentin、CD99阳性率均较高,且进行STAT6 检测的患者均为阳性,符合SFT 特征。另有研究[27]结果表明端粒酶逆转录酶(TERT)启动子突变在28%的SFT 患者中被观察到,并且与高风险的病理特征和预后相关,但仍需在大样本腹膜后SFT 系列中进一步验证。
目前对于腹膜后SFT 的生物学行为难以预测,甚至一些组织学良性的肿瘤也可能出现复发转移[28]。有文献[29]报道组织学良性的腹膜后SFT 手术切除10年后,出现了肺部转移。这种组织学和临床行为之间不可预测的关系促进了风险分层模型的发展。Demicco 等[30]建立了3 层模型并随后改进,包括年龄、肿瘤大小、有丝分裂计数以及坏死程度4 个方面,分为低危、中危、高危3 个组别。重要的是,改进的SFT 风险分层标准现已包含在2020年WHO 分类中[31]。Salas 等[32]构建了风险计算器来预测局部和转移复发,研究结果证实了初次切除后10—20年延迟复发的情况并不少见。因此,对于中危、高危SFT 患者规律复查、长期严密随访需要引起临床医生高度重视。
综上所述,腹膜后SFT 无特异性临床表现,确诊有赖于病理学及免疫组化检查,STAT6 的弥漫性表达有助于诊断。根治性手术切除仍为主要治疗手段,术前栓塞对缩短术后住院时间、减少术后引流量及并发症的发生具有积极意义。同时,腹膜后SFT 延迟复发并不少见,这也凸显了在风险分层模型的指导下对患者进行术后长期随访的必要性。
利益冲突:所有作者均声明不存在利益冲突。
