食管鳞状细胞癌患者组织中lncRNA-TUG1 的 表达与预后的关系
2022-08-02袁丽侠
郭 剑 袁丽侠
食管癌(EC)是消化系统中常见的恶性肿瘤之一,在全球范围内其发病率居恶性肿瘤的第9 位,病死率居第6 位,在亚洲地区及非洲东南部的发病率较高[1]。EC 主要分为食管腺癌和食管鳞状细胞癌(ESCC),其中ESCC 是EC 的主要组织学亚型。在中国,平均每年有15 万左右的EC 患者死亡,其中90%以上为ESCC 患者[2]。ESCC 的发病较为隐匿且早期症状不明显,大多数患者在确诊时已是中晚期,其5 年生存率仅15%左右。因此,亟需寻找一种能够早期诊断ESCC 的生物标志物。
长链非编码RNA(lncRNA)是一类长度大于200 nt 的非编码RNA,具有广泛的生物学功能,可通过与DNA、蛋白质等大分子相互作用,调控肿瘤的发生和发展。牛磺酸上调基因1(TUG1)位于人类染色体22q12.2,可通过与甲基化的PRC2蛋白结合,调控与生长相关的基因表达[3]。Young等[4]的研究表明,沉默lncRNA-TUG1 可使发育中的视网膜细胞生长减慢,或致其凋亡。研究表明,lncRNA-TUG1 在结肠癌、胃癌等消化系统肿瘤的发生、发展中起着重要作用[5-6],但目前其与ESCC 相关的报道较少。本研究检测了ESCC 组织中lncRNA-TUG1 的表达水平,并分析其与ESCC患者的临床病理特征及预后的关系。
1 资料与方法
1.1 一般资料
收集2013 年10 月至2015 年10 月在渭南市中心医院行ESCC 根治性切除术的103 例患者的肿瘤组织及癌旁组织(距肿瘤组织边缘>5 cm)标本。所有组织在采集后均于30 min 内进行速冻处理,并保存于-80 ℃的冰箱中待用。纳入标准:(1)术前未接受放射、化学治疗;(2)术后经病理检查确诊为ESCC;(3)签署知情同意书。排除标准:(1)并发其他恶性肿瘤者;(2)心、肝、肾等重要器官功能不全者;(3)合并自身免疫性疾病者。本研究经医院医学伦理委员会批准。
103 例ESCC 患者中男性70 例(67.96%),女性33 例(32.04%),年龄41~72 岁,平均年龄为(59.81±7.62)岁。根据国际抗癌联盟(UICC)和美国癌症联合委员会(AJCC)于2017 年联合发布的第八版食管癌TNM 分期标准进行分期[7],其中Ⅰ期25 例,Ⅱ期22 例,Ⅲ期30 例,Ⅳ期26 例;术后经病理检查确诊的分化程度为低分化20 例,中分化32 例,高分化51 例。
1.2 lncRNA-TUG1 水平检测
采用实时定量PCR(real time qRT-PCR)法测定lncRNA-TUG1 的表达水平。使用TRIzol 试剂盒提取ESCC 组织及癌旁组织标本中的总RNA,严格按照试剂盒说明书进行操作。使用酶标仪测定RNA 的浓度和纯度。使用PrimeScriptTMRT Master Mix 试剂盒进行反转录,生成cDNA。使用PCR 仪进行扩增反应,反应条件为95 ℃预变性10 min,之后95 ℃ 20 s、60 ℃ 30 s、72 ℃ 30 s,共40 个循环。以U6 作为内参,采用2-ΔΔCT法表示lncRNA-TUG1的相对表达量。PCR 引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。
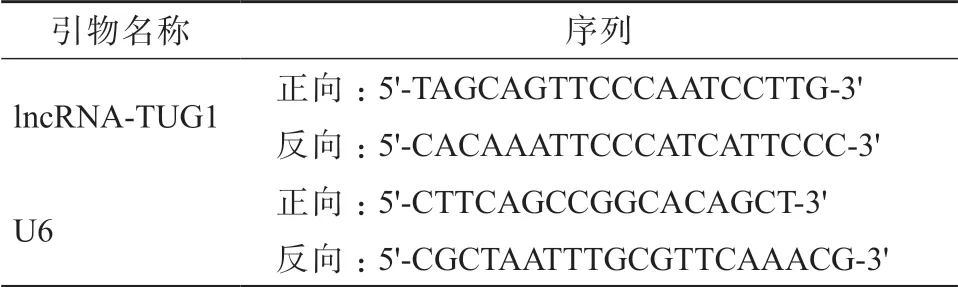
表1 引物序列
1.3 随访
采用门诊或电话的方式对ESCC 患者进行为期5 年的随访。随访开始时间为术后,第1 年每3个月随访1 次,第2 年每6 个月随访1 次,之后每年随访1 次。随访截至2020 年10 月,以患者死亡作为随访终点事件。
1.4 统计学方法
应用SPSS 20.0 软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t 检验;计数资料以例(%)表示,组间比较采用χ2检验。采用Kaplan-Meier 法绘制生存曲线,采用Cox 比例风险回归模型对ESCC 患者的预后影响因素进行单因素和多因素分析。P<0.5 为差异有统计学意义。
2 结果
2.1 lncRNA-TUG1 在ESCC 组织及癌旁组织中的表达水平
lncRNA-TUG1 在ESCC 组织中的相对表达量为3.28±0.26,高于癌旁组织(1.03±0.09),两组比较差异具有统计学意义(P<0.01)。
2.2 lncRNA-TUG1 的表达水平与ESCC 患者临床病理特征的关系
根据103 例ESCC 患者lncRNA-TUG1 的相对表 达量的中位数(1.58),将患者分为lncRNA-TUG1高表达组(≥1.58,n=58)和lncRNA-TUG1 低表达组(<1.58,n=45)。结果显示,lncRNA-TUG1的表达水平与患者的年龄、性别、烟酒史及肿瘤位置(靠近咽部者为高位,靠近胃下端者为低位,处于中间者为中位)无关(P>0.05);与患者的肿瘤分期、分化程度及淋巴结转移情况有关,lncRNATUG1 高表达组中Ⅲ~Ⅳ期者、低分化者、发生淋巴结转移者的占比显著高于lncRNA-TUG1 低表达组,两组比较差异均有统计学意义(P 均<0.05)。见表2。
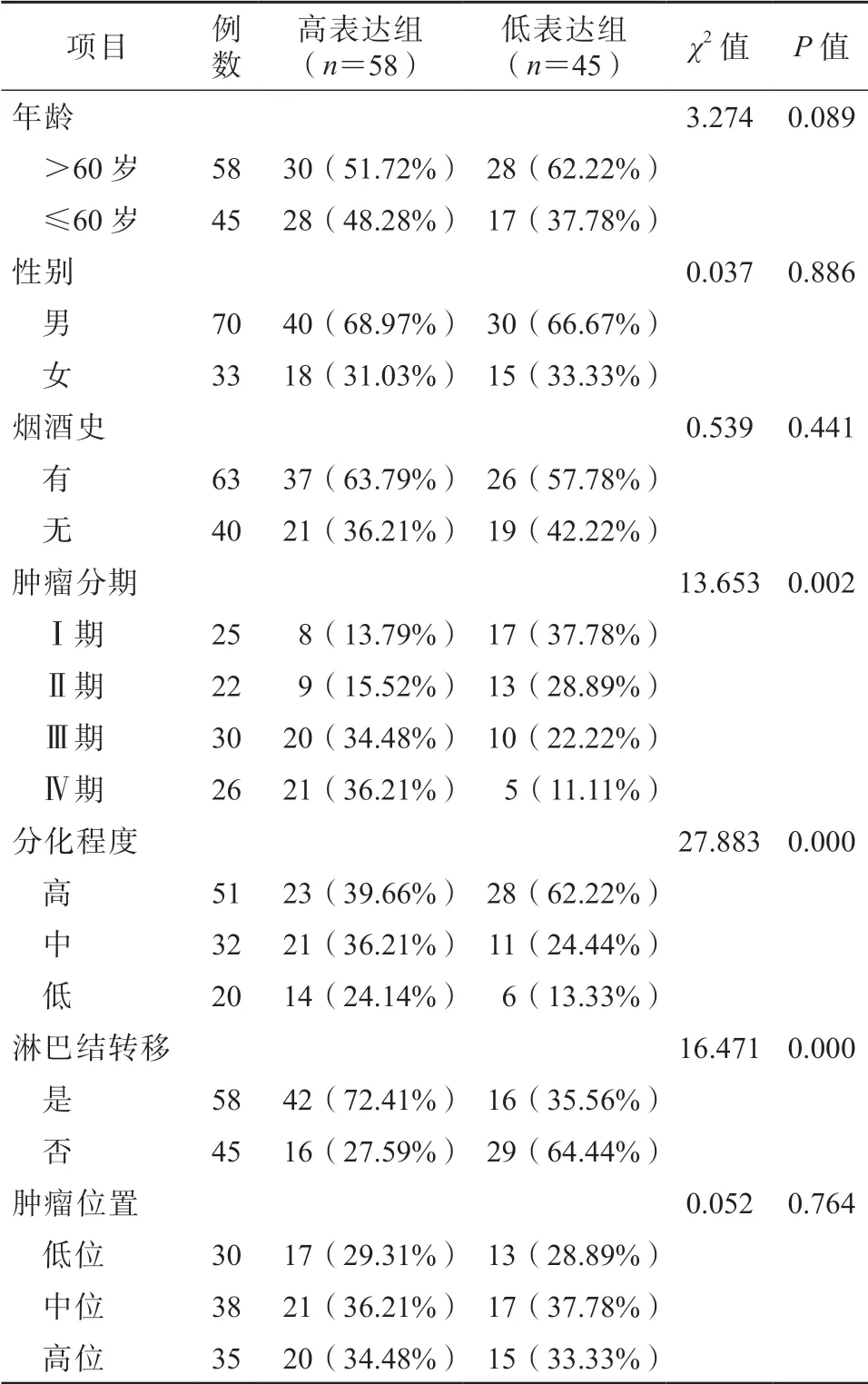
表2 lncRNA-TUG1表达与患者临床病理特征的关系/例(%)
2.3 lncRNA-TUG1 的表达水平与ESCC 患者预后的关系
生存分析结果显示,lncRNA-TUG1 高表达组的5 年生存率为24.14%,低于lncRNA-TUG1 低表达组(51.11%),两组比较差异具有统计学意义(P< 0.05)。见图1。
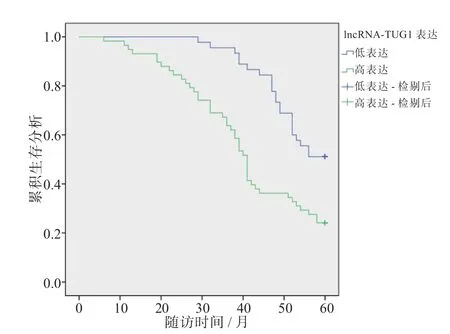
图1 不同lncRNA-TUG1 表达水平的ESCC 患者的生存分析
2.4 影响ESCC 患者预后生存的相关因素
将患者的年龄、性别、烟酒史、肿瘤分期、分化程度、淋巴结转移、肿瘤位置和lncRNA-TUG1水平作为自变量,将ESCC 患者的预后生存情况作为因变量,纳入Cox 单因素回归分析,结果显示肿瘤分期、分化程度、淋巴结转移和lncRNA-TUG1水平均与ESCC 患者的预后生存有关(P 均<0.05)。将单因素分析中P<0.05 的项目,包括肿瘤分期、分化程度、淋巴结转移和lncRNA-TUG1 水平作为自变量,将ESCC 患者的预后生存情况作为因变量,纳入Cox 多因素回归分析,结果显示淋巴结转移和lncRNA-TUG1 高表达是ESCC 患者预后生存的独立危险因素(P 均<0.05)。见表3。
3 讨论
EC 是一种具有异质性且容易高度恶化的消化道肿瘤,在全球范围内具有较高的发病率和病死率,严重威胁人类的健康。在中国,每年有数十万人死于EC,且主要以ESCC 亚型为主。近年来,虽然ESCC 的治疗方式得到了显著改进,但患者的5年生存率并未明显升高。大多数EC 患者早期症状不明显,确诊时常已失去手术机会。因此,寻找一种新的潜在标志物,加强对ESCC 的早期诊断、预防和治疗是当前的研究重点。

表3 影响ESCC 患者预后生存的单因素和多因素Cox 比例风险回归分析
lncRNA 在机体正常的生物学过程中发挥着重要的作用,可调控基因表达,参与染色体重排、组蛋白修饰、转录激活与干扰等过程。此外,lncRNA 也参与了包括肿瘤在内的人体多种疾病的调控。研究表明,lncRNA 与肿瘤的浸润和转移有关[8]。lncRNA-TUG1 最初是在小鼠视网膜细胞中被发现的[4]。Zhang 等[9]的研究发现,lncRNATUG1 在骨肉瘤组织中高表达,且与肿瘤的分期、大小及患者预后密切相关,lncRNA-TUG1 高表达的患者术后生存时间显著低于低表达者。Cai 等[10]的研究表明,lncRNA-TUG1 在神经胶质瘤患者中呈高表达,当其被沉默后,神经胶质瘤细胞对化学治疗的敏感度增高。研究发现,lncRNA-TUG1 在体外可通过介导miR-148a-3p/MCL-1/Wnt/β-catenin轴调控ESCC 的生物学功能和上皮间质转化[11]。另有研究表明,lncRNA-TUG1 可能通过与PRC2 结合,从而在ESCC 的发生、发展中发挥作用[12-13]。本研究结果指出,lncRNA-TUG1 在ESCC 组织中的表达水平显著高于癌旁组织,这提示lncRNA-TUG1 的表达可能与ESCC 的发病有关。此外,本研究还指出,lncRNA-TUG1 的表达水平与患者的肿瘤分期、分化程度及淋巴结转移情况有关,lncRNA-TUG1的表达水平越高,患者的肿瘤分期越高,肿瘤分化程度越低,且更容易发生淋巴结转移,这提示lncRNA-TUG1 可能与ESCC 的转移及恶化相关。
多项研究表明,lncRNA-TUG1 可作为膀胱癌、结肠癌、宫颈癌的预后指标[14-16]。本研究结果显示,lncRNA-TUG1 高表达的ESCC 患者术后生存率显著低于lncRNA-TUG1 低表达者,这提示lncRNATUG1 的表达水平可能可以预测ESCC 患者的预后生存情况。Cox 回归分析结果表明,lncRNA-TUG1高表达和淋巴结转移是影响ESCC 患者预后生存的独立危险因素。该结果提示在临床中需要加强对lncRNA-TUG1 高表达患者的术后监测,必要时予以辅助治疗,以防止疾病复发。
综上所述,ESCC 患者的肿瘤组织中lncRNATUG1 的表达水平较高,且其表达水平与ESCC 的发生、发展及患者的预后生存情况密切相关;监测ESCC 患者lncRNA-TUG1 的表达水平有助于判断病情进展及预后情况。今后需对lncRNA-TUG1在ESCC 中的具体调控机制进行深入探究。
