超声弹性成像参数在浸润性乳腺癌诊断中的应用及其与组织NKD1、HER-2表达量的关系
2022-08-02连俊李苗伍玉容梁汝娜
连俊,李苗,伍玉容,梁汝娜
安康市中心医院超声科,陕西 安康 725000
浸润性乳腺癌是发生于乳腺导管上皮及末端导管上皮组织的恶性肿瘤,以乳房肿块、乳头疼痛、内陷为常见症状。目前多采用超声等影像学手段进行检查,但对于微小病变易出现漏诊现象。有研究指出,采用超声弹性成像检测组织硬度来反映其结构变化,可用于判断正常组织及病变组织的差别,以达到诊断的目的,或可提高诊断准确度[1]。超声弹性成像技术的基本原理是对不同硬度组织加以刺激后,会产生不同程度的形变,故可通过观察组织硬度变化来对肿瘤性质进行鉴别。研究显示,浸润性乳腺癌的发生发展过程受多种因素影响,且Wnt 信号通路被认为与多种恶性肿瘤的发生有关[2]。相关报道指出,多种恶性肿瘤均存在Wnt信号通路的异常激活,而裸角质膜同源蛋白(naked cuticle drosophila1,NKD1)是该通路重要的负向调控因子[3]。人表皮生长因子受体-2 (human epidermal growth factor receptor 2,HER-2)是一种与乳腺癌发生紧密相关的原癌基因,也是该疾病重要的预后和预测性分子标志物。但目前尚无报道明确指出超声弹性成像参数与浸润性乳腺癌患者癌组织NKD1、HER-2 表达的关系。本研究旨在探究超声弹性成像参数在浸润性乳腺癌诊断中的应用价值及其与癌组织NKD1、HER-2表达量的关系,为该疾病的临床诊治提供参考。
1 资料与方法
1.1 一般资料 选取2019 年2 月至2021 年6 月安康市中心医院收治的90 例浸润性乳腺癌患者作为乳腺癌组,以同期收治的68例乳腺良性肿瘤患者作为对照组。(1)纳入标准:①乳腺癌组患者符合《中国抗癌协会乳腺癌诊治指南与规范(2015版)》[4]关于浸润性乳腺癌的诊断标准,且经病理学检查确诊;②对照组患者符合《乳腺增生与良性肿瘤现代诊断治疗学》[5]关于乳腺良性肿瘤的诊断标准;③于术前行超声检查;④为单侧原发性乳腺肿瘤;⑤患者均知情本研究的研究内容,且已签署同意书。(2)排除标准:①合并严重器质性疾病患者;②术前已接受放化疗及生物治疗等抗肿瘤治疗者;③合并其他恶性肿瘤疾病患者;④既往有胸部手术史者;⑤存在超声检查禁忌证者;⑥妊娠期或哺乳期妇女。乳腺癌组患者年龄31~65 岁,平均(49.68±5.33)岁;产次0~3 次,平均(1.28±0.20)次;肿块最大径0.9~5.1 cm,平均(1.86±0.35)cm;已出现淋巴结转移35例。对照组患者年龄29~64岁,平均(49.31±5.46)岁;病理学检查结果(术中采样):乳房纤维腺瘤27例、乳腺内乳头状瘤18 例、乳腺囊性增生病12 例、脂肪瘤11 例;产次0~3 次,平均(1.31±0.22)次;肿块最大径0.4~3.6 cm,平均(1.39±0.26)cm。两组患者的年龄、产次比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会审核通过。
1.2 方法
1.2.1 超声弹性成像 患者均于术前应用西门子Acuson S2000 型彩色多普勒超声诊断仪进行检查,探头型号为14L5,频率为7~14 MH,患者取平卧位,双上肢自然放置于头两侧,先行常规超声检查,明确病灶形态、大小、边界等,然后将探头调整至轻微接触病灶表面皮肤,启动弹性成像模式,应用实时双幅模式显示病灶的弹性图及灰阶图,将取样框调整至病灶的两倍,采用Color2 彩色显示法,蓝色为硬,红色为软,控制质控量化参数≥60,能够清晰显示肿块边界后按冻结键,启动Area Rati自动测量AR。硬度评分:1分,病灶与周围组织均呈均匀粉色;2分,病灶呈紫色混杂少量绿色;3分,病灶呈绿色混杂少量黄色;4分,病灶呈红色混杂少量黄色;5分,病灶呈红色混杂少量黄色。
1.2.2 NKD1表达量检测 术中取少量癌组织及癌旁组织(距癌组织5 cm,且经快速病理学检查证实为非癌组织),用干净的剪刀将组织于冰上剪碎,在液氮中研磨,然后放入离心管中,在加入裂解混合液后于冰中放置3 h(每20 mg组织加入150 μL裂解混合液),应用海门LX200 型离心机将裂解后的样本进行离心处理,速率为12 000 r/min,离心40 min,吸取上清液进行蛋白浓度测量,用裂解混合液调整样品浓度,将样品溶液加入缓冲液混匀后,煮5 min使蛋白变性,取出待冷却的样品进行点样,以每孔中点样量30 μL 进行上样,避免产生气泡,然后进行电泳、转膜、封闭、孵育、DAB显色处理,进行电泳时,压缩胶部分用60~90 V电压压缩25~35 min,分离胶部分用100~140 V电压分离30~50 min,应用Image lab 软件对蛋白印迹的灰度值进行分析,以目的蛋白灰度值/内参蛋白灰度值来反映目的蛋白的相对表达。
1.2.3 HER-2 mRNA表达量检测 应用Trizol法提取总RNA,采用分管光度法测定RNA 含量及纯度。将提取的RNA 逆转录为cDNA,应用Primer 5.0软件合成HER-2 引物及内参β-action 引物,采用PCR法扩增后进行电泳分离,应用GENE TOOL 软件进行半定量分析,以HER-2/β-action表示HER-2 mRNA表达量。
1.3 观察指标 (1)比较两组患者的AR 值及硬度评分,并分析其对浸润性乳腺癌的诊断价值。(2)比较乳腺癌组患者的癌组织及癌旁组织的NKD1、HER-2表达量。(3)比较不同AR值及硬度评分患者的癌组织NKD1、HER-2表达量,并分析其与弹性评分及AR值的相关性。
1.4 统计学方法 应用SPSS22.0 统计软件分析数据。计数资料比较采用χ2检验;计量资料符合正态分布,以均数±标准差()表示,组间比较采用t检验;采用受试者工作特征曲线(receiver operating characteristic curve,ROC)曲线分析超声弹性成像参数对浸润性乳腺癌的诊断价值,并采用Z检验比较两组间曲线下面积(area under curve,AUC)差异;采用Pearson检验分析癌组织NKD1、HER-2 表达量与弹性评分及AR值的相关性。均以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者的AR值及硬度评分比较 乳腺癌组患者的AR值大于对照组,硬度评分高于对照组,差异具有统计学意义(P<0.05),见表1。患者超声二维图像及弹性成像图像见图1。

图1 46岁女性右乳内上象限包块的超声二维图像及弹性成像图像
表1 两组患者的AR值及硬度评分比较()
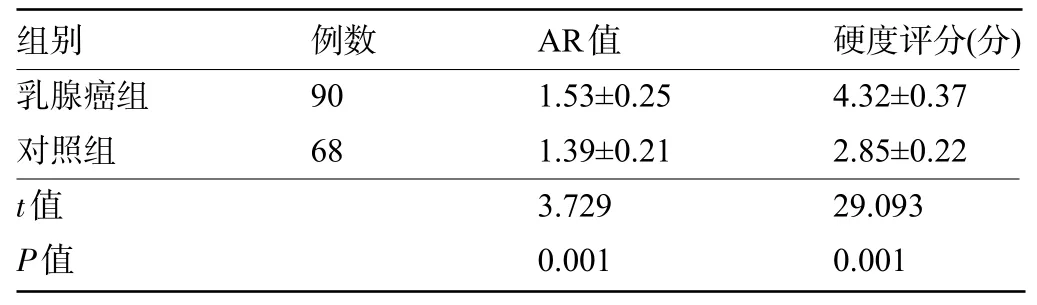
表1 两组患者的AR值及硬度评分比较()
组别 例数AR值 硬度评分(分)乳腺癌组对照组t值P值90 68 1.53±0.25 1.39±0.21 3.729 0.001 4.32±0.37 2.85±0.22 29.093 0.001
2.2 超声弹性成像参数对浸润性乳腺癌的诊断价值 超声弹性成像参数联合检测诊断浸润性乳腺癌的 AUC 大于 AR 值单独检测(Z=2.819,P<0.05),见表2、图2。
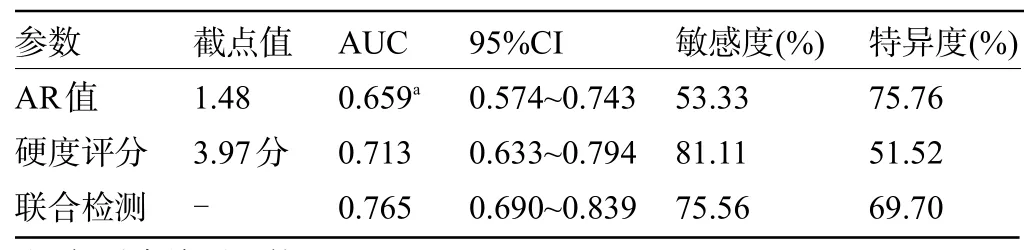
表2 超声弹性成像参数对浸润性乳腺癌的诊断价值

图2 超声弹性成像参数诊断浸润性乳腺癌的ROC曲线分析
2.3 癌组织及癌旁组织的NKD1、HER-2表达量比较 癌组织NKD1 表达量低于癌旁组织,HER-2 mRNA 表达量高于癌旁组织,差异有统计学意义(P<0.05),见表3。
表3 癌组织及癌旁组织的NKD1、HER-2表达量比较()

表3 癌组织及癌旁组织的NKD1、HER-2表达量比较()
例数90 90项目癌组织癌旁组织t值P值NKD1 0.56±0.11 0.64±0.12 4.662 0.001 HER-2 mRNA 0.63±0.13 0.45±0.08 11.187 0.001
2.4 不同硬度评分及不同AR值患者癌组织NKD1、HER-2 表达量比较 硬度评分≥3.97 分患者癌组织 NKD1 表达量低于<3.97 分患者,HER-2 mRNA 表达量高于<3.97 分患者,差异有统计学意义(P<0.05);AR 值≥1.48 患者癌组织 NKD1 表达量低于<1.48 患者,HER-2 mRNA表达量高于<1.48患者,差异有统计学意义(P<0.05),见表4。
表4 不同硬度评分及不同AR 值患者癌组织NKD1、HER-2 表达量比较()

表4 不同硬度评分及不同AR 值患者癌组织NKD1、HER-2 表达量比较()
项目 例数分类NKD1HER-2 mRNA硬度评分73 17 AR值≥3.97<3.97 t值P值≥1.48<1.48 t值P值69 21 0.54±0.10 0.65±0.13 3.850 0.001 0.53±0.11 0.66±0.13 4.542 0.001 0.65±0.12 0.54±0.10 3.503 0.001 0.65±0.13 0.56±0.09 2.958 0.004
2.5 癌组织NKD1、HER-2表达量与硬度评分及AR 值的相关性 癌组织NKD1 表达量与硬度评分及AR 值呈负相关(P<0.05),HER-2 mRNA 表达量与 AR值呈正相关(P<0.05),见表5。

表5 癌组织NKD1、HER-2表达量与硬度评分及AR值的相关性
3 讨论
浸润性乳腺癌已成为全球最常见的癌症,严重威胁了女性的身体健康。目前多采用超声等方法诊断,主要依据肿块的形态、内部结构等来进行判断,但在临床工作中发现,较多浸润性乳腺癌微小病灶发病早期恶性征象并不明显,会影响到最终诊断。相关研究指出,超声弹性成像可用于鉴别肿瘤性质,以辅助诊断疾病良恶性[6-7]。超声弹性成像是依据不同病变组织及正常组织的组织硬度不同来进行判断的,施加外力后,癌组织及正常组织弹性形变不同,通过组织内部位移信号不同,计算出肿块的变形程度,可以以此判断病灶良恶性[8]。本研究发现,乳腺癌组的AR值大于对照组,硬度评分高于对照组,说明浸润性乳腺癌患者存在病灶硬度增高的现象,其原因在于,恶性肿瘤多呈浸润性生长,与周围组织黏连而导致活动度降低,因此相应区域的组织硬度增加。另外,本研究发现,超声弹性成像参数联合检测对浸润性乳腺癌具有较高的诊断价值。另外,本研究发现,AR值诊断浸润性乳腺癌的截点值分别为3.97 分,略高于徐志花等[9]研究,这可能与良性组患者出现病灶部位胶原化有关。患者病灶胶原化,会出现纤维增生,使得弹性对比度增加,进而导致弹性分级增高。
NKD1 是一种由470 个氨基酸组成的蛋白,广泛表达于多种重要器官的细胞质中,是Wnt信号通路的抑制性蛋白[10-11]。HER-2是人类表皮生长因子受体家族成员,在胎盘、胚胎上皮组织及多种肿瘤细胞中呈高表达,研究显示,HER-2 可以作为乳腺癌诊断和评估的独立危险因素[12-13]。相关报道指出,NKD1过表达可介导Wnt/PCP信号途径,通过调控黏附蛋白活性及上皮细胞的极性来维持细胞极性,而起到肿瘤抑制作用[14-17]。表明NKD1 表达或与肿瘤的发生发展过程相关。本研究结果显示,癌组织NKD1 表达量低于癌旁组织,HER-2 mRNA 表达量高于癌旁组织,进一步证实了浸润性乳腺癌患者癌组织存在NKD1、HER-2 mRNA表达异常的现象,这主要与NKD1、HER-2均能介导肿瘤发生过程有关。本研究上述研究结果显示,超声硬度评分及AR 值可用于评价病灶性质,而浸润性乳腺癌的发生与NKD1、HER-2表达存在密切关联,提示NKD1、HER-2 表达或与超声弹性指标存在某种联系,为验证上述猜想,本研究进行了相关分析,结果发现,癌组织NKD1表达量与硬度评分及AR值呈负相关,HER-2 mRNA表达量与AR值呈正相关。其具体机制尚不可知,笔者认为,可能与癌组织浸润等有关。
综上所述,超声弹性成像参数联合检测对浸润性乳腺癌具有诊断价值,且与癌组织NKD1、HER-2 mRNA表达量相关。
