网络药理学结合分子对接技术探索灭幽汤治疗幽门螺杆菌相关性胃炎的作用机制
2022-08-02凡丞杨金兰王升
凡丞,杨金兰,王升
信阳市中心医院,信阳 河南 464000
幽门螺杆菌(helicobacter pylori,Hp)由Marshall 和Warren 在20 世纪80 年代首次从人胃黏膜中分离出来。近年来Hp 导致的我国人群感染率处在较高水平。慢性胃炎、胃溃疡与Hp 感染关系密切。且Hp 引起的长期感染还可导致胃恶性肿瘤,其中包括胃癌和MALT 淋巴瘤[1]。Sugano 等[2]撰写的报告中提出应将Hp 感染相关性胃炎作为一种独立的疾病看待。对于Hp 的传统根除治疗方案为抗菌药物联合质子泵抑制剂,劣势是副作用和日益凸显的耐药性。世界多地报道了Hp 对克拉霉素耐药率大于15%[3-4]。质子泵抑制剂的长期使用会引起消化系统、微量元素流失和心肌梗死风险增加等不良反应[5-6]。另外,还会引起肾脏和血液系统不良反应[7-8]。因此,寻求副作用小、敏感度较高的治疗方法十分必要。
近年来,国家大力扶持中医药产业,以整体观和辨证论治为根本的治疗理念具有独特优势,有望成为治疗HP 相关性胃炎的新方案[9]。湖南中医药大学以蒲公英、黄芩、陈皮、青皮、白及、三七及乌贼骨为组分研制的灭幽汤在治疗Hp 相关性胃炎的多项临床研究[10-11]及动物试验[12-13]中取得良好收效。但灭幽汤组分复杂,目前尚无针对灭幽汤治疗HP 相关性胃炎的系统性研究,具体机制有待阐明。为此,本研究将采用网络药理学研究方法探究灭幽汤治疗HP 相关性胃炎的作用机制,以期为后续试验研究提供理论依据。
1 材料与方法
1.1 灭幽汤化学成分收集和活性成分的筛选
灭幽汤组方为蒲公英(20 g)、三七(6 g)、黄芩(15 g)、青皮(10 g)、陈皮(10 g)、白及(10 g)和乌贼骨(15 g),制备方法见文献[12]。运用数据库TCMSP(http://tcmspw.com/tcmsp.php)及数据库TCMID(http://www.megabionet.org/tcmid)结合文献搜集灭幽汤中各组分的化学成分,并赋予TCMSP 编号。以口服生物利用度(OB)≥30%和类药性(DL)≥0.18 为标准对搜集的化学成分进行活性成分筛选。
1.2 活性成分靶点筛选
运用TCMSP 数据库对活性成分进行靶点预测,并得到对应的靶蛋白全称。以“Helicobacter pylori associated gastritics”为关键词检索Genecards 数据库(http://www.genecards.org/)得到疾病相关基因。以“Homo Sapiens”为筛选标准,经Uniprot 数据库(http://www.uniprot.org/)将药物靶点和疾病靶点对应的靶蛋白全称进行标准化命名。通过取交集,获得活性成分与疾病共有靶点。运用Cytoscape3.7.1软件构建灭幽汤活性成分-靶点网络模型,运用Network analyzer 工具分析活性成分degree 值,degree 值越高表明活性成分治疗地位越重要。
1.3 靶点蛋白互作网络的构建及核心靶点筛选
将灭幽汤活性成分与疾病共有靶点基因导入String 数据库(http://www.string-db.org/),物种选择人类,得到蛋白互作关系数据的TSV 格式文件。将文件导入Cytoscape 得到蛋白互作关系网络,使用CytoNCA 插件筛选核心基因,并构建子网络。进一步使用CytoHubba 插件中提供的最大团中心性(maximal clique centrality,MCC)算法筛选TOP10核心基因。
1.4 分子对接
分别在PubChem 网站(http://pubchem.ncbi.nlm.nih.gov/)和PDB 数据库(https://www.rcsb.org/)下载活性成分和靶蛋白的3D 结构SDF 格式文件。使用Pymol 对原始蛋白进行去水去配体。Openbable 软件将活性成分保存为“mol2”格式。然后Autodock tools 软件对活性成分和蛋白进行加氢、电荷分配操作,保存为“PDBQT”格式文件。运用Autodock Vina 软件对“活性成分-靶点网络”中degree 值前5 位的活性成分和degree 值前15 位且属于PPI 互作网络中TOP10 蛋白的靶点进行分子对接,使用结合能评估活性成分与蛋白的结合活性,结合能越小,对接活性越强,复合物越稳定。
1.5 GO 和KEGG 富集分析
将活性成分和疾病共有靶点输入Metascape 网站(http://www.metascape.org/),物种选择“H.Sapiens”,导出分析结果。收集GO 和KEGG 条目,以及与之对应的基因数量(count)、-Log(p)值,运用Excel 2010 绘制条形图。
2 结果
2.1 灭幽汤的活性成分
共得78 种活性成分,其中蒲公英15 种,黄芩36 种,陈皮5 种,青皮5 种,三七8 种,白及9种,乌贼骨主要由盐和氨基酸构成,本次未搜集到乌贼骨相关活性成分。共得到灭幽汤活性成分靶标1 226 种,去重及除去未匹配到的基因后得到205 种。Gene cards 数据库中共得到疾病相关靶标871 种,与灭幽汤活性成分靶标取交集后得到共有靶标97 种,见图1。剔除无关联的活性成分,共得到作用于疾病的潜在活性成分62 种,其中蒲公英10 种,黄芩29 种,陈皮5 种,青皮5 种,三七7 种,白及6 种,见表1。62 种潜在活性成分与97 种“活性成分-疾病”共有靶标的相互作用网络图见图2。
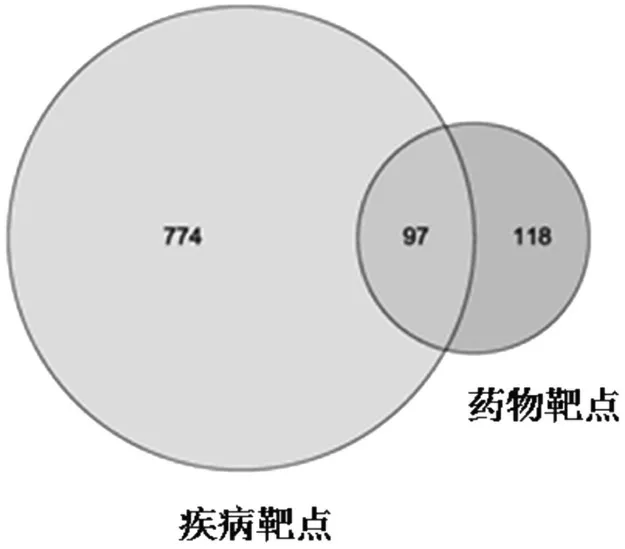
图1 Hp相关性胃炎靶点与灭幽汤作用靶点的韦恩图
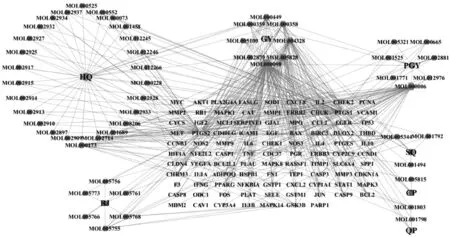
图2 灭幽汤“活性成分-潜在靶点”的网络关系
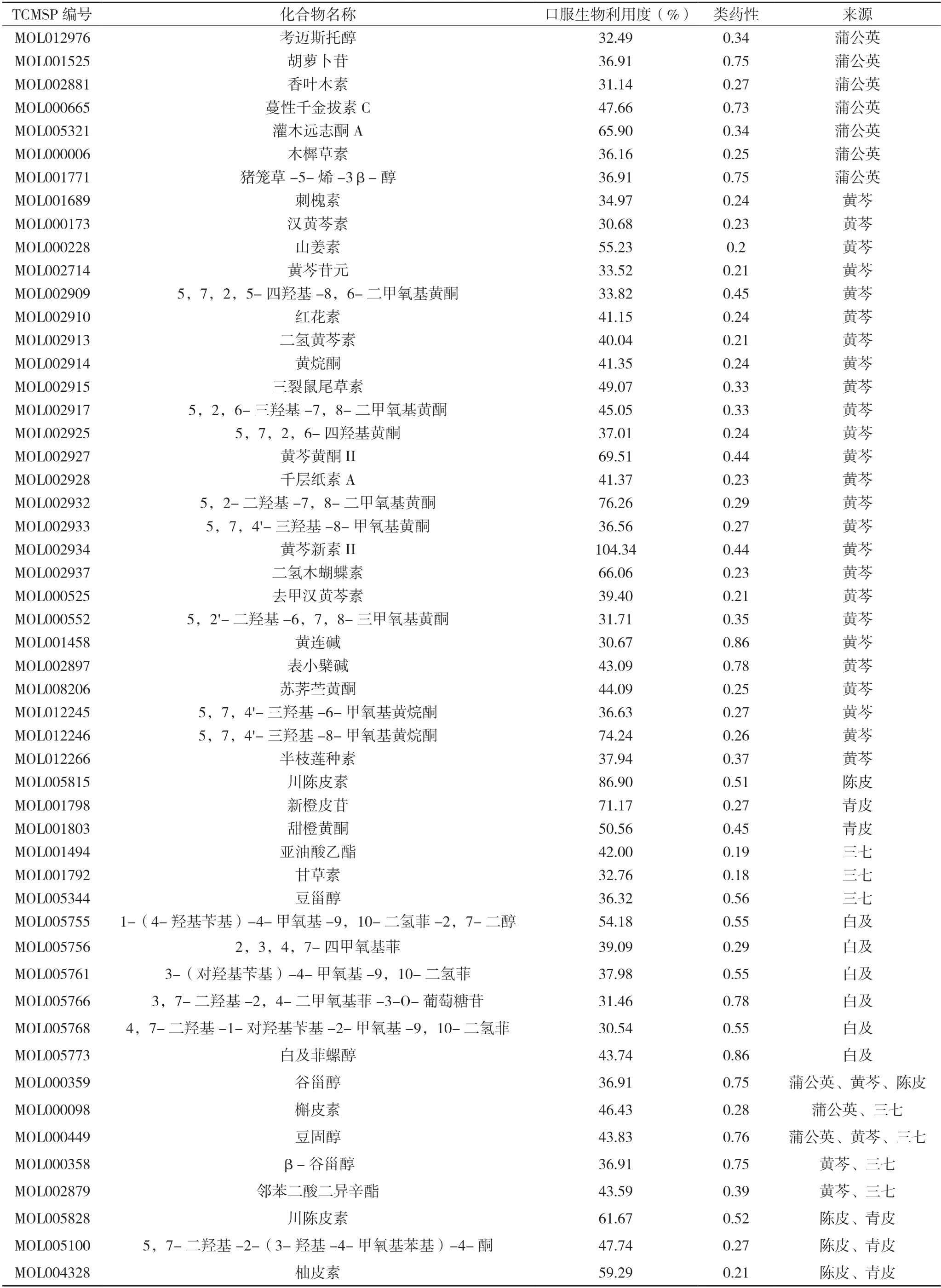
表1 灭幽汤治疗Hp相关性胃炎的潜在活性成分
2.2 蛋白互作网络的构建
97 个活性成分与疾病共有靶点的初始蛋白互作网络包含97 个节点和2 026 条边。经CytoNCA插件对初始网络中degree>41 的节点构建子网络。经CytoHubba 插件对子网络进一步筛选得到核心基因网络图,核心基因为前列腺素内过氧化物酶2(PTGS2)、肿瘤蛋白P53(TP53)、丝/苏氨酸蛋白激酶B1(AKT1)、半胱氨酸蛋白酶3(CASP3)、丝裂原活化蛋白激酶3(MAKP3)、血管内皮生长因子A(VEGFA)、原癌基因(JUN)、丝裂原激活蛋白激酶8(MAPK8)、丝裂原活化蛋白激酶1(MAPK1)和白介素6(IL6)。见图3。

图3 灭幽汤治疗Hp相关性胃炎的蛋白相互作用网络
2.3 GO 与KEGG 富集分析
通过GO 功能富集分析,灭幽汤治疗Hp 相关性胃炎与1 781 个生物过程、60 个细胞组成以及111个分子功能存在相关性(P<0.01)。根据P 值选取前10 个GO 条目绘制条形图,见图4,图5。KEGG富集分析共得到241 条信号通路,选取前20 个信号通路绘制条形图,主要包括癌症途径、IL-17 信号通路、NF-κB 信号通路和Hp 感染中的上皮细胞信号传导通路,见图6。

图4 GO细胞元件富集分析
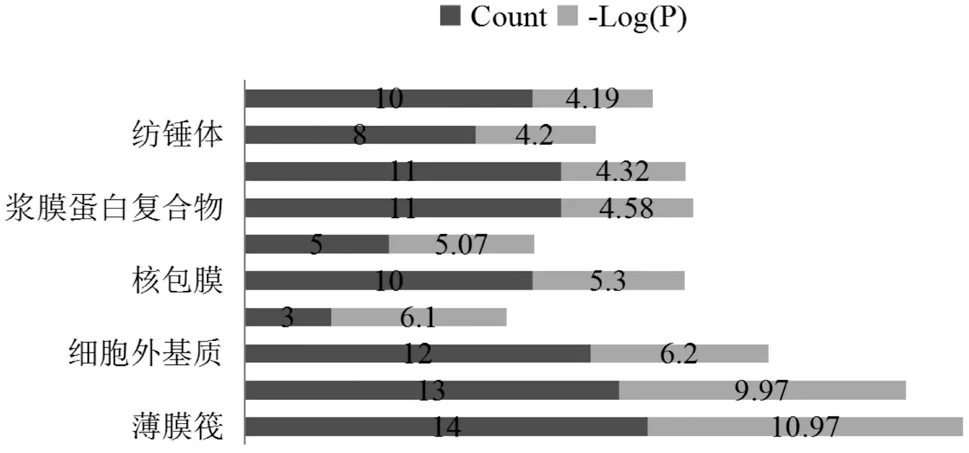
图5 GO分子功能富集分析
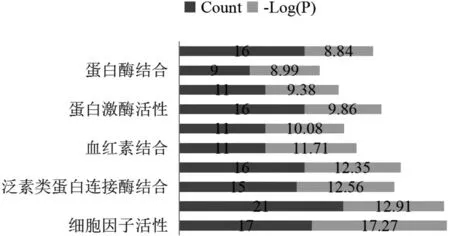
图6 KEGG通路富集分析
2.4 活性成分与潜在靶点的分子对接
根据“1.4”中所示方法进行分子对接,结果显示槲皮素、木樨草素、川陈皮素、柚皮素和β-谷甾醇分别与PTGS2、TP53、AKT1、CASP3 均具有较好的结合活性,结合能均大于-5 kcal/mol。且与PTGS2 结合活性最高,见表2。活性成分与靶点主要依靠氢键作用力结合,部分活性成分与靶蛋白的结合细节图见图7。
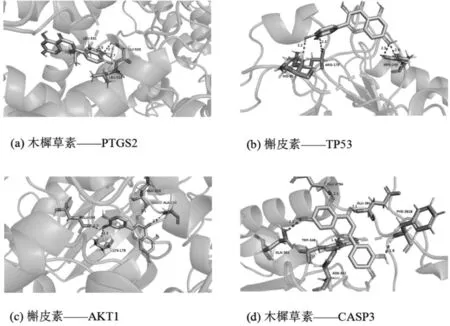
图7 灭幽汤活性成分与核心靶点的分析对接图
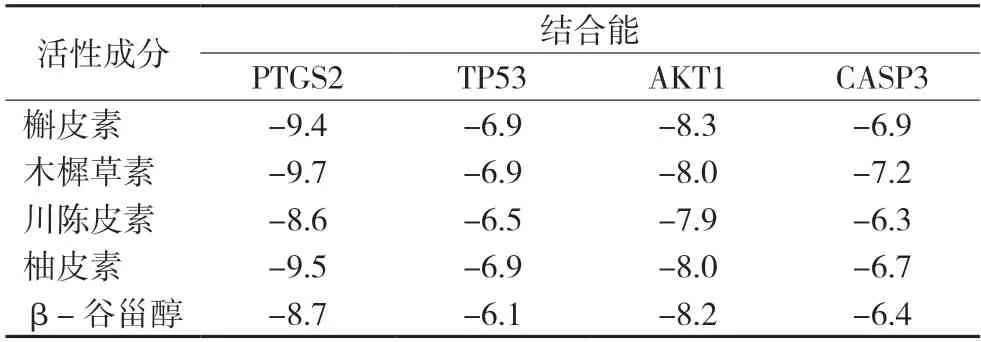
表2 灭幽汤关键活性成分与核心靶点的分子对接结果(kcal/mol)
3 讨论
通过活性成分-靶点网络图可以看出灭幽汤中含活性成分最多的中药依次为黄芩、蒲公英、三七、白及、陈皮和青皮。结合与靶标的连接情况来看,度值排名前5 位的活性成分中,共有成分槲皮素、柚皮素、川陈皮素和β-谷甾醇以及来源于蒲公英的木樨草素与靶标连接更密集。槲皮素为类黄酮化合物,结构中含大量酚羟基,具有抗炎、抗细胞氧化[14]、抑制HP[15]等活性。木樨草素也属于类黄酮化合物,其在体内外抗炎活性均较强[16],有研究表明木樨草素可通过改变Hp 感染胃癌CRL-1739 细胞ADAM-17、IL-8、IL-10 和NF-κB 的表达可能成为治疗胃癌的潜在化合物[17]。川陈皮素可以诱导CD74 蛋白(幽门螺杆菌脲酶粘附蛋白分子)的表达,是一种抑制Hp 粘附和感染的候选化合物[18]。β-谷甾醇可通过介导AMPK、PTEN、和Hsp90 作用于胃腺癌细胞发挥抗癌作用[19]。本研究活性成分与疾病共有靶点97个,通过CytoNCA 和CytoHubba 插件提供的MCC 算法两步筛选得到前10 位核心靶点,为PTGS2、TP53、AKT1、CASP3、MAKP3、VEGFA、JUN、MAPK8、MAPK1 和IL6。MCC 算法提供了较好的敏感度和特异度,更有利于精确发现关键节点[20]。提示以上十个靶点在蛋白互作网络中处于关键地位。
有文献表明,部分靶点在Hp 相关性胃炎形成和进展阶段发挥关键作用。其中PTGS2 为环氧合酶,属于诱导型酶,通常以较低活性存在于正常组织中,炎症刺激可使其表达水平上调,经过生物化学反应,产生前列腺素[21],最终引起炎性反应和疼痛。由此可见灭幽汤通过多种活性成分作用于PTGS2,这对治疗Hp 相关性胃炎具有重要作用。JUN 编码的是一种转录因子AP-1,Hp 可通过AP-1 刺激巨噬细胞,进而产生递质促进炎症发生[22]。IL-6 是一种促炎细胞因子,有研究显示其与胃炎炎症程度呈正相关[23]。
GO 富集分析显示,活性成分-疾病共有靶点主要参与对脂多糖的反应、凋亡信号通路以及对氧化应激的反应等生物过程。基于KEGG 通路富集分析可知,IL-17 信号通路、NF-κB 信号通路、Jak-STAT信号通路及Hp 感染中的上皮细胞信号传导和癌症途径与胃炎密切相关。其中,NF-κB 信号通路可调节包括细胞因子和黏附分子等参与炎症反应的蛋白的基因转录过程,在胃炎到胃癌的发展进程中有重要调节作用[24-25]。IL-17 是一种促炎细胞因子。据报道,Hp 感染患者胃黏膜IL-17 蛋白的表达水平上调,而在根除Hp 后,IL-17 蛋白表达水平随之下降[26]。本研究中,蛋白互作网络前10 位核心基因中PTGS2、IL-6 以及CASP3 皆分布在IL-17 信号通路图中。JAK-STAT 信号通路是目前已知的三大炎症信号通路之一,还具有调节细胞增殖、分化和凋亡等功能[27-28]。据报道,中草药发挥抗Hp 作用主要集中在抗炎和抗癌相关的信号通路[29],本研究结果显示,前20 条信号通路中有诸多通路执行的是炎症和癌症路径。
综上所述,本研究通过网络药理学的研究方法得到了灭幽汤的主要活性成分有槲皮素、柚皮素、川陈皮素、β-谷甾醇和木樨草素。主要通过作用于PTGS2、JUN 和IL6 等关键靶点来调控IL-17 信号通路、NF-κB 信号通路、Jak-STAT 信号通路来治疗幽门螺杆菌相关性胃炎。分子对接也初步证实degree值前五位的活性成分与PTGS2、TP53、AKT1 以及CASP3 有较好的结合活性,由此可见,灭幽汤中的活性成分可以通过作用于多个靶点来调控涉及炎症、细胞增殖和凋亡相关的信号通路来治疗幽门螺杆菌相关性胃炎。这对于进一步探究灭幽汤的作用机制以及发现治疗相关的先导化合物具有前期借鉴价值。
