数轴在电化学教学中的妙用
2022-07-30蓝尤钊王月娟
蓝尤钊,王月娟
浙江师范大学化学与生命科学学院,浙江 金华 321004
在化学教学中,为了便于理解记忆一些规律性或系统性的知识点,我们通常会引入一些直观的“模型”来辅助教学[1]。“模型认知”已成为现阶段高中化学要求培养的核心素养之一,这里的“模型”分为实物模型和非实物模型两大类,其中非实物模型包括数学模型、图像模型和语义模型等,基于“数轴”的图像模型在化学教学中有着丰富的应用。例如,数轴可以用来理解各类化学反应[2-6],其中在氧化还原反应中,数轴模型可以直观体现物质的量的关系和电子转移的数值[4,5]。数轴模型容易记忆,数值表示从左到右增大的规律可以用于理解和记忆一些规律性的知识点[3,7-12],如溶解度、pH、金属活动顺序表、盖斯定律,等等。本文以数轴为模型,简单直观地讲解了电池符号、电极电势和电极极化三个电化学中的重要知识点。电池符号中的正负极规定和氧化还原反应中的得失电子与数轴的正负端和正负号完美对应。结合金属活动顺序表,数轴上数值的大小与电极电势的大小位置相对应,我们可以很容易理解记忆金属电极电势的大小与氧化还原反应的能力。电极极化导致电极电势的变化,其极化的程度或大小直观地体现在数轴上。
1 数轴与电池符号
电池符号的书写是与电池相关的电化学教学的重要内容,它遵循一般的惯例。这个惯例主要涉及以下四个方面[13]:① 电池的正负极,正负极发生的氧化还原反应;② 不同相态的分隔,盐桥的表示;③ 各物质的相态;④ 由电极电势计算电池电动势。从学习的角度看,写多了自然可以记起来,但时间久了难免忘记,比如左边右边是什么极和发生什么反应的问题。下面结合我们熟知的数轴来理解和记忆电池符号的表示惯例,因为数轴是个非常简单的模型,基于这个模型的记忆非常清楚,且不容易忘记。我们以铜锌Danel电池为例来说明数轴和前面述及的电池符号惯例中的第①和第④两个方面的对应关系。如图1所示,对于第①个方面,数轴的原点(即0点)对应电池符号中正极和负极的分界,数轴的负端(-)对应电池的负极,正端(+)对应电池的正极。负极的负号后加一个电子符号即(-e),表示失去电子反应即氧化反应。类似地,正极的正号后加一个电子符号即(+e),表示得电子反应即还原反应;对于第④个方面,电池的电动势计算定义为正极的电极电势减去负极的电极电势,即φ右-φ左。例如我们以Cu和Zn的标准电极电势为例,整个电池的电动势为1.1015 V。总之,我们以数轴的原点作为电池符号正负极的分界点,而数轴的正负端对应了电池的正负极端,正负号对应得失或加减电子,正负端的数值差的大小对应了电池电动势的大小。

图1 数轴与电池符号的对应关系
2 数轴与电极电势
电极电势的大小没有绝对值,它是相对于某一标准电极定义的电势差。按照国际纯粹与应用化学联合会的规定,我们采用标准氢电极作为标准电极,其电极电势定为0。未知电极电势的定义方法是一定温度下把未知电极与标准氢电极组成如下电池:
标准氢电极||未知电极
该电池的电动势即为未知电极的氢标电极电势。又因为未知电极是在正极发生还原反应,所以由此定义的电极电势又称为氢标还原电极电势。现在我们结合数轴来说明电极电势及其在理解氧化还原顺序方面的应用。如图2所示,我们把氢电极电势放在数轴的0点,则数轴正负两端的数值就代表未知电极电势的值。下面我们以回答两个问题的方式来进一步阐述如何结合数轴理解电极电势的定义及其应用。
① 如果把标准氢电极电势定为0.1 V (图2b),其他电极电势如何变化?
答:因为各个未知电极与标准氢电极之间的电势差不变,所以未知电极的电势就是在原来的电极电势(图2a)的基础上进行平移即可,数值上在原来电极电势的基础上+0.1 (图2b)。
② 如何理解记忆“电极电势越负,越容易被氧化;电极电势越正,越容易被还原”?
答:我们已熟记的金属活动顺序表为[7]:

从图2可知,活泼的K在数轴的最左端,即在数值上是最小的,因此,我们自然得出电极电势越负,越容易被氧化,而惰性的Au在最右边,电极电势越正,越容易被还原。

图2 数轴与电极电势的表示
3 数轴与电极极化
电极的极化是指电极工作时随着电极上电流密度的增加其电极电势偏离可逆电极电势的现象,偏离程度的大小用超电势或过电位来衡量。下面我们从两个方面阐述如何结合数轴理解电极的极化现象及其对电解的影响。
① 电极极化会使得电池实际做功比其可逆功小,而使得电解时需要比可逆电动势更大的电压。图3a给出了电池的极化曲线及对应的数轴模型,正极和负极极化曲线分别位于数轴的正负端,这与前面电池符号的定义一致。从图中我们可以看出,正极极化曲线和负极极化曲线近似对称,相应的电位都向数轴0点方向靠拢,最后电池可做的功的大小数值zFE不可逆小于可逆电池功的大小zFE可逆。对于电解池(图3b),正好相反,电极的极化导致电极电位由数轴中心向两边移动,导致实际需要比可逆电池电动势更大的电压。无论是原电池中的向原点靠拢,还是电解池中的远离原点,都是朝着超电势增大的方向。基于这些特点,我们总结为“靠拢原点,做更小的功;远离原点,需更大的电压”。在这里,“靠拢”可以理解为数轴上两点相互靠拢,间距变小(寓意更小的功);而“远离”可以理解为数轴上两点相互远离,间距变大(寓意更大的电压)。最后,基于数轴右边的数减去左边的数为正值,可以理解记忆超电势计算定义的惯例,定义超电势为正值[13]。即,对于电解池,阴极的超电势η阴= (φ可逆-φ不可逆),而阳极的超电势η阳= (φ不可逆-φ可逆)。例如[13],有0.005 mol·kg-1的ZnSO4溶液,Zn2+在阴极上的理论析出电势(φ可逆)为-0.808 V,而实际的析出电势(φ不可逆)为-0.838 V,则η阴= -0.808 - (-0.838) = 0.030 V。

图3 原电池(a)和电解池(b)的两极极化与数轴模型的对应关系
② 在电镀的时候,为什么比氢活泼的一些金属如Zn可以比H更早析出?从图3b我们可以看到电极极化导致阴极的电位向更负的方向移动,即向更不容易被还原的方向移动。从图4的数轴模型可以很直观地看出,在没有极化时,H的电极电势(设中性溶液,φH+/H)位于Zn的电极电势(φZn2+/Zn)的右边,H更容易析出。发生极化后,由于H具有较大的超电势(η),其极化后的电极电势φ’H+/H移到了φZn2+/Zn的左边,导致了Zn更易析出。
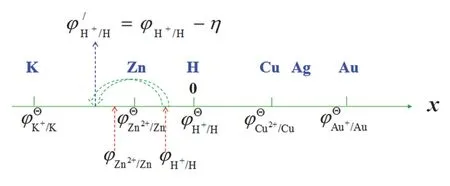
图4 超电势影响离子的氧化还原顺序的数轴模型
4 结语
数轴模型本身非常简单,极易记忆,可以帮助学生很好地理解和记忆电池符号的规定。金属活动顺序表在数轴上的体现,可以帮助学生理解电极电势的大小与金属氧化还原顺序之间的关系。电极极化的概念及对电解的影响从数轴上可以直观地体现。本文讨论的三方面内容涉及电化学教学的最基本概念和电化学电极从非极化到极化的进阶内容。本文对教师来说,是模型化物理化学教学内容的一个完美例证,而对学生来说,则是物理化学学习简单化的一个标样。本论文的模型化方法已在多届学生中实践并收到好评。
