终末期肾病患者脑区局部一致性及功能连接改变的fMRI研究
2022-07-30白迪马驰王成健周彤王家臣毕玉珍任延德
白迪,马驰,王成健,周彤,王家臣,毕玉珍,任延德*
终末期肾病(end-stage renal disease,ESRD)是指各种慢性肾病的终末阶段,患者常伴有多种神经系统并发症,如急性脑血管病、认知功能损伤等,其中认知功能损伤以抽象思维和执行功能受损为主[1-2]。认知功能受损影响患者的生活质量及治疗的依从性,严重时患者出现焦虑、抑郁甚至死亡的风险显著增加[3]。因此,我们迫切需要了解ESRD患者出现脑损伤背后的神经病理学机制。
局部一致性(regional homogeneity,ReHo)作为静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)的算法之一,用于量化区域内局部神经元活动的一致性,已经逐渐成为探究ESRD患者认知功能损伤的神经病理学机制的重要工具[4-5]。Li等[4]通过ReHo算法研究发现ESRD患者出现异常的大脑活动主要分布在与记忆和认知相关的皮质。虽然ReHo算法可以反映局部大脑神经元之间的协调和一致性,却无法评估局部脑活动异常是否伴有不同脑区之间功能整合的损害。功能连接(functional connectivity,FC)通过评估远距离体素或感兴趣区域间时间序列的相关性,反映大脑不同区域之间神经元活动的协调和相互作用[6]。Chen等[7]使用ReHo和FC算法发现ESRD患者在多个脑区的ReHo值显著降低,且与未进行血液透析的ESRD患者相比,血液透析患者在某些区域显示出更低的ReHo值,区域间FC增强,提示血液透析患者的功能障碍更严重,脑功能重组更普遍。然而Chen的研究主要集中于评估血液透析对ESRD患者脑功能的影响,并未就ESRD患者出现脑损伤的神经病理学机制进行深入探究。因此,本研究选取ReHo值改变的区域作为感兴趣区(regions of interest,ROI)进行FC分析,探究ESRD患者脑局部神经元功能活动的变化及其与实验室检查之间的相关性。
1 材料与方法
1.1 研究对象
选取自2018年8月至2019年12月于青岛大学附属医院肾内科收治的终末期肾病患者38例,纳入ESRD组。同期在青岛市市南区招募年龄和性别匹配的38例健康志愿者纳入健康对照组。本研究通过青岛大学附属医院医学伦理委员会批准(批注文号:QYFYWZLL26750),所有受试者均已签署知情同意书。
ESRD组纳入标准:(1)经青岛大学附属医院确诊为慢性肾脏病5期,肾小球滤过率低于15 mL/(min·1.73 m2)[8];(2)年龄18~70岁;(3)无磁共振检查禁忌证、幽闭恐惧症。
排除标准:(1)重度脑外伤病史;(2)颅内器质性病变,如肿瘤、梗死、出血等;(3)脑血管病如脑动静脉畸形、烟雾病等;(4)精神疾病史;(5)药物滥用史(药物、乙醇或香烟);(6)高血压病、糖尿病、冠心病、心力衰竭、肝肾功能衰竭等严重系统性疾病;(7)对试验不配合或无法有效完成磁共振扫描的受试者。2 名ESRD患者和2 名健康受试者因腔隙性梗死灶被排除,4 名健康受试者因头动幅度较大而被排除。最终,36 名ESRD 患 者(男21 例,女15 例)和32 名 健 康 受 试 者(男19例,女13例)被纳入本次研究。
1.2 研究方法
1.2.1 实验室检查
ESRD组患者在进行磁共振成像前24 h内均完成实验室检查,包括血清肌酐、尿素、血红蛋白、红细胞比容、血清钾、血清钠和血清钙水平。
1.2.2 采集磁共振数据
使用美国GE Signa HDX 3.0 T磁共振扫描仪和标准头部线圈进行数据采集。扫描过程中,患者仰卧,使用泡沫板以减少头动,并戴有防噪耳机。患者闭上眼睛但保持清醒,保持放松状态,避免做任何特定的思考活动。首先获取所有受试者的常规T2 加权像(T2-weighted images,T2WI)以及T2-液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)图像,以避免患者存在任何器质性病变。其次扫描患者的三维T1加权像(three-dimensional T1-weighted images,3D-T1WI)以及rs-fMRI图像。所有扫描均由一名有3年及以上放射操作工作经验的技师完成,器质性病变的诊断由一名有5年及以上放射诊断工作经验的中级职称医师完成。
采用单次激发梯度回波-平面回波成像序列采集rs-fMRI图像,扫描参数如下:TR/TE 3000 ms/40 ms,FOV 240 mm×240 mm,翻转角90°,矩阵96×96,层厚5 mm,层间隔0 mm。每个时间点扫描25层,共采集125个时间点,扫描时间约6 min。采用三维磁化准备快速梯度回波序列获取3D T1WI 图像,扫描参数如下:TR/TE 5600 ms/1.7 ms,FOV 256 mm×256 mm,矩阵256×256,层厚1.2 mm,层间隔0 mm,扫描时间约5 min。
1.2.3 rs-fMRI数据处理
借助dcm2niix 软件(https://www.nitrc.org/projects/dcm2nii/)将原始数据统一转换为NFITI格式。使用基于MATALAB 2014A 平台的RESTplus_V1.22 版本软件包进行数据处理。步骤如下:(1)去除前10 个时间节点所扫描的图像,以排除最初不稳定的信号;(2)去除在任意方向移动超过3 mm 或者旋转角度超过3°的图像;(3)针对受试者脑组织的大小、形状不同进行图像配准;(4)将所有研究对象的图像与标准模板进行标准化;(5)以大小为3 mm×3 mm×3 mm 体积单元对图像数据进行重新采样;(6)对预处理后的rs-fMRI 数据进行去线性漂移、低频滤波(0.01~0.08 Hz)处理,减少低频线性漂移和高频生理性噪音如呼吸声和心跳声造成的影响;(7)去除全脑协变量、头动信号、脑白质信号及脑脊液信号。
ReHo分析:使用RESTplus_V1.22软件计算每个体素的肯德尔和谐系数(Kendall's Concordance Coefficient,KCC),将每个体素的ReHo 值除以全脑ReHo 均值,得到标准化的ReHo 图,再对标准化的ReHo 图进行平滑校准,用于后续的统计分析。
FC 分析:根据ReHo 结果,选取ESRD 组与对照组ReHo 值存在显著差异的脑区作为ROI 进行FC 分析,构建ROI 两两之间的连接矩阵。计算受试者每对ROI 的时间相关性,使用GRENA 软件(https://www.nitrc.org/projects/gretna)分析ESRD 组与对照组之间FC 值的差异[9]。使用BrainNet Viewer 软件包(https://www.nitrc.org/projects/bnv)将两组间FC 差异的区域映射到皮层表面,并进行可视化处理[10]。
1.3 相关性分析
为探究ESRD患者脑自发性脑活动的变化,并分析其与临床变量之间的关系,提取两组存在差异性脑区的ReHo值、FC值与实验室检查结果进行Pearson相关性分析。
1.4 统计学分析
使用SPSS 22.0 软件分析受试者的一般临床资料,数值用均值±标准差表示,确定显著水平为P<0.05。使用RESTplus1.22 软件对ESRD 组和对照组的ReHo 值及FC 值进行统计分析,AlphaSim 校正,P<0.05为差异有统计学意义。
2 结果
2.1 人口统计资料及临床资料
ESRD 组和对照组的性别构成、年龄、受教育年限的差异无统计学意义(P>0.05),结果见表1。

表1 ESRD组与对照组基本资料的比较Tab.1 Comparison of clinical data between ESRD patients and control group
2.2 ReHo分析
与健康对照组相比,ESRD 组的ReHo 值在左侧颞极区、右眶部额下回、双侧直回ReHo 值显著升高(P<0.001,AlphaSim 校正),在双侧距状裂周围皮层、左侧额下回、右侧颞上回、右侧缘上回ReHo值显著降低(P<0.001,AlphaSim校正),结果见图1、表2。
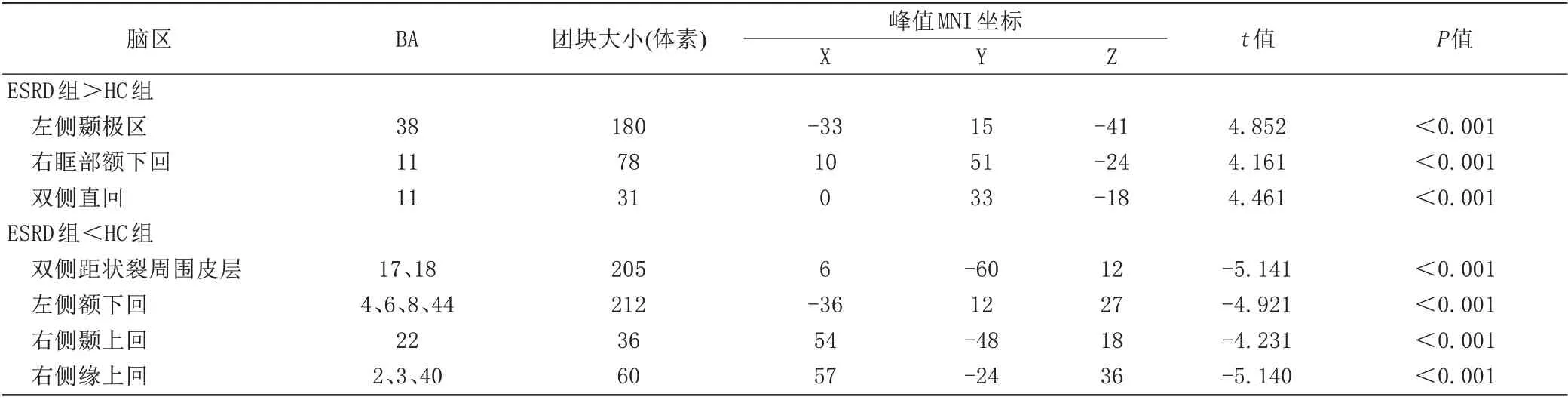
表2 ESRD组与对照组ReHo值显著差异的脑区Tab.2 Differences in ReHo values between ESRD patients and control group
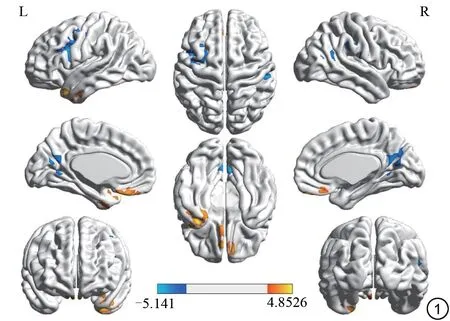
图1 ESRD 组与对照组ReHo值差异比较图(P<0.001,AlphaSim 校正)。橙色区域:ESRD 组>对照组,蓝色区域:ESRD 组<对照组。ESRD:终末期肾病。Fig. 1 Differences in ReHo values between end-stage renal disease patients and healthy control group.The orange area:end-stage renal disease patients group>healthy control group, the blue area:end-stage renal disease patients group<healthy control group.
2.3 基于ROI的FC分析
与健康对照组相比,ERSD 患者右侧距状裂周围皮层与左侧额下回、右侧缘上回的FC 减弱,右侧缘上回与右侧颞上回的FC 减弱[基于网络的统计分析(network-based statistic,NBS)校正[11],P均<0.05],结果见图2、表3。

图2 ESRD组与对照组基于感兴趣区的功能连接差异(NBS校正,P均<0.05)。TPO.L:左侧颞极;IFG.L:左侧额下回;CAL.R:右侧距状裂周围皮层;REC:双侧直回;ORBinf.R:右眶部额下回;SMG.R:右侧缘上回;STG.R:右侧颞上回;ESRD:终末期肾病;NBS:基于网络的统计分析。Fig. 2 ROI-based FC abnormalities between end-stage renal disease patients and healthy control group (P<0.05). ROI: regions of interest; FC: functional connectivity; TPO.L: left temporal pole; IFG.L: left inferior frontal gyrus;CAL.R: right calcarine sulcus; REC: rectus gyrus; ORBinf.R: right orbital inferior frontal gyrus; SMG. R: right supramarginal gyrus; STG. R: right superior temporal gyrus; ESRD: end-stage renal disease; HC: healthy control;NBS:network-based statistic.

表3 ESRD组较HC组功能连接异常的脑区Tab.3 ROI-based FC abnormalities between ESRD patients and control group
2.4 相关性分析
右侧距状裂周围皮层ReHo值与血红蛋白水平(r=0.347,P=0.048)及红细胞比容呈正比(r=0.357,P=0.041),结果见图3。
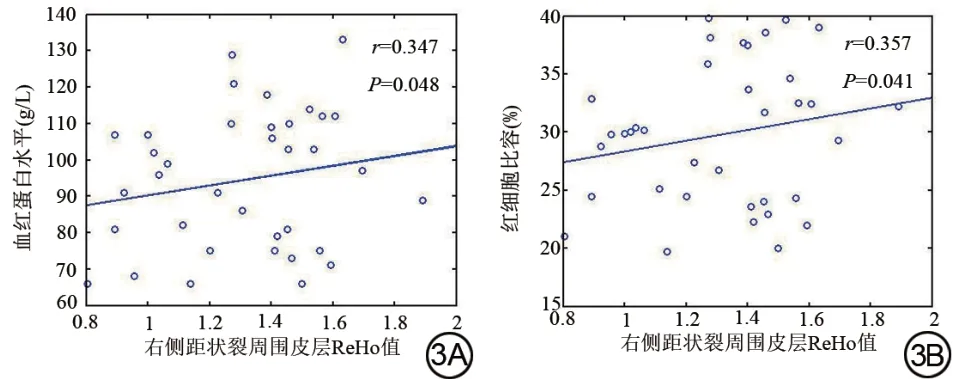
图3 终末期肾病组脑区ReHo 值变化与临床变量间血红蛋白水平(3A)及红细胞比容(3B)相关关系的散点图。ReHo:局部一致性。Fig. 3 Scatter plot of correlation between changes in ReHo value of brain region and hemoglobin levels (3A) and erythrocyte volume (3B) in end-stage renal disease patients.ReHo:regional homogeneity.
3 讨论
本研究采用ReHo及FC算法发现ESRD患者在额叶、颞叶、顶叶及枕叶多个脑区存在自发脑活动异常,且在部分脑区出现FC损伤,提示ESRD患者存在局部及远程大脑功能活动同步障碍,为进一步理解ESRD患者脑损伤的神经病理学机制提供了新的思路。
3.1 本研究中ReHo值及FC改变的意义
ReHo 使用KCC 评估给定体素的时间序列及其相邻区域之间的相似性,可以反映其神经同步性。大脑皮层中的同步活动对于跨解剖分布但功能相关的神经元活动的空间和时间进行协调和整合[11-12]。本研究发现ESRD 患者在多个脑区出现ReHo 值升高或降低,其异常表明区域神经元之间协调和整合的能力减弱,暗示脑神经功能受损并可能引发相关疾病。
本研究发现,与对照组相比,ESRD 患者在双侧距状裂周围皮层、左侧额下回、右侧颞上回、右侧缘上回的ReHo值显著降低。距状裂周围皮层位于枕叶内侧面,是视皮层的重要组成部分,涉及视觉信息的初步加工及整合,并且与视觉记忆、注意等神经心理活动密切相关。额叶主要与随意运动和高级精神活动有关,额叶功能障碍主要表现为自发性、洞察力、判断力和反应抑制能力降低[13]。陈佩娜等[14]使用ReHo算法研究发现ESRD患者在多个脑区ReHo值显著降低,其中包括额下回,并且额下回的ReHo值与认知功能损害具有较好的相关性。缘上回是顶下小叶的重要组成部分,顶叶通常被认为具有不同的注意力功能,如注意转移、视觉空间注意、工作记忆和超模态控制等[15-16]。颞叶与记忆、情感以及语言理解有关,参与认知功能的调节[17]。Peng等[18]研究发现与健康受试者相比,ESRD患者在颞叶的大脑固有活动受到损害,且与神经心理测试评分具有相关性,提示颞叶是ESRD患者功能损伤的脑区。Liang等[19]研究也发现ESRD患者在额叶、颞叶、顶叶的ReHo 值显著降低,且与认知功能损伤有关,这与我们的研究结果一致,提示额叶、颞叶、顶叶神经同步性降低可能与ESRD患者的注意力、记忆力以及高级精神活动异常有关,可以作为ESRD患者神经功能异常的特殊标志。此外,本研究发现ESRD患者在双侧直回、左侧颞极以及右眶部额下回的ReHo值显著升高,这可能是脑损伤早期区域内代偿所致。
在本研究中,ESRD患者ReHo值出现异常升高或降低的区域多位于默认模式网络(default mode network,DMN)。DMN脑区包括后扣带回皮质、楔前叶、内侧前额叶皮层、顶下小叶等,主要参与多种认知功能处理,涉及广泛的视觉、听觉、语言、记忆和运动等方面[20-21]。此前多项基于静息态功能磁共振的研究证实ESRD患者在DMN脑区的ReHo、ALFF值以及FC发生改变,提示ESRD患者在DMN脑区的自发性脑活动异常具有良好的可重复性[22-26]。因此本研究选择ReHo值异常的区域作为ROI进行FC分析得到的结果是可靠的。
本研究另一个重要发现是右侧距状裂周围皮层与左侧额下回、右侧缘上回的FC减弱,右侧缘上回与右侧颞上回的FC 减弱,脑区之间连接性下降可能是大脑网络中神经元连接中断及功能整合障碍所致[27-28]。值得注意的是ESRD 患者FC 减弱的脑区与ReHo 值显著降低的区域一致,与先前研究相比,本研究进一步揭示ESRD患者可能存在局部及远程大脑功能活动的同步障碍。
3.2 相关性结果的讨论
相关性分析显示ESRD患者在右侧距状裂周围皮层的ReHo值与血红蛋白水平、红细胞压积成正比,推测贫血状态可能与右侧距状裂周围皮层自发性脑活动异常有关。终末期肾病透析治疗患者肾性贫血的发生率为74.29%[29],低血红蛋白或低红细胞压积会减少大脑氧合,增加神经元退化风险[30],提示临床需及时纠正患者的贫血状态来预防ESRD患者脑损伤的进展[31]。
3.3 局限性
本研究尚存在一些不足之处。首先,没有对受试者进行认知功能测试。其次,本研究的样本量偏小,需进一步扩大样本量对比透析方式、透析持续时间对ESRD患者ReHo值与FC值的影响。最后,我们的研究是一项横断面研究,无法纵向比较ESRD患者处于疾病不同阶段各个脑区出现脑活动异常的动态变化。
综上所述,本研究将ReHo 和FC 两种算法相结合,发现ESRD 患者在多个脑区存在局部功能活动同步性异常,主要累及DMN 区域,且在部分脑区表现出局部及远程大脑功能活动同步障碍,有助于进一步理解ESRD患者脑损伤的神经病理学机制。
作者利益冲突声明:全体作者均声明无利益冲突。