水生蔬菜答农民问(55-2):菱角对生态环境适应能力如何?在生态环境改良中有哪些主要用途?
2022-07-29刘义满王爱新乐有章魏玉翔
刘义满 王爱新 乐有章 魏玉翔
2 菱角对富营养化水体的净化效果
2.1 菱角植株生物量大,有利于大量吸收和积累水体营养物质及重金属等污染物
菱角植株生长迅速,生物量大。特别的一点,菱角除了具有土中根系外,其沉水茎上具有大量兼具吸收、光合及贮藏功能的不定根(图1),有利于大量吸收和富集水体营养物质及重金属等污染物。李文朝[24]在江苏无锡五里湖的研究结果表明,菱角耐污性较强,生物量大;6月定植时植株水面叶片覆盖率约20%,1个月后水面叶片覆盖率即可达100%,最高生物量(鲜质量)达7 kg/m2以上。杨孟等[25]报道的太湖菱角(红菱)生物量则高达22.5 kg/m2。有人在美国哈德逊河流域调查,菱角植株干物质生产量可达1 kg/m2以上[26]。日本佐贺大学(Saga University)Arima等[27]利用从我国杭州及上海引进的大果型(单果鲜质量15~30 g,包括四角菱、二角菱及无角菱),源自日本的中果型(单果鲜质量5~10 g,均为四角菱)和小果型(单果鲜质量5 g以下,均为二角菱)菱角进行种植比较试验,结果植株干质量(包括地上和地下部分)大果型和中果型菱角大于600 g/m2(400 kg/667 m2),小果型菱角植株干质量产量300~500 g/m2(200~334 kg/667 m2)。易磊[28]在河北白洋淀调查结果表明,菱生长期4月至10月初,主要生长期7~9月,高速生长期集中于40~80天(即7~8月),植物生物量在果实成熟的9月下旬达到最大值。植株体内氮、磷累积量在植株生长最旺盛的8月上旬达到最大值。其中,叶片具有最大生物量和氮、磷积累量,其次为茎,根最小。在种植水生植物的水体中,污染物去除总量中,有一部分是通过植株吸收作用去除的。植物通过吸收作用去除的污染物量占污染物去除总量的比例,即为植株吸收贡献率。徐蕾等[11]研究结果表明,在严重富营养化和异常富营养化水体中,TN和TP去除率中的菱角植株吸收贡献率可以分别达34.8%~36.9%和24.1%~34.5%。

图1 菱角植株生长量大、不定根众多,水体净化功能强,可以做到生态效益和经济效益协调统一
2.2 菱角对重金属的富集积累能力
黄亮等[29]2000年对武汉地区相关湖泊的调查结果(表1)显示,除Pb为叶片富集能力大于根部外,其他为根部大于叶部,如武湖的菱角植株根部和叶部重金属质量分数比值分别为Zn 2.30、Cr 2.80、Cu 2.20、Co 3.80、Ni 2.60、Cd 2.30、Pb 0.85。菱角叶部对水中重金属富集 系 数F(×103)分 别为Zn 3.53、Cr 2.57、Pb 5.00、Cu 3.99、Co 3.69、Ni 3.61、Cd 66.20。生物体内Cd与金属硫蛋白的紧密度比Zn大3 000倍,Zn和Cd与硫蛋白中的巯基结合时,Cd可以置换Zn。Zn/Cd值可以反映重金属积累能力,也间接指示植物的破坏程度,如武汉斧头湖、涨渡湖及武湖菱角叶片内的Zn/Cd值分别为73.1、9.1及15.1。

表1 武汉斧头湖、涨渡湖及武湖内菱角叶片重金属质量分数[29] μg/g
周娜[30]研究结果表明,菱角不定根对Hg2+和Cu2+的最大吸附量分别为5.5、9.75 mg/g,最大吸附比表面积分别为0.65、1.51 m2/g。
印度Vinod等[31]进行的植物修复研究(Phytoremediation experiments)中,利用菱角(Trapa natans)处理城市污水(municipal wastewater),文中城市污水取自活性污泥法城市污水处理厂(activated sludge process-based municipal wastewater treatment plant),结果显示,菱角能在P〈0.05、0.01或0.001水平上显著减少Cd、Cr、Cu、Fe、Mn、Pb、Zn等重金属含量。菱角对这些指标的去除速率在处理15~45天内逐渐增加,处理60天时略有放缓,但去除量达到最大值。Cd、Cu、Fe、Mn及Zn的大部分积累于叶部,而大部分Cr和Pb积累于根部。
王方园等[32]研究表明,培养液中添加砷和汞后18天,菱角根、茎、叶对水体砷和汞的富集系数明显大于对土壤砷和汞的富集系数;对水体汞的富集能力大于水体砷;根部的富集能力大于茎和叶(表2)。该研究结果还表明,菱角对砷和汞的富集能力大于茭白。分析还认为,汞的存在会抑制水中砷向菱角迁移。
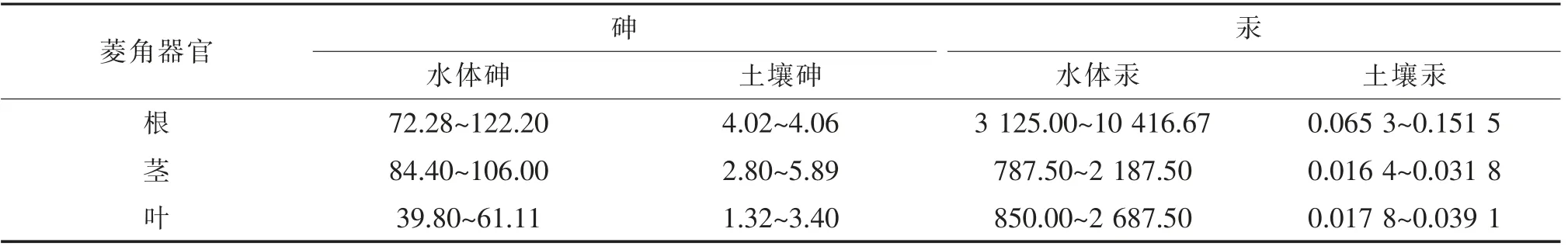
表2 菱角根、茎、叶对水体和土壤中的砷、汞的富集系数[32]
虽然不同研究结果中,菱角对重金属等的富集能力差异较大,但总体而言,菱角对重金属具有较强的富集能力,可以用于重金属清除。
2.3 菱角对富营养化水体的净化作用
关于菱角对富营养化水体的净化作用,我国一些研究人员进行过模拟研究(表3)。综合表3模拟研究结果,种植菱角对富营养化水体化学需氧量去除率为42.40%~67.52%,总磷去除率33.86%~87.50%,总氮去除率44.10%~87.92%,氨氮去除率58.0%~74.5%,均明显高于对照(高出对照的幅度,不同研究结果不一,低者13.3%~16.6%,高者267.43%),显示出较好的水体净化能力。另外,研究结果显示,种植菱角还可较大幅度增加水体透明度。至于水体溶解氧,有个别模拟研究显示,种植菱角可以大幅度增加其含量,但该结果与多数调查检测结果不相符合。

表3 模拟实验中菱角植株对水体富营养化物质的去除率 %
我国不同地区利用菱角进行的工程化水体净化示范项目中,亦显示出很好的效果。廖荣明[39]2008-2009年调查,安徽合肥烔炀河水质基本维持在Ⅲ~Ⅴ类,虽然菱角植株使水体溶解氧含量有一定程度降低,但总体上对水体氮、磷有良好净化效果。高吉喜等[40]在云南滇池流域自然条件下研究前置库对面源污水净化效率,7~8月,定植期菱角水面覆盖率约80%,结果氮净化率48.9%、磷净化率50.9%。王琴等[41]在白洋淀的监测结果显示,相较于无植被区,菱角种植区水体透明度(SD)0.74 m(增加45%);菱角种植区和菱角种植区外围水体TN、NH4+-N、TP以及底泥总氮(STN)和总磷(STP)均有一定削减效果,其中菱角种植区外围9月下旬TN去除率达63.5%,7月下旬和10月中旬TP去除率分别达到55.6%和88.4%;菱角种植区8月下旬铵氮去除率31.4%,10月中旬凯氏氮去除率45.2%。但是,9月下旬菱角进入采收期后,水体溶解氧低于无植被区。而且,菱角植株腐烂沉积会导致底泥总磷含量增加。刘存歧等[42]在河北白洋淀的研究结果显示,种植菱角的水体透明度比对照区平均增加0.55 m,增幅65%;浮游植物密度显著降低。另外,菱角的生物量、氮和磷含量以及氮、磷积累量均在7月30日达到峰值,水体透明度也最高,此后氮、磷积累量逐渐下降,到9月30日菱种植区水质反而劣于对照。王琴等[41]和刘存歧等[42]的研究结果均提示,利用菱角净化水体时,应注意合理配置种植密度,并及时清除菱角植株。
山东济宁南四湖湖区浅水域、废弃池塘、塌陷地水域、入湖河口水域等不同生态区内,种植菱角对富营养化水体起到很好净化效果。高敏等[43]调查结果表明,菱角种植区水体COD、TP、TN及NH3-N去除率分别为46.37%~57.03%、98.38%~99.60%、93.10%~96.15%及93.07%~98.63%。杨孟等[25]报道,在太湖梅梁湾中犊山和管社山菱控制性种养工程样地中,种植菱角(红菱)水域水质明显改善,与无水生植物水域相比,TN浓度降低约50%,TP降低20%~76%,Chla降低68%,水体透明度增加1倍。菱角生物量15 t/667 m2,其中氮同化去除量30.33 kg/667 m2,磷同化去除量4.87 kg/667 m2。
戴伟东等[44]对浙江温州三篛湿地内的2块大面积种植菱角种植区(分别约6 000、3 000 m2,用种量10 kg/667 m2,主要种植期5~10月)调查结果,与对照区比较:①水体透明度、营养盐和叶绿素a浓度等指标均有明显改善;②与非种植区比较,2个菱角种植区水体透明度在7月差异最显著,分别提高0.4和2.3倍;③TN在5月差异最显著,质量分数分别下降39.7%和20.6%;④TP含量在5~6月差异最显著,分别下降58.6%和42.6%;⑤氨氮在6月差异最显著,分别下降72.1%和61.3%;⑥叶绿素a分别在5~7月差异最显著,分别下降61.4%和77.5%,均差异显著。另外,菱角种植区内的高锰酸盐指数均低于非种植区,浮游动物密度显著降低。邵珊等[45]调查结果表明,在旱生蔬菜种植区排水下游种植一定面积菱角,使TN和TP分别下降98.08%和85.66%,表明菱角能有效拦截地表径流中的TN和TP。
印度Vinod等[31]研究结果显示,菱角能在P〈0.05、0.01或0.001水平上显著减少城市污水中总 溶 解 固 体(total dissolved solids,TDS)、电 导 率(electrical conductivity,EC)、五 日 生 化 需 氧 量(biochemical oxygen demand,BOD5)、化学需氧量(chemical oxygen demand,COD)、总凯氏氮(total Kjeldahl nitrogen,TKN)、磷酸盐(phosphate,PO43-)、钠(Na+)、钾(K+)、钙(Ca2+)、镁(Mg2+)等含量。修复研究结束后,菱角植株各生化成分(biochemical component)含量依次为总糖(total sugar)〉粗蛋白(crude protein)〉总灰分(total ash)〉粗纤维(crude fiber)〉总脂肪(total fat)。综合认为,菱角净化城市污水效果良好,用于处理活性污泥法城市污水处理厂污水,可以有效降低污染物含量。
2.4 菱角对氮素再悬浮的影响
黄沛生等[46]曾经在太湖梅梁湾口调查研究菱角对氮素再悬浮的影响,结果显示,菱角生长区内(生长区边缘20 m内处)水底泥层表层2 cm沉积物的有机物含量5.95%~11.49%,水面再悬浮物(resuspension)有机物含量21.86%~50.39%;菱角生长区外(生长区边缘30 m外处)水底泥层表层2 cm沉积物的有机物含量6.41%~12.03%,水面再悬浮物有机物含量15.19%~50.40%。菱角生长区内的沉积物和再悬浮物有机物含量差异不明显。但是,菱角生长区内和区外沉积物的再悬浮速率存在明显差异。菱角生长区内沉积物平均再悬浮速率218.46 g·m-2·d-1,仅为菱角生长区外(658.13 g·m-2·d-1)的33.20%。通过再悬浮作用,8月下旬至11月上旬菱角种植区内沉积物平均每天每1 m2带入水中的TN为719.63 mg,仅为菱角种植区外(1 536.14 mg)的48.85%。也就是说,在富营养化水体中种植菱角,能够显著降低沉积物再悬浮速率,进而降低水体TN含量。
2.5 菱角对藻类的抑制作用
唐萍等[47]进行的克藻研究中,栅藻(Scenedesmus arcuatusL.)藻液光密度OD650值达0.05时,植入菱角植株,植株叶片水面覆盖率50%,培养7天时,对照OD650值上升至0.12,而菱角种植处理的藻液OD650值降至约0.03。栅藻体内丙二醛积累量(常可反映机体胁迫损伤,特别是膜结构破坏程度)达150.3 nmol/g,为对照的1.69倍;SOD活性(其活性对多种环境因子的胁迫敏感)为671.7 U/g,仅为对照的60.02%。另外,利用已培养种植菱角6天的种植水,接种栅藻(起始OD650值0.05)培养7天时,OD650值下降至0.087,为对照的66.92%;栅藻内Chla含量963.1 U/g,仅为对照的68.39%。综合试验结果,菱角对栅藻生长具有抑制作用。李峰民等[48]试验结果,菱角不同部位浸出液对蛋白核小球藻(Chlorella pyrenoidosa)均有一定抑制作用,而且植物体经过干燥保存后,其浸出液仍具有化感作用。
3 菱角种植对水体质量的负面作用
利用菱角进行水体净化时,亦可能产生一定负面作用。例如,有调查结果显示,菱角覆盖度增加时,会导致水体溶解氧含量降低。水体溶解氧在硝化作用中起重要作用,硝化细菌正常代谢也需要溶解氧。每1 g氨氮(以氮元素计)转化为硝态氮,最大需要消耗4.57 g溶解氧。溶解氧较高时不会抑制硝化细菌的繁殖和硝化作用,较低时对硝化细菌有明显抑制作用。保障硝化作用彻底进行,硝化系统中的溶解氧含量应保持在2 mg/L以上。也就是说,水体溶解氧高有利于对水体中各类污染物的降解,从而使水体较快得以净化;反之,溶解氧低,水体中污染物降解较缓慢。国家标准GB 11607-1989《渔业水质标准》要求水体溶解氧含量“在连续24 h中,16 h以上必须大于5 mg/L,其余任何时候不得低于3 mg/L,对于鲑鱼类栖息水域冰封期其余任何时候不得低于4 mg/L”。天然水体中溶解氧含量一般为8~10 mg/L。
Caraco等[49]调查结果表明,在美国哈德逊河(Hudson River)流域,以菱角(Trapa natans)为主的植被区中40%的生长期内水体溶解氧浓度值低于2.5 mg/L,相比之下,在同一时期,以美国本地物种美洲苦草(Vallisneria americana)为主的植被区,水体溶解氧浓度5 mg/L以上。廖荣明[39]2008-2009年调查表明,安徽合肥烔炀河水体溶解氧含量4.80~6.25 mg/L,其与高锰酸钾指数(CODMn)、氨氮(NH4+-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)及总氮(TN)之间的偏性关系数(partial correlation coefficient)均为极显著负相关。表明水体溶解氧含量在4.80~6.25 mg/L范围内降低的同时,水体CODMn、NH4+-N、NO3--N、NO2--N及TN的含量会极显著增加。而曹新光等[50]在湖北黄州市遗爱湖的调查结果表明,水体溶解氧(DO)含量7.2~10.0 mg/L,与天然水体含量一致,属于正常水平。计算表明,遗爱湖水体溶解氧含量、pH值(7.5~8.5)、CODMn(6.50~11.10 mg/kg)、NH3-N(0.32~0.72 mg/kg)、TP(0.09~0.21 mg/kg)、TN(0.88~1.46 mg/kg)、F-(0.31~0.37 mg/kg)、Chla(0.040~0.092 mg/kg)及SD(水体透明度,0.31~0.47 m)等指标之间,尽管TP与pH、SD与Chla之间呈极显著负相关,NH3-N与F-之间呈显著正相关,CODMn与Chla之间呈极显著正相关,但水体溶解氧其他指标之间的相关系数则均未达显著水平。
又如,菱角植株腐解也可能导致水体质量变劣。汤志凯等[51]设置菱角植株初始生物量密度为5.7 g/L,在模拟条件下腐解时,腐解速率在第2天达到最大值,之后是快速腐解阶段,一直到第45天进入较低水平的缓慢分解阶段,至第120天则腐解率达到94.5%。腐解速率与水体化学需氧量(高锰酸钾指数CODMn)及可溶性有机碳(DOC)含量之间均呈极显著正相关。整个腐解周期内,平均磷释放率为0.670 mg/g(以无机磷酸盐为主);腐解120天时,植株总磷(TP)含量比初始浓度降低52.31%,水体TP与初始值相近,而底泥TP比初始值增加284%,植株腐解向水体释放的磷与底泥之间发生明显交换。王琴等[41]和刘存歧等[42]在河北白洋淀的研究结果均显示,9月下旬菱角进入采收期后,菱种植区水质反而劣于对照。其中,水体溶解氧低于无植被区,菱角植株腐烂沉积导致底泥总磷含量增加。该结果与有关研究人员利用芡实进行的研究结果类似[52]。
尽管菱角种植对水体环境有一定的负面作用,但综合而言,菱角种植对水体环境的改良效果大于负面效果。
4 提高菱角水体净化效益的建议
4.1 菱角与其他植物配合,构建周年水体净化植物配置模式
李文朝[24]建议,利用伊乐藻(Elodea nuttallii)、菹草(Potamogeton crispus)等耐寒型沉水植物,与菱(Trapaspp.)、凤眼莲(Eichhonia crassipes)等夏季净化能力较强的喜温植物组成常绿型水生植被,形成生长期和净化功能的季节性交替互补,在冬季和夏季都具有较强的水质净化能力和抑藻能力。与处理区外相比,水体透明度提高2倍以上,消光物质含量减少80%左右,NH4+、PO43-降低50%左右;浮游藻类受到强烈抑制,Chla仅为处理区外的20%~50%。如果在水生蔬菜范围内选择配置植物,则菱角(春夏秋)—水芹或豆瓣菜(秋冬春,浮水种植)也是一个可行的水体净化植物周年配置模式。
4.2 对于主要用于水体净化的菱角植株而言,要选择适宜密度、及时采收产品和清除植株残体
多项研究结果提示,种植菱角进行水体净化时,除了保持适宜的密度外,宜及时清除菱角植株残体,防止源自菱角植株的有机质过量积累于底泥,导致第二次污染。如易磊[28]在河北白洋淀调查认为,菱角适宜收割时期为9月末。根据关保华等[12]研究,利用菱角进行水体净化时,适当提高密度,有利于茎叶中的磷积累,便于随同茎叶一同清除。
