生物活性玻璃的抗菌机制及其影响因素
2022-07-29董峻池郑慧玲卫羽雯
董峻池,郑慧玲,卫羽雯,马 骞
生物活性玻璃(bioactive glasses,BGs)由Larry Hench在1969年发明,是一类以SiO2-Na2O-CaO-P2O5氧化物体系为基础的材料,有良好的生物活性与生物相容性。此外,BGs的抗菌作用显著,除了对常见致病菌有抗菌效果外,对口腔细菌也有显著抗菌作用,可作为潜在的抑菌剂用于治疗细菌相关的口腔疾病。然而目前对于BGs的抑菌机制尚未见总结性研究报告,因此本文对口腔疾病常见致病菌以及BGs的抗菌机制和影响因素作一简要综述。
1 口腔常见致病菌
迄今为止发现的人类口腔细菌约有700多种,它们黏附在牙齿表面形成生物膜,在正常情况下与口腔固有环境维持动态平衡,当平衡被打破时,会导致口腔疾病[1]。牙菌斑生物膜黏附在牙齿或修复体表面,是由基质包裹的、细菌相互黏附的微生物群落[2],主要分为龈上牙菌斑生物膜和龈下牙菌斑生物膜,龈上菌斑以革兰氏阳性兼性厌氧菌为主,是龋病的始动因子;龈下菌斑中的优势群落为革兰氏阴性厌氧菌,与牙周病的发展密切相关[2]。
目前研究认为,具有耐酸和产酸能力的变形链球菌与乳酸杆菌是龋病发病的主要原因,此外,部分学者认为双歧杆菌、放线菌、韦荣球菌、普氏菌等同样参与了龋病的形成[3]。变形链球菌能通过疏水作用黏附于牙齿表面,形成具有高亲和力的生物膜[4-5]。当糖分摄入过多时,微生物酵解糖产生有机酸,生物膜中的pH值下降,酸性环境有利于变异链球菌和乳酸杆菌的增殖,进而更促进酸性代谢产物的释放,当pH值低于5.5时会导致牙釉质脱矿发生龋病[6]。由此可推断,导致龋病的并不是细菌本身,而是它们创造的微环境,针对致病菌的抗菌剂或改善微环境的材料都可能对龋病产生治疗效果。
牙周病是指发生在牙周支持组织导致的各种疾病,目前各项研究已证明,龈下菌斑中的细菌及其产物是导致牙周病发生发展必不可少的因素[2]。齿垢密螺旋体、牙龈卟啉单胞菌和福赛坦氏菌构成的红色复合体和具核梭杆菌、伴放线聚集杆菌、中间普氏菌等[7]共同参与牙周病的形成,其中牙龈卟啉单胞菌是公认的牙周致病菌,可破坏宿主的免疫系统[8]。
牙周病时牙菌斑生物膜的形成呈动态,主要包括细菌的定植、细菌之间相互附着与共聚、斑块成熟三大过程[9]。牙周病的发展伴随着革兰氏阳性菌的减少和革兰氏阴性菌的富集。通常认为革兰氏阳性链球菌是生物膜形成中的初始定植者[6],其中血链球菌是公认的最早定植的链球菌,可维护口腔健康;除此以外变形链球菌能使表面的环境变为厌氧环境,为后续厌氧菌黏附做准备[4],还能产生胞外聚合物如葡聚糖,使生物膜对抗菌剂具有更强的抵抗力[6];戈登氏链球菌也可促进革兰氏阴性厌氧菌的黏附,如可以通过链球菌抗原Ⅰ/Ⅱ蛋白与牙龈卟啉单胞菌的次要菌毛抗原Mfa1相互介导发挥作用[10]。
牙周病后期定植的厌氧菌增加,种类繁多,共同促进生物膜的成熟。如具核梭杆菌可表现为共生菌,通过表面的黏附素连接早期的革兰氏阳性菌与晚期的革兰氏阴性菌[11]。卟啉单胞菌属、普氏菌属和齿状密螺旋体可以为其他厌氧菌提供氨基酸等营养物质,在生物膜的形成中发挥重要作用[12]。
除了上述与龋病、牙周病相关的致病菌,口腔中还有一些细菌在常见的感染性疾病中扮演重要的角色。如粪肠球菌与根尖周炎的发展和根管治疗后再次感染相关[13-14];普氏菌、梭杆菌、消化链球菌在干槽症患者的拔牙窝内含量较高[15]。
2 BGs的分类及抗菌作用
BGs按组成成分的不同分为硅酸盐系、磷酸盐系和硼酸盐系[16],硅酸盐系根据硅含量差异又可分为45S5 BGs、S53P4 BGs和58S BGs等多种类型,不同类型BGs的抗菌能力有一定差异。BGs对多种细菌有快速杀菌效果,不仅可作用于常见的金黄色葡萄球菌、大肠杆菌等,也可作用于口腔内的部分重要致病菌。
45S5 BGs是Hench等[17]首次发现的组成为45.0% SiO2、24.5% Na2O、24.5% CaO、6.0% P2O5的四元结构的BGs,国内外对45S5 BGs的抗菌效果也有广泛的研究和讨论。Allan等[18]将血链球菌、变形链球菌和黏性放线菌这三种龈上细菌分别加入3种不同的培养基,并暴露于BGs颗粒,1 h后杀菌率>65%;对牙龈卟啉单胞菌、具核梭杆菌、中间普氏菌和伴放线聚集杆菌这四种龈下细菌进行处理也得到类似结果。许玉婷等[19]测定了45S5 BGs对血链球菌、变形链球菌和黏性放线菌3种常见龈上菌的最低抑菌浓度(minimum inhibitory concentration, MIC)和最低杀菌浓度(minimum bactericidal concentration, MBC),分析得45S5 BGs对3种细菌的抑制能力顺序为:黏性放线菌>变形链球菌>血链球菌;杀菌能力顺序为:变形链球菌>血链球菌>黏性放线菌,由此可见,相比于其他两种龈上菌,血链球菌对45S5 BGs不够敏感,但有研究表明45S5 BGs可明显降低血链球菌生物膜的活力[20]。
S53P4 BGs(53% SiO2、23% Na2O、20% CaO、4% P2O5)被认为是BGs中抗菌能力最强的一类,对多重耐药菌株也有很大的抗菌潜力[21],在耐药菌横行的当下有极佳的临床应用前景。S53P4 BGs糊剂对口腔龈上及龈下菌斑有广谱抗菌作用,可使内氏放线菌在暴露后10 min内失去活性,伴放线聚集杆菌、牙龈卟啉单胞菌和变形链球菌在60 min内丧失活力,血链球菌在60 min内活性显著降低[22]。
58S BGs(58% SiO2、33% CaO、9% P2O5)抗菌性较其他几类BGs弱[23]。但在评估58S、63S、72S BGs纳米粉末的抗菌效果时,58S BGs作用相对较强,对铜绿假单胞菌、大肠杆菌混合金黄色葡萄球菌的MBC分别为100 mg/mL和50 mg/mL,63S BGs的MBC为100 mg/mL,而72S BGs未表现出抗菌作用,当浓度低于50 mg/mL时,三者都没有显示出抗菌性[20]。表1总结了几种BGs的抗菌效果。

表1 不同类型BGs的抗菌效果Tab.1 Antibacterial effect of different kinds of BGs
由于BGs具有上述抗菌作用,具有作为口腔抑菌剂的良好前景,因此,对BGs抗菌机制及其抗菌效果的影响因素的研究也显得更有意义。
3 BGs的抗菌机制
目前公认的BGs抗菌机制主要是形成针状玻璃碎片、释放离子增加溶液pH值、增加渗透压三大方面,其余还有:扰乱细菌膜电位、活性氧(reactive oxygen species,ROS)的作用、抗生物膜活性、Ca/P沉积、作为载体掺入抗菌剂等。
3.1 形成针状玻璃碎片
细菌可以通过静电作用黏附在BGs表面[24],继而BGs的针状玻璃碎片可破坏细菌的细胞壁,致细胞内容物流出,细菌死亡。
Hu等[20]在镜下观察到细菌大部分附着在BGs表面,黏附的细菌数量与BGs浓度成正比,这表明BGs具有细菌黏附性且黏附具有浓度依赖性。在透射电子显微镜下可见,BGs表面和靠近细胞的区域有大量针状碎片,能够刺破细菌的细胞壁,使细菌失去完整的结构,此时膜电位也可能发生改变[25]。这种BGs碎片质地均匀,染色较深,极有可能是BGs在液体环境中释放出的离子聚集形成的富硅层[24],但其具体形成、成分等仍有待进一步研究。
另外有研究表明,BGs的部分碎片可以在不破坏细菌的细胞膜的情况下直接进入细胞体内与胞内物质发生反应,细胞质出现凝集现象,这可能也是导致其抗菌的原因之一[24]。
相对于BGs,临床常用的抗生素作用机制主要分为干扰蛋白质合成、抑制细胞壁合成、影响细胞膜的通透性和抑制核酸转录复制这几方面[26],细菌对于抗生素的耐药性可通过降低细胞膜通透性、增强抗生素灭活酶和药物外排泵的表达、形成生物膜、抗性基因水平转移或突变使抗生素吸收减少或靶点改变等方式产生[27]。而BGs可通过机械损伤细菌细胞膜产生抗菌作用,因此不易产生耐药性。
3.2 增加溶液的pH值
BGs在液体环境中释放Na+、Ca2+等离子,与周围的H+或H3O+发生交换,增加pH值[28-30]。碱性环境可以减少体内细菌在表面的定植[18]。当pH值增加时,细胞膜中的磷脂或不饱和脂肪酸受损,破坏了膜的完整性破坏以及蛋白质的三维结构,膜蛋白变性使膜pH梯度发生变化,细胞内外的酶丧失生物活性,细胞代谢减弱;碱性溶液中的氢氧根离子能与细菌DNA发生反应,使基因丢失,抑制DNA复制,引起基因致死性突变[31-32]。
BGs也可能通过增加溶液的pH值,改变部分细菌的超微结构和基因转录水平从而发挥其抗菌作用。粪肠球菌在碱性环境下生存的生化机制的实验中,可见其Na+-K+-ATPase活性、细胞表面疏水性和生物膜形成增加,且此时大部分的基因转录水平随pH值的提高呈倍数增长,如与ATP酶活性相关的atpb、atpE;与粪肠球菌在碱性环境下形态的适应性改变有关的salB、FtsZ;与细菌黏附有关并参与生物膜形成的efa、ace、gelE、esp等[33]。这些基因对碱性环境下粪肠球菌的存活和生物膜形成有重要贡献,有助于更好地理解粪肠球菌的致病机制,优化BGs的抗菌效果。当溶液的pH值增加时,粪肠球菌的上述基因表达率增加,有利于其适应碱性环境,因此粪肠球菌对BGs的抵抗力较强;而当pH超过11时,编码与抑制ATP酶活性有关蛋白的atpE等大幅度增加,对粪肠球菌几乎具有致死效应。
3.3 增加渗透压
BGs释放出Na+、Ca2+、Si4+等可以提高环境的渗透压[29],使细胞内容物流出,从而导致细菌死亡[30],这一过程与pH值的增加几乎同时发生。
通常情况下,细胞内的离子浓度高于周边环境,从而对细胞膜产生正压。BGs释放出的离子可使环境中的离子浓度升高,根据渗透压计算公式Π=RTC(Π代表渗透压,R指气体常数,T指绝对温度,C是液体中的分子与离子浓度),随着离子浓度的升高,渗透压也显著上升,使细胞内外压力差减小,细胞膜上压力下降,细菌细胞内水分流失,大小、形状、膜应力水平等均发生变化,产生抗菌效果[34]。如Drago等[21]将多重耐药菌株(multiple drug resistant strain, MDR)与400 mg/mL的S53P4 BGs接触2 h,在扫描电镜下可见细菌收缩和胞膜结构扭曲,与未经处理的细菌相比,大小差异较大,这可能是细菌对BGs引起的高渗环境的反应。
3.4 ROS的作用
ROS在抗菌和细菌耐药方面发挥重要作用,有文献表明BGs的抗菌机制与ROS的产生密切相关[29]。
ROS是氧的单电子还原产物,细菌有氧呼吸会产生一部分ROS[35],同时生成超氧化物歧化酶等中和、抵御之前的ROS。BGs组成体系中含有SiO2,可通过在应变表面打开Si—O—SiO三元环诱导细胞产生ROS膜蛋白并扰乱细胞膜电位[36-37],并进入细胞内与酶、代谢和遗传物质等反应[38],当ROS产生过多,超出抗氧化酶系的负荷能力时,细菌产生较大的氧化应激坏死[39]。Tsamesidis等[40]研究溶胶—凝胶法制得的生物活性玻璃陶瓷(bioactive glass ceramic,BGC)对红细胞的毒性时,用荧光分析法检测到所有BGC在浓度为0.125~0.500 g/L、37 ℃的环境下4 h后都会使ROS的生成增加,而增加的ROS也许是其抗菌的机制之一。ROS会对红细胞造成一定伤害,但BGC对红细胞的毒性具有浓度依赖性,在一定限度内,BGC能增加红细胞内的谷胱甘肽以对抗这种损伤。
3.5 扰乱细菌膜电位
BGs释放出的高浓度Ca2+可能会引起细菌膜电位的扰动或攻击细胞膜上的某些靶点,使细胞内容物流出,抑制细菌各种生理活动,这也可能是BGs的抗菌机制之一[30,34]。
膜电位是指细胞膜内外两侧的电位差,是由于细菌胞膜两侧离子分布不均以及不同离子顺各自电化学梯度扩散而形成的,对许多功能性膜蛋白具有调节作用,与ATP的合成、细胞增殖和分裂、细胞代谢、信号传导等生理活动有密切联系[41]。BGs在液体中释放的高浓度离子使细菌细胞膜两侧的电化学梯度发生变化[42]并对细胞膜施加一定压力,通道蛋白打开以减轻压力防止细胞裂解,细胞内的K+、Ca2+等顺浓度梯度被动流出[43],膜电位改变,三磷酸腺苷酶(ATPase)、呼吸链脱氢酶等的活性降低,导致ATP合成减少,细胞的代谢活动受到抑制[42]。
3.6 Ca/P沉积
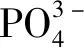
Zehnder等[44]用S53P4 BGs悬浮液处理被粪肠球菌定植的离体前磨牙根管,10 d后在扫描电镜下观察到S53P4 BGs均匀地黏附在根管内壁上,且细菌表面呈现出钙化外观,排除其他因素后可推测BGs的抗菌作用可能与细菌表面钙化有一定相关性。细菌表面的沉积物可能对细胞膜造成不规则的损伤或对细胞局部施加较大的压力,导致细胞坏死[45]。
3.7 作为载体释放抗菌离子
BGs不仅本身可以释放出离子发挥作用,也可作为载体掺入Ag+、Cu2+、Zn2+、Li+等金属离子[46],此时被称为介孔生物活性玻璃(mesoporous bioactive glass, MBG)。MBG是在生物活性玻璃和二氧化硅(MS)基础上研制的新型材料,其内部存在大量的纳米级孔道,因此具有更大的比表面积、更好的生物相容性及生物活性[47]。MBG因有序的介孔通道结构、较大的表面积和体积、较高的孔隙率作为释放抗菌剂的载体而备受关注[46]。
MBG负载的金属离子主要是通过破坏细菌的细胞壁和细胞膜、使细菌产生过多的ROS发生氧化应激反应等几种主要机制来达到持久的抗菌效果。例如常见的Ag+主要是通过和细菌细胞壁的—SH相互作用,停止呼吸链电子转移,使呼吸链的关键酶(如琥珀酸脱氢酶)失活,或者抑制细菌细胞壁蛋白质以及细菌DNA、RNA的合成和其他代谢途径,最终导致细胞死亡[20]。
当MBG作为载体时,缓释时间延长且释放率高,是骨科抗感染的重要材料之一[48]。但由于高浓度的金属离子会产生一定的细胞毒性[16],因此需要维持抗菌性能与生物相容性的平衡。
4 BGs抗菌作用影响因素
不同的BGs由于发挥作用的环境和条件不同,对不同细菌的抗菌效果也有很大差异,基于BGs的作用机制,它的生物活性主要受到玻璃组成、结构与释放出的离子浓度的影响[17]。
4.1 BGs自身因素
BGs的组成与结构:BGs按组成成分划分为硅酸盐系、磷酸盐系和硼酸盐系BGs,硼酸盐可抑制细菌蛋白质的合成,因此比一般的硅酸盐系BGs抵抗大肠杆菌的作用更强[49];硅酸盐系BGs按二氧化硅含量不同划分的45S5 BGs、S53P4 BGs、58S BGs等BGs中,S53P4 BGs目前被认为抗菌效果最强。Munukka等[29]通过比较6种不同的BGs和2种溶胶-凝胶衍生的材料对29种典型需氧菌的杀菌作用,发现这几种材料中,抵抗力最强的粪肠球菌仅在暴露于S53P4 BGs时完全失去生存能力,S53P4 BGs甚至还可以杀死多种耐药菌。
BGs的浓度:BGs的抗菌能力与浓度成正比,较低浓度的BGs在液体环境下也可抑菌和杀菌,随着BGs浓度增加,pH值升高速度加快,抗菌效果更好。Hu等[28]将不同含量的45S5 BGs加入到1 mL细菌悬浮液中,比较他们对金黄色葡萄球菌、表皮葡萄球菌和大肠杆菌的抗菌作用,发现随着BGs浓度的增加,溶液的pH值也随之增加,抗菌作用增强,超过50 mg/mL的BGs可拥有98%以上的杀菌率,该研究证实浓度对BGs抗菌效果的影响,也表明了BGs的有效抗菌浓度,在后续的BGs抗菌效果测定中被广泛应用。此外,许玉婷等[19]用不同浓度的BGs处理24 h血链球菌菌斑和48 h混合菌斑10 min后,在场发射扫描电镜和激光共聚焦显微镜下均可见菌斑中的细菌数目、菌斑密度和厚度随着BGs浓度的增加而减少。
BGs的材料学:BGs的物理性质如粗糙度、孔隙率和颗粒尺寸等可通过改变细菌黏附和比表面积等影响材料的抗菌性能[20]。粗糙度增加,BGs表面黏附的细菌增多[50],溶液中BGs颗粒周围较高的pH值或针状玻璃碎片更容易作用于细菌;此外,粗糙度、孔隙率增加与颗粒尺寸降低都能使比表面积增大,扩大BGs与液体环境的接触面积,离子扩散速度增加,局部pH和渗透压增大,抗菌效果更好[30]。
4.2 细菌因素
4.2.1 浮游细菌与生物膜细菌 生物膜主要包括内部的菌体和位于外周的自身分泌的胞外基质等物质,可吸附于物体表面[51],它的形成有利于细菌的生长,抵抗外界的药物,造成长期感染[33],BGs对浮游细菌的抗菌效果明显优于菌斑生物膜[52]。王梦婷等[52]用不同浓度的BGs处理血链球菌、具核梭杆菌、伴放线聚集杆菌这3种浮游细菌及其形成的单菌种菌斑和混合菌斑,结果得出BGs对菌斑的最小菌斑清除浓度明显大于对浮游细菌的MIC和MBC,这也许是因为生物膜的多糖基质可以充当物理屏障减缓抗菌剂进入菌斑内部[30]。
4.2.2 革兰氏阴性菌与革兰氏阳性菌 相对于革兰氏阳性菌,BGs对革兰氏阴性菌的抗菌效果更好,这可能是两种细菌之间细胞壁成分的差异导致的[28]。肽聚糖是革兰氏阳性菌细胞壁的主要成分,革兰氏阴性菌的细胞壁主要由磷脂、脂多糖和蛋白质构成,有一层外膜。有报道显示,纳米颗粒对大肠杆菌的损伤主要发生在外膜,因此革兰氏阴性菌对BGs有更高的敏感性可能是外膜损伤导致周质渗漏的原因[53]。
5 总结与展望
综上所述,BGs对口腔中常见的致病菌有抑菌和杀菌效果,并且因为BGs作用的机制是通过细胞损伤来破坏微生物,不会产生耐药性,所以作为口腔抑菌剂有强大的临床应用前景。
目前人们对BGs抗菌机制的研究多集中在相对宏观的层面,对于BGs是否影响了口腔致病菌基因改变的实验较少。此外,也有研究表明pH值升高并非BGs发挥抗菌作用的主要原因[54],且由于人体缓冲系统的存在,BGs抗菌作用的研究也难以在体内完成,目前主要以体外实验为主,因此需要加强和拓展BGs对细菌基因的作用和抗菌效应的体内实验研究,使BGs抑菌抗菌机制的研究更加深入透彻,也为BGs在临床上得到有效的应用奠定更强的理论基础。
