机械敏感离子通道Piezo1在糖尿病大鼠牙移动过程中的表达和功能研究
2022-07-29关禹哲蒋玉坤吴祖平李天成胡芝爱邹淑娟
关禹哲,蒋玉坤,吴祖平,李天成,胡芝爱,邹淑娟
随着人们生活水平的提高和对高品质生活的追求,越来越多的中老年人开始接受正畸治疗[1]。再加上近年来糖尿病发病率的迅速增长及年轻化趋势,使得正畸患者中患有糖尿病的人数和比例日益增加。研究表明,糖尿病状态下的高葡萄糖毒性、胰岛素绝对或相对缺乏、微血管病变等多种因素,可引起成骨细胞及破骨细胞活性变化、骨组织微结构改变、骨强度降低、骨脆性增加等骨骼系统异常变化,从而导致骨形态异常[2]。由于骨代谢异常,糖尿病患者在口颌系统常出现牙周病风险,拔牙术后牙槽骨创口愈合减慢[3-4];影响骨整合、增加种植体周围炎发生率,导致种植手术失败率增加[5]。目前有关糖尿病状态如何影响正畸过程中牙槽骨重建的研究还非常有限。
正畸牙移动的过程是牙槽骨不断重建的过程。牙齿受力后首先对牙周膜产生持续压缩或牵张作用,激发牙周膜内一系列生物学应答反应,从而将机械应力刺激转导为多种生物学信号,进一步引发相邻牙槽骨的适应性重建[6]。其中,压力侧牙槽骨重建以破骨细胞介导的骨吸收为主;张力侧骨重建以成骨细胞活跃的新骨沉积为主;骨吸收与骨形成二者共同参与骨重建过程,构成了正畸牙移动的生物学基础。关于糖尿病状态对正畸牙移动牙槽骨重建的确切影响,目前尚存争议:部分研究显示糖尿病状态下破骨吸收更为活跃,牙移动加速,同时伴随牙槽骨的骨质疏松[7];另一部分研究显示糖尿病导致骨重建能力降低,牙移动速率减慢[8];也有研究显示糖尿病对正畸牙移动无显著影响[9]。因此,需要明确糖尿病对正畸牙移动过程中牙槽骨重建的影响及具体机制,才能够对糖尿病正畸患者进行适宜的正畸治疗。
机械敏感性离子通道(mechanosensitive ion channel, MIC)是一种能感受细胞膜机械力变化,并将环境中的机械刺激转化为细胞内电信号或者化学信号的离子通道,在各种机械力传导过程中起重要作用[10]。Piezo是近年来发现的一种以Ca2+渗透为主的新型机械敏感性阳离子通道[11-12]。脊椎动物Piezo通道蛋白主要包括Piezo1和Piezo2两种类型。二者在组织器官分布、感知机械力种类和激活机制等方面均存在差别。关于Piezo1的研究表明,Piezo1通道不仅参与构成机械外力转导为细胞内化学信号的关键环节,同时也在维持骨稳态方面起着至关重要的作用[13-14]。研究发现,在大鼠正畸牙移动初期,牙周膜中Piezo1蛋白的表达显著增强[15]。人来源牙周膜细胞在静态压力刺激下,Piezo1的表达明显升高[16],提示Piezo1参与正畸牙移动的机械应力转导和骨重建过程。
本实验拟通过免疫荧光染色技术,在蛋白水平观察机械敏感性离子通道Piezo1蛋白在糖尿病大鼠牙移动中张力侧牙周组织的表达变化,以了解糖尿病状态牙周膜成纤维细胞对机械应力感知和成骨向分化的影响。结合糖尿病大鼠牙移动中张力侧成骨因子及牙槽骨相关参数的表达变化,初步探讨糖尿病状态下Piezo1蛋白影响正畸牙移动过程中牙槽骨重建的机制。
1 材料与方法
1.1 材料
组织切片机(Leica,德国),显微计算机断层扫描成像分析系统micro-CT(Scanco, μct50,瑞士),正置光学显微镜及采图系统(Leica,德国),Image-Pro Plus 6.0图像分析系统(MediaCybernetics,美国),0.012英寸正畸镍钛拉簧(杭州新亚齿科公司,中国),二氨基联苯(diaminobenzidine,DAB)显色试剂盒(北京中杉金桥生物技术有限公司,中国),链脲佐菌素(Sigma公司,美国),DAPI(Solarbio公司,中国),甘油(Solarbio公司,中国),Piezo1兔多克隆抗体(Abcam,美国),Osterix兔多克隆抗体(杭州华安生物技术有限公司,中国),Runx2兔多克隆抗体(杭州华安生物技术有限公司,中国),HE染色试剂盒(Solarbio,中国)。
1.2 实验动物及分组
选取由四川大学实验动物中心提供的8周龄雄性Wistar大鼠60只,体重为(200±10)g,均饲养于四川大学口腔疾病国家重点实验室。实验通过四川大学伦理委员会审查(编号WCHSIRB-D-2020-107),在保证正常通风、温度和湿度情况下,给予所有大鼠相同饲料和饮水,适应性喂养1周后随机分为对照组和糖尿病组,每组30只;对照组和糖尿病组又随机分为0、7、14 d 3个小组,每小组10只。
1.3 糖尿病模型建立
糖尿病组大鼠用高脂高糖饲料喂养,经5周后,按照体重每千克50 mg剂量腹腔注射链脲佐菌素,注射后3 d和7 d,检测随机血糖浓度,均≥16.7 mmol/L 者,为糖尿病成模大鼠;对照组注射等量柠檬酸缓冲液。建模成功后着手构建牙移动模型。
1.4 牙移动模型的建立
两组大鼠禁食1 d后,采用10%水合氯醛(由于建立正畸牙移动模型过程中不引起疼痛,故仅采用10%水合氯醛进行镇静和催眠,可满足建模需求)(0.35 mL/100 g)进行腹腔注射麻醉。之后将正畸镍钛拉簧分别固定于大鼠左侧上颌第一磨牙和中切牙间,施加40 g的力(图1)。在第0天(施加正畸力前一天)以及牙齿移动后第7天和14天分别处死(n=10)。动物处死后解剖获取包含上颌磨牙及周围牙周组织的样本,去除多余软组织后使用4%多聚甲醛固定24 h。

图1 大鼠正畸牙移动模型Fig.1 Orthodontic tooth movement model in rats
1.5 微计算机断层扫描技术(microcomputed tomography,micro-CT)及分析
在规定时间点获得组织样品后,于4%多聚甲醛溶液中固定组织24 h。高分辨率micro-CT 50系统进行扫描组织。本研究选择左侧上颌第一磨牙远颊根张力侧中部的200 μm×200 μm×200 μm立方体小梁骨作为感兴趣区域进行分析骨参数指标。主要的骨参数指标包括骨体积/总体积(BV/TV)比、小梁间距(Tb.Sp)、小梁数量(Tb.N)和小梁厚度(Tb.Th)。
1.6 标本制备及组织学染色
1.6.1 标本制备 micro-CT扫描完毕后,动物组织标本在14%乙二胺四乙酸(pH=7.4)中脱钙1个月。组织标本乙醇梯度脱水、二甲苯透明后采用石蜡包埋,沿上颌牙列矢状方向切割制备5 μm石蜡切片。按照常规步骤进行苏木素-伊红(hematoxylin and eosin,HE)染色,光镜下观察第一磨牙远颊根远中张力区组织结构变化,牙槽骨形态结构,牙周膜组织形态结构和细胞种类。
1.6.2 免疫荧光染色 石蜡切片经60 ℃烘烤1 h后用二甲苯脱蜡,梯度乙醇脱水,95 ℃抗原修复20 min,山羊血清封闭30 min后,滴加一抗Piezo1(1∶200),4 ℃过夜。第2天室温孵育Alexa Fluor 488山羊抗兔荧光二抗1 h后,DAPI复染细胞核,甘油封片。荧光显微镜观察染色切片。图像定量分析由Image Pro Plus 6.0完成。
1.6.3 免疫组化染色 石蜡切片经烘烤、脱蜡、脱水、抗原修复和血清封闭后,滴加一抗:Runx2(1∶100)、Osterix(1∶100),PBS缓冲液做阴性对照,4 ℃过夜。抗体与目的蛋白质结合后,滴加二抗生物素化山羊抗兔IgG孵育30 min(37 ℃)。二抗与一抗结合后,再滴加辣根过氧化酶标记链霉素卵蛋白试剂孵育30 min(37 ℃)。使用DAB显色试剂盒显色,苏木素轻度复染,脱水,透明,中性树胶封片。光学显微镜下观察并使用Image Pro Plus 6.0软件分析组化染色的积分光密度平均值(MOD)。
1.7 统计学方法
使用GraphPad Prism 7对数据(平均值±SD)进行统计分析。组间比较采用单因素方差分析(One-way ANOVA)法,检验水准α=0.05。P<0.05被认为具有统计学意义。
2 结 果
2.1 大鼠糖尿病模型的建立
本研究采用高脂高糖饮食结合单次链脲佐菌素注射构建大鼠糖尿病模型,以模拟临床中肥胖引起的2型糖尿病患者。注射柠檬酸钠缓冲液的对照组大鼠健康状况良好,正常饮食、进水,毛色有光泽,体重逐渐增加。糖尿病组大鼠腹腔注射链脲佐菌素3 d后开始表现出多尿、多饮、多食等情况,且体毛色泽逐渐暗沉,体重增长减缓,后期逐渐下降。注射链脲佐菌素后第1、5、9、13天检测大鼠血糖浓度,结果显示大鼠血糖均>16.7 mmol/L,说明糖尿病组大鼠血糖稳定,糖尿病建模成功。
2.2 micro-CT分析
为检测糖尿病对正畸牙移动过程中牙槽骨改建的影响,采用micro-CT检测并分析了正畸牙移动初期、7 d和14 d第一磨牙远颊根张力侧中部骨组织相关参数。牙移动初期(0 d),糖尿病组BV/TV和Tb.Th小于对照组,并且糖尿病组Tb.Sp大于对照组,差异有统计学意义,说明糖尿病大鼠的牙槽骨密度显著低于对照组。牙移动7 d和14 d时,糖尿病组和对照组BV/TV均下降;与0 d相反,糖尿病组的BV/TV在牙移动7 d和14 d后显著高于对照组。7 d和14 d两组Tb.Sp和Tb.N无显著差异(表1)。
表1 大鼠牙移动张力侧骨质分析Tab.1 Analysis of bone quality on tension side during orthodontic tooth movement in rats
2.3 HE染色
本研究采用HE染色观察糖尿病对正畸牙移动过程中第一磨牙牙周组织结构、形态和细胞行为的影响。牙移动前(0 d),糖尿病组和对照组骨小梁结构清晰、交织成网状,虽然糖尿病组骨小梁较对照组疏松,但二者牙周膜均排列规整(图2)。牙移动7 d,对照组张力侧牙周膜变宽、血管扩张明显,牙槽骨表面可见较多成骨细胞,而糖尿病组牙槽骨表面成骨细胞数量明显少于对照组;牙移动14 d,对照组牙槽骨表面可见新骨形成,并且沿新生骨表面可见排列整齐的成骨细胞,而糖尿病组虽然成骨细胞数量较7 d有所增加,但张力侧牙槽骨表面几乎无新生骨形成。由此可以推测,糖尿病状态下成骨细胞的增殖和分化受到抑制,牙移动张力侧新生骨组织形成显著减少。

图2 牙周组织变化(HE染色 ×200)Fig.2 Periodontal tissue changes(HE staining ×200)
2.4 Piezo1免疫荧光染色
本研究采用免疫荧光染色检测正畸牙移动过程中机械敏感离子通道Piezo1的表达情况,并分析糖尿病对Piezo1表达的影响。未施加正畸机械力时(0 d),对照组和糖尿病组张力侧几乎检测不到机械敏感性离子通道Piezo1的表达(图3)。牙移动7 d,对照组牙周膜中Piezo1的表达显著增加(MOD=18.80),14 d表达较7 d降低;糖尿病组Piezo1的表达虽然在牙移动7 d增加,但是其表达仍然显著低于对照组(MOD=11.14),且差异具有统计学意义;与对照组趋势相似,14 d糖尿病组Piezo1的表达减少。牙移动14 d,随着牙移动距离的增大,弹簧施加的应力逐渐减小,牙周膜感受的应力也相应减小,因此对照组和糖尿病组14 d Piezo1的表达均表现出降低趋势。以上结果说明,施加正畸机械力激活了牙周膜中Piezo1离子通道,而糖尿病状态下Piezo1离子通道的激活受到抑制。
2.5 免疫组化结果
为进一步探讨糖尿病状态下Piezo1通道影响正畸牙移动牙槽骨重建的机制,该研究采用免疫组化检测了成骨分化关键转录因子Runx2和Osterix的表达,以分析Piezo1对成骨分化的影响。未施加正畸机械力时(0 d),对照组和糖尿病组大鼠张力侧牙周组织中均检测到少量Osterix和Runx2的表达,虽然对照组Osterix的表达高于糖尿病组,但二者无统计学差异。牙移动7 d,对照组成骨分化关键转录因子Osterix和Runx2的表达均显著增加,牙移动14 d对照组Osterix表达量较7 d略有下降,但仍高于0 d,而Runx2表达量持续增高,表达量与7 d持平;糖尿病组Osterix的表达在7 d也明显增加,但仍然显著低于对照组,且14 d表达降低(图4);而糖尿病组Runx2的表达在7 d略微增加,与0 d比差异无统计学意义,且在14 d降低到未施加正畸应力的表达水平(图5)。由此说明,牙移动过程中张力侧Osterix和Runx2的表达增加,促进张力侧新生骨组织的形成,而糖尿病阻碍了Osterix和Runx2的表达,成骨显著受到抑制,这可能与糖尿病状态下Piezo1离子通道的激活受到抑制相关。
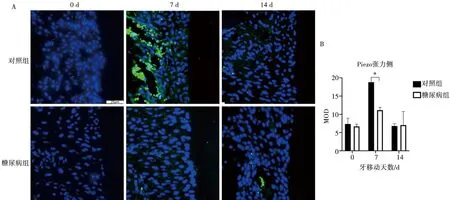
A:免疫荧光染色-Piezo1通道( ×400);B:施加正畸力后大鼠牙周组织Piezo1通道表达水平(*:P<0.05)

A:大鼠牙移动张力侧免疫组化染色-Osterix( ×200);B:施加正畸力后大鼠牙周组织Osterix 表达水平(*:P<0.05)
3 讨 论
正畸牙移动是牙槽骨不断重建的过程,Osterix和Runx2是成骨分化关键转录因子,参与成骨信号传导和调控[17]。加力后7 d及14 d, 糖尿病大鼠牙移动张力侧牙周膜内成骨因子Osterix和Runx2的表达均低于健康大鼠,且在7 d有统计学差异。并且,micro-CT显示糖尿病大鼠张力侧骨小梁排列较健康大鼠疏松,骨密度降低,说明了糖尿病状态下,成骨活性受到抑制,从而影响张力侧新生牙槽骨形成。冯智敏等研究结果也发现糖尿病大鼠牙移动骨改建过程中张力侧成骨细胞数显著少于健康大鼠,成骨受到抑制[18]。正畸牙移动过程中健康大鼠BV/TV降低是由于牙移动张力侧新生骨形成,新生骨的密度较原来的牙槽骨密度低,分析选区过程中新生骨组织的纳入降低了BV/TV的测量值;而糖尿病大鼠因骨改建速率较健康大鼠低,牙移动距离较健康大鼠小,张力侧新生骨组织范围小,同样的分析选区更多地纳入了原有的牙槽骨,因此糖尿病大鼠在7 d和14 d时BV/TV下降相较健康大鼠少,两者统计学分析有显著差异。

A:大鼠牙移动张力侧免疫组化染色( ×200); B:施加正畸力后大鼠牙周组织Runx2 表达水平(*:P<0.05,**:P<0.01)
随着人们对糖尿病研究的不断深入,发现糖尿病状态下的骨代谢受到影响。机械敏感性离子通道Piezo1能感知机械应力,并通过钙离子通道影响成骨代谢。本实验通过免疫荧光标记发现,Piezo1蛋白在健康大鼠张力侧牙周膜成纤维细胞中大量表达,而固有牙槽骨中的成熟骨细胞中未见表达,与康婷的研究结果[15]一致。在牙移动过程中,Piezo1的表达受正畸应力刺激随时间逐渐增加,在7 d达到高峰,而后降低,并在14 d恢复至较低水平。这与大鼠牙移动过程中牙周组织改建的变化一致。由于牙周膜中的成纤维细胞处于感受咀嚼力的前沿,Piezo1离子通道在该细胞内的表达活跃,说明Piezo1参与了正畸牙移动的机械应力转导过程[15]。糖尿病状态下,虽然正畸应力刺激能显著激活Piezo1蛋白的表达,但糖尿病组张力侧牙周膜内Piezo1蛋白表达仍显著低于健康大鼠。由此,我们推测,糖尿病状态抑制了应力刺激下牙周膜成纤维细胞中Piezo1的表达水平。
本实验未探究糖尿病状态下其他离子通道在牙周膜中的表达变化,但由于Piezo1离子通道具有完整的机械敏感性[19-20],仍然可以推测糖尿病通过影响该通道在牙周膜中的表达影响正畸牙移动应力转导,进而影响张力侧牙槽骨重建。Piezo1的正常功能对维持牙移动过程中张力侧牙槽骨重建起到关键作用[21]。本实验证实了正畸牙移动机械应力激活了牙周膜中机械敏感性离子通道Piezo1的表达,而糖尿病状态下Piezo1的表达显著受到抑制,并且牙移动张力侧成骨分化关键转录因子Osterix和Runx2的表达降低。鉴于牙周膜是牙周组织中对牙齿受到的机械力刺激进行感受的第一效应器,是维持牙周稳态、调控骨组织重建的关键效应部位[22-23],而Piezo1作为与机械转导及感受有关的机械敏感离子通道,可能在其中扮演了感受器的角色[24-25]。因此,我们推测糖尿病状态通过影响机械敏感性离子通道Piezo1的功能,从而抑制正畸牙移动中力学信号的有效转导,并最终降低张力侧牙槽骨重建的效率。该发现为进一步研究糖尿病对正畸牙移动的影响以及Piezo1感知应力刺激调控牙槽骨重建的作用机制奠定了一定的基础,为糖尿病患者安全有效的正畸临床治疗提供科学依据。
