ADA、CCL19在系统性红斑狼疮患者中的表达水平及临床意义*
2022-07-29彭子辉程井军李红涛丁德光
彭子辉,程井军,李红涛,丁德光,王 解△
1.襄阳市中心医院/湖北文理学院附属医院皮肤科,湖北襄阳 441003;2.湖北中医药大学国医堂中医科,湖北武汉 430061;3.襄阳市中医医院皮肤科,湖北襄阳 441000;4.湖北省中医院风湿免疫科,湖北武汉 430075
系统性红斑狼疮(SLE)好发于20~40岁的育龄期女性,以淋巴细胞异常活化、抗体和免疫复合物形成为主要特征,该病临床表现复杂,易复发,常累及血液、神经、消化等系统及肺、肾等器官组织[1-2]。SLE根据病情进展需调整治疗方案,活动期患者以控制病情为主,病情稳定后维持治疗[3]。及时诊断SLE并动态监测疾病活动度,对临床制订针对性治疗方案极为关键。自身免疫功能紊乱及炎性反应贯穿SLE整个发病过程[4]。腺苷脱氨酶(ADA)主要存在于淋巴组织、胸腺组织等,介导了免疫细胞的发育和分化成熟,并调节免疫系统稳态[5]。ADA活性异常参与了类风湿关节炎、儿童社区获得性肺炎的发病过程[6-7]。趋化因子配体19(CCL19)主要由炎症细胞合成,通过与其特异性受体趋化因子受体7(CCR7)结合后趋化炎症细胞定向迁移定植于特定靶器官,进而诱发免疫功能紊乱和炎症反应[8]。CCL19参与了儿童支气管哮喘等炎症性疾病发病过程[9]。关于ADA、CCL19联合检测在SLE发病过程中的作用,目前鲜见报道。本研究旨在探讨ADA联合CCL19检测对SLE的诊断价值及其与疾病活动度的关系。现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2017年1月至2018年12月襄阳市中心医院收治的116例确诊为单纯性SLE患者(病例组)的临床病历资料,纳入标准:(1)典型临床症状如发热、蝶形红斑、关节痛等,并经血常规、免疫学、自身抗体等实验室检查及磁共振成像、超声等影像学检查综合确诊为SLE;(2)符合美国风湿病学会制定的诊断标准[10];(3)年龄18~75岁;(4)临床病历资料完整,无重要数据缺失。排除标准:(1)心脏功能不全者及肝、肾功能障碍;(2)急、慢性炎性反应性疾病;(3)类风湿性关节炎、强直性脊柱炎、结核病等自身免疫性疾病;(4)纳入研究前3个月内有手术史或重大创伤;(5)入组前1个月内接受过免疫抑制剂或激素类药物治疗;(6)妊娠期及哺乳期的女性;(7)纳入研究前正在接受规范临床治疗;(8)精神疾病及恶性肿瘤。采用疾病活动度指数(SLEDAI)评分表[11]对入院时的患者进行评分,并根据评分将患者分为无活动组(SLEDAI评分0~<5分),共37例;轻度活动组(SLEDAI评分5~<10分),共32例;中度活动组(SLEDAI评分10~<15分),共25例;重度活动组(SLEDAI评分≥15分),共22例。并于同期随机选取40例性别、年龄与病例组患者相近的健康志愿者为对照组,对照组近期未服用过任何药物、也无任何疾病史。病例组与对照组性别、年龄、体重指数(BMI)等基线资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究在获得医院伦理委员会的批件后开展,研究过程中研究对象及家属均在知情同意书上签字。
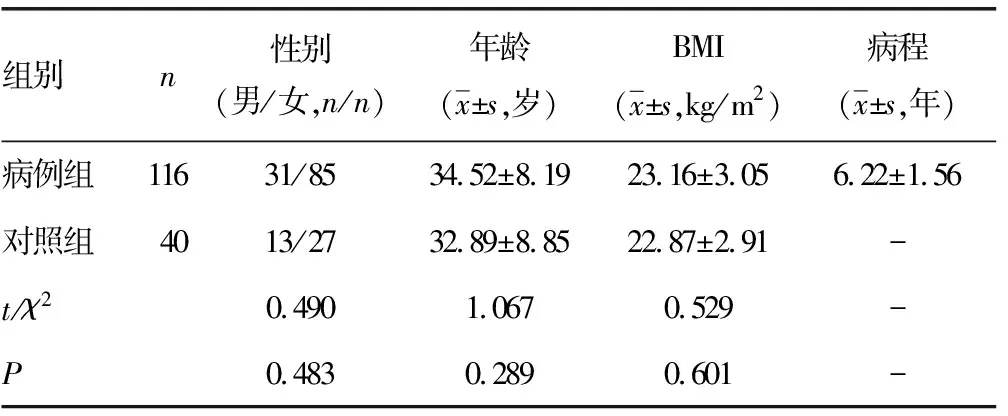
表1 病例组与对照组基线资料比较
1.2方法
1.2.1治疗措施 SLE患者入院后,针对患者的病情严重程度口服不同剂量天津天药药业股份有限公司的甲泼尼龙片(规格:每片4 mg;国药准字号:H20020224)治疗,4~48毫克/次,1 次/天;同时采用江苏盛迪医药有限公司的环磷酰胺(规格:每支0.2 g;国药准字:H32020857)冲击治疗,参考体表面积500~600 mg/m2,并以20~30 mL生理盐水稀释后静脉注射,1周1次,连续2次后间隔1~2周再重复。所有患者完成治疗后定期随访。
1.2.2血清ADA、CCL19水平检测 采集SLE患者入院次日以及出院前的清晨空腹周静脉血4 mL,健康体检者于入院当日清晨抽取,将血液置于含乙二胺四乙酸的抗凝试管中,室温下静置1 h,以3 000 r/min的转速离心10 min,离心半径12 cm,留取上清液置于-80 ℃环境下保存。采用日立7600-110全自动生化分析仪检测血清ADA水平,试剂盒由四川迈克生物科技股份有限公司提供,采用酶联免疫吸附法检测血清CCL19水平,检测试剂盒由美国R&D公司提供,酶标仪购于美国Bio-Rad公司。检测过程严格参照说明书进行。
1.2.3随访 通过电话或门诊的方式定期随访出院后的患者预后情况,随访时间为2年,第1年每3个月随访1次,第2年每6个月随访1次,随访终点为患者SLE病情复发,复发标准由临床医生判断,并符合相关文献[10]。
2 结 果
2.1病例组与对照组治疗前血清ADA、CCL19水平比较 病例组治疗前血清ADA、CCL19水平高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 病例组与对照组治疗前血清ADA、CCL19水平比较
2.2各组患者血清ADA、CCL19水平比较 SLE患者治疗后血清ADA、CCL19水平均较治疗前降低,差异均有统计学意义(P<0.05);不同病情严重程度SLE患者治疗前血清ADA、CCL19水平比较,差异有统计学意义(P<0.05),组间两两比较,轻度活动组、中度活动组、重度活动组患者血清ADA、CCL19水平高于无活动组,中度活动组、重度活动组患者血清ADA、CCL19水平高于轻度活动组,重度活动组患者血清ADA、CCL19水平高于中度活动组,差异均有统计学意义(P<0.05);不同病情严重程度的SLE患者治疗后血清ADA、CCL19水平比较,差异无统计学意义(P>0.05)。见表3。

表3 各组患者血清ADA、CCL19水平比较
2.3SLE患者血清ADA、CCL19水平与SLEDAI评分的相关性 SLE患者治疗前血清ADA、CCL19水平与SLEDAI评分呈正相关性(r=0.732、0.795,P<0.05)。
2.4血清ADA、CCL19对活动期SLE的诊断价值 以活动期(包括轻度、中度和重度活动期)SLE患者(共计79例)为阳性样本,以无活动SLE患者(共计37例)为阴性样本绘制ROC曲线评估血清ADA、CCL19对活动期SLE患者的诊断价值,结果显示,ADA诊断活动期SLE的AUC为0.820(95%CI:0.782~0.858,P<0.001),截断值为22.04 U/L,约登指数为0.58,灵敏度、特异度分别为0.83、0.75;CCL19诊断的AUC为0.843(95%CI:0.810~0.896,P<0.001),截断值为257.60 ng/L,约登指数为0.62,灵敏度、特异度分别为0.85、0.77;ADA联合CCL19诊断的AUC为0.893(95%CI:0.850~0.935,P<0.001),约登指数为0.68,灵敏度、特异度分别为0.89、0.79。见图1。
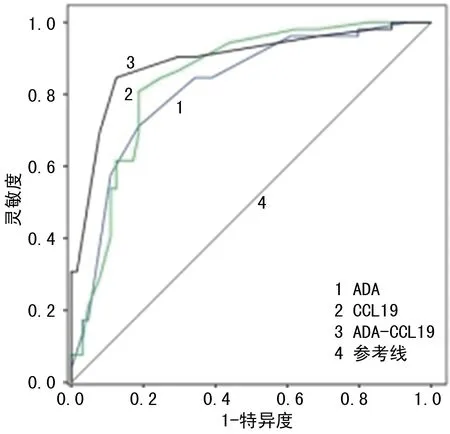
图1 血清ADA、CCL19诊断活动期SLE的ROC曲线
2.5血清ADA、CCL19对SLE患者复发时间的影响 SLE患者出院后均通过门诊或电话的方式成功随访,随访时间2年,随访期间共有49例患者复发,复发率42.24%,复发患者血清ADA、CCL19水平均高于未复发患者,差异有统计学意义(P<0.05)。见表4。

表4 SLE复发患者与未复发患者血清ADA、CCL19水平比较
2.6血清ADA、CCL19对SLE患者预后的预测价值 SLE患者出院后2年内,根据SLE患者预后情况分为复发患者和未复发患者,绘制ROC曲线评估血清ADA、CCL19对预后的预测价值,结果显示,ADA预测复发的AUC为0.799(95%CI:0.765~0.839,P<0.001),截断值为47.18 U/L,约登指数为0.46,灵敏度、特异度分别为0.77、0.69;CCL19预测复发的AUC为0.807(95%CI:0.776~0.845,P<0.001),截断值为479.58 ng/L,约登指数为0.51,灵敏度、特异度分别为0.79、0.72;ADA联合CCL19预测复发的AUC为0.865(95%CI:0.829~0.891,P<0.001),约登指数为0.63,灵敏度、特异度分别为0.85、0.78。见图2。
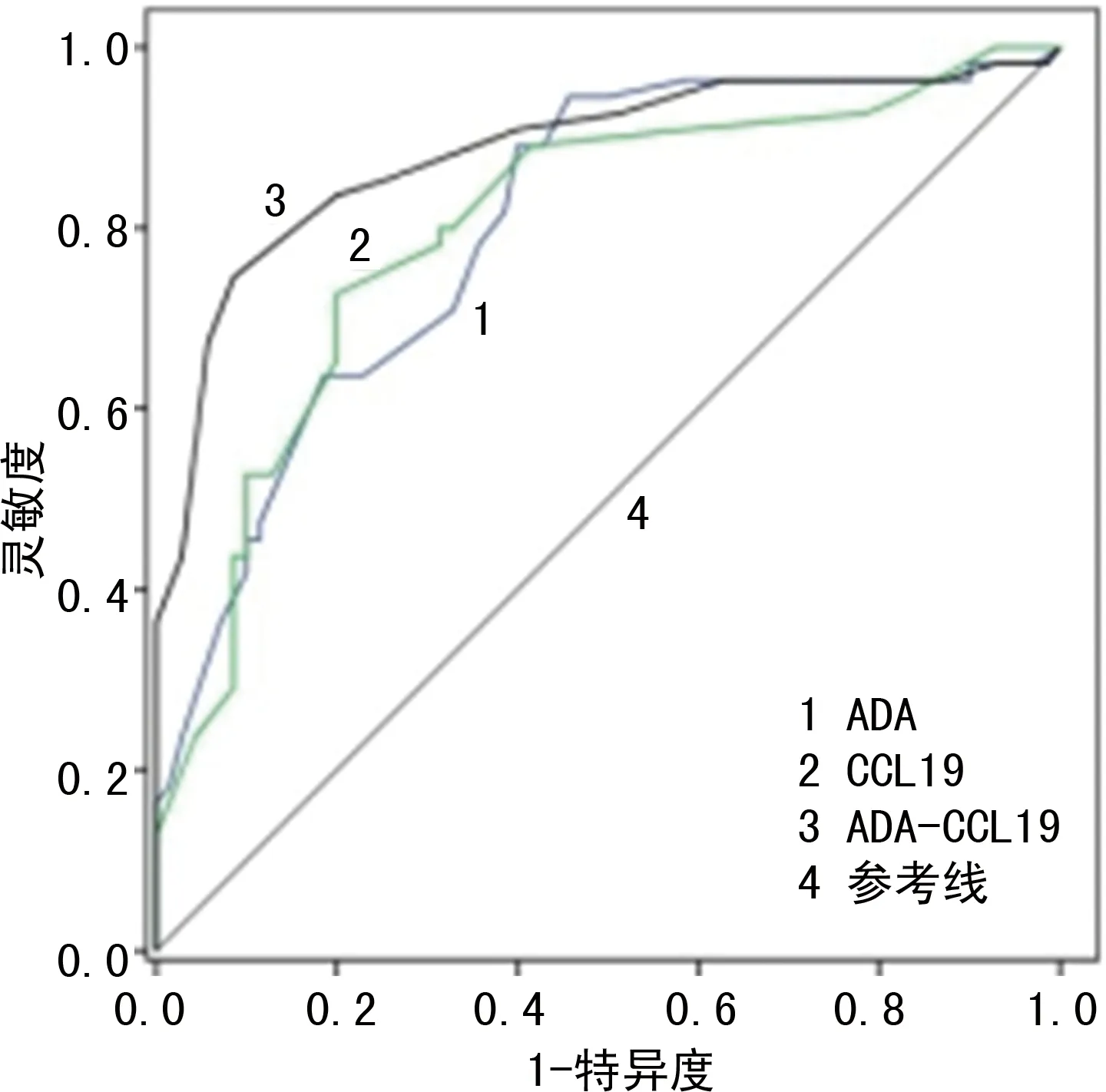
图2 血清ADA、CCL19对SLE患者预测预后的
3 讨 论
SLE是遗传与环境等多种因素共同作用导致机体免疫功能调节紊乱,并可累及多靶向系统的自身免疫性疾病,临床症状包括发热、面部蝶形红斑、四肢关节不对称性和间歇性疼痛等,该病治疗周期长,病情易反复发作,治疗难度大[12]。流行病学调查结果显示,SLE具有发病率高、病情迁延难愈等特点,严重影响患者生命质量,早期诊断SLE并判断病情活动度,是临床实施针对性治疗措施的关键[13]。目前,临床根据典型症状、影像学检查、自身抗体及免疫学指标等实验室检测等诊断SLE,但各指标特异度较差,需与类风湿性关节炎、系统性血管炎等鉴别诊断,常发生误诊和漏诊[14]。因此,迫切需要寻找其他有效的生化指标辅助临床诊断SLE、评估疾病活动度及预测预后复发情况。
ADA是基因位于人第20对染色体上的嘌呤降解酶,广泛分布在胸腺、脾及其他淋巴组织中,其主要生理作用是分解嘌呤核苷酸产生肌苷,并进一步合成黄嘌呤而经尿酸排出。ADA还与机体细胞免疫活性有关,能够促进淋巴细胞特别是T细胞的增殖和分化,因此介导了多种免疫缺陷病的发病过程[15]。KOH等[16]研究显示,结核分枝杆菌感染人体并破坏T淋巴细胞,导致ADA大量释放入血,其水平反映了结核分枝杆菌感染情况,因此可作为辅助诊断肺结核及评估病情严重程度的指标。程卫东等[17]发现,ADA在化脓性脑膜炎患者中表达上调,并与疾病严重程度密切相关,推测其机制,可能是因为细胞免疫是化脓性脑膜炎重要的病理生理基础,脑膜炎导致机体免疫调节功能紊乱,T淋巴细胞活化并异常增多,ADA大量分泌。此外,ADA还参与了病毒性肝炎等免疫炎症性疾病的发病过程[18]。赵冠华等[19]的系统性评价发现,由于样本量较小,ADA在SLE发病过程中的临床意义仍存在争议。本研究结果显示,SLE患者治疗前血清ADA水平高于健康体检者,说明ADA参与了SLE发病过程,可能与以下机制有关:SLE发生时激活炎症细胞释放炎性因子,诱发炎性反应,机体通过代偿性机制导致T淋巴细胞增殖及分化,ADA活性增强并抑制机体的内源性抗炎因子腺苷水平,进一步加重炎性反应,破坏免疫稳态,免疫系统攻击自身而致SLE发生[5]。结果进一步显示,随着SLE疾病活动度增强,ADA水平不断升高,Pearson积矩相关性分析发现ADA水平与SLEDAI评分呈正相关,提示ADA可作为评估SLE疾病活动度的重要指标,对指导临床制订诊疗方案有参考价值。
趋化因子相对分子质量为8 000~16 000,是一类结构相似的小分子多肽,具有趋化免疫调节细胞定向游走并定植在不同靶器官,进而发挥免疫炎性反应等病理生理功能。CCL19属趋化因子家族成员,主要由活化的内皮细胞以及T淋巴细胞合成并分泌,通过趋化树突状细胞归巢而转变为成熟细胞,进而激活T淋巴细胞,促进炎症反应发生和参与免疫调节功能[20]。研究显示[21],CCL19与其配体CCR7特异性结合后通过趋化作用参与自身免疫性疾病发生过程。康晓燕[9]研究显示,CCL17表达上调参与了支气管哮喘发病过程,其机制为CCL19与CCR7结合后,在支架蛋白Gabs1的调控下,趋化呼吸道树突状细胞传递抗原信号到Th细胞,导致Th分化而致大量炎性因子释放,也有可能是因为CCL19与CCR7结合后激活PI3K/Akt信号通路,导致肿瘤坏死因子-α大量表达,最终促进支气管哮喘发病。林丽[22]发现,CCL19在类风湿性关节炎患者中表达上调,并与T淋巴细胞亚群正相关,早期测定CCL19可评估患者预后,指导临床开展相应的干预治疗。本研究中,SLE患者治疗前血清CCL19水平较健康体检者明显升高,提示CCL19参与了SLE发病过程,可能是因为SLE发病过程中,B细胞免疫异常,具有免疫调节功能的B细胞数量急剧减少,自身反应性B细胞比例显著上调,最后的结局是CCR7浓度降低,CCL19与CCR7结合减少,导致CCL19水平在血清中异常升高。也有可能是因为CCL19通过调节补体C3、C4水平及IgG、 IgM、IgA等免疫球蛋白的表达而参与介导SLE发病。此外,结果还显示,CCL19与SLE疾病活动度呈正相关关系,说明CCL19可作为评估SLE疾病活动度的重要指标。
绘制ROC曲线结果显示,ADA和CCL19均有一定的诊断价值,并且两指标联合检测的AUC可达0.893,灵敏度和特异度分别为0.89和0.79,优于单一指标的诊断结果,提示联合检测对明确SLE疾病活动度的价值较高。上述结果表明,当患者入院后,通过检测血清ADA和CCL19可辅助临床诊断其活动度,并进一步根据其水平的高低判断活动度,进而评估患者病情严重程度,为临床制订治疗策略提供参考,而在治疗过程中,也可采用两血清生化指标动态监测疾病活动度,以及时调整治疗方案。SLE病情易复发,给治疗带来难度,本研究显示,SLE出院后2年内复发的比例高达42.24%,复发患者血清ADA、CCL19水平显著高于未复发者,ROC曲线结果显示,ADA和CCL19对出院后患者复发具有一定预测价值,AUC分别为0.799、0.807,联合检测预测复发的AUC为0.865,此时灵敏度和特异度为0.85和0.78,该结果说明,血清ADA和CCL19不仅可以作为诊断SLE活动度和评估病情严重性的生化指标,还可有效预测出院后患者的复发情况,这对制订早期干预措施减少复发,改善预后具有重要意义。
综上所述,血清ADA和CLL19可辅助临床诊断SLE疾病活动度和评估病情严重程度,同时还能预测患者预后。本研究为单中心的小样本回顾性研究,需扩大样本量开展多中心前瞻性队列研究以进一步证实其临床价值。
